INTRODUCCIÓN
Los ritmos biológicos son las variaciones temporales de los procesos fisiológicos. Sus períodos oscilan desde milisegundos hasta años. Los ritmos circadianos, períodos fisiológicos de aproximadamente 24 horas, coordinan la actividad temporal de los procesos bioquímicos, sistémicos y de comportamiento de la mayoría, si no, de todos los seres vivos del planeta. Mecanismos endógenos mantienen los ritmos circadianos, pero estos se pueden sincronizar mediante factores externos. El ciclo de luz y oscuridad generado por la rotación de la Tierra es el sincronizador, o Zeitgeber (término alemán que significa ''dador de tiempo'') más prevalente 1. Aunque con mucha menor intensidad que la luz, otros Zeitgebers en humanos son los aspectos socioculturales del entorno, como los horarios de alimentación y los momentos de mayor actividad, entre otros 1. La adaptación del sistema circadiano a señales predecibles del medio ambiente prepara el organismo para optimizar los procesos fisiológicos a las horas más eficientes del día. En el mundo industrializado, fenómenos como la exposición prolongada a la luz y el transporte transatlántico, entre otros, afectan la homeostasis del reloj endógeno, y han sido asociados a un aumento en el riesgo de problemas en la salud humana 2) (3. En particular, uno de los procesos más importantes del cuerpo, la proliferación celular, está regulado por el reloj biológico y su alteración puede tener repercusiones directas en la regulación del cáncer. En efecto, por la fuerte evidencia epidemiológica 4) (5, la Organización Mundial de la Salud concluyó que ''la disrupción del ritmo circadiano es probablemente cancerígena para los humanos'' 6.
FUNDAMENTOS MOLECULARES DEL RELOJ BIOLÓGICO
El sistema circadiano está conformado por un reloj maestro, el núcleo supraquiasmático (NSQ), ubicado en el hipotálamo 7. La actividad de este pequeño núcleo pareado, conformado por alrededor de 200.000 neuronas, mantiene autónomamente el ritmo endógeno de aproximadamente 24 horas en humanos 8) (9. Este núcleo recibe información de neuronas especializadas en la retina acerca de la intensidad de la luz, y así, sincroniza el reloj endógeno con los períodos de luz y oscuridad del medio ambiente 10) (11. Solo las neuronas del NSQ mantienen autónomamente el ritmo de 24 horas, y por eso conjuntamente se llaman el ''Reloj maestro''. Sin embargo, todas las células del cuerpo tienen la maquinaria para mantener el ritmo, pero deben ser sincronizadas por el reloj maestro mediante señales hormonales y neurales 8) (2.
El reloj molecular de cada célula consiste en la transcripción y traducción cíclica de genes circadianos. Los componentes principales del circuito temporal de las células son los genes clock y bmal1, cuyos productos se dimerizan en el complejo CLOCK/BMAL1 y forman lo que se conoce como el brazo positivo del reloj13) (14. Este complejo funciona como activador de la transcripción, por medio de elementos E-box de los genes period y cryptocrome al principio de cada día 12. Las proteínas PER y CRY se acumulan durante el día y forman un complejo represor PER/CRY, el brazo negativo del reloj, que al principio de la noche inhibe la actividad de CLOCK/BMAL1 13) (14. Este circuito de activación e inhibición genéticas dura aproximadamente 24 horas, y es finalmente regulado por el resto de la maquinaria del reloj molecular, que incluye los receptores nucleares Rev-erbβ y Roaα 8,14. El mecanismo molecular fue elucidado originalmente en la mosca de la fruta y aunque las secuencias de los genes no son las mismas, el proceso es altamente conservado filogenéticamente con diferentes grados de complejidad en otras especies incluyendo a los humanos 15.
REGULACIÓN DEL CICLO CELULAR POR EL RELOJ BIOLÓGICO ENDÓGENO
Los genes reloj en su oscilación rítmica ejercen influencia sobre el control de otros procesos al nivel molecular, en particular, sobre los estadios del ciclo celular, la apoptosis y la reparación del ADN en las células 2) (16. Estudios en cianobacterias, plantas, vertebrados 15) (17 y humanos 18 han mostrado que los componentes de los ritmos circadianos regulan diferentes genes del ciclo celular, incluyendo c-myc, wee1, p21 y las ciclinas, que permiten la transición de la célula a través del ciclo celular 16) (19) (20.
La replicación del ADN o fase S del ciclo celular de bacterias y otros organismos unicelulares ocurre en horas de la noche y el ciclo celular tiene una duración de alrededor de 24 horas 21. Por el contrario, en vertebrados la replicación celular ocurre hacia las horas de la tarde 22. En humanos, la fase S de la mucosa gastrointestinal, la piel y la médula ósea corresponde al medio día 18 o a las horas de la tarde 23) (24) (25. Independientemente de la hora de mayor replicación del ADN, el ciclo celular está fuertemente influenciado por los ritmos circadianos y tiene una duración de 24 horas 19) (26.
La regulación del ciclo celular por el reloj biológico no se limita a la transición de G1 a S (replicación), sino que también involucra el paso de G2 a M (mitosis). Se ha encontrado que las proteínas WEE1 y p21 inhiben la transición de G2 a M y de G1 a S, respectivamente 27) (28. Tanto wee1 como p21 tienen expresión circadiana y son regulados por los genes reloj 27. La regulación de la proliferación incluye la inactivación del gen p21 por parte de BMAL1, que hace que la vía de p53 no funcione correctamente y no interrumpa el ciclo celular en caso de daño en el ADN 29. Por otro lado, estudios in vitro han mostrado que el gen reloj per1 disminuye la expresión de p21, wee1, ciclina 1 y cdc2, aumenta la de c-myc y promueve la apoptosis 19) (20.
Además de controlar la entrada y el paso a través del ciclo celular, el sistema circadiano controla los procesos responsables de la farmacocinética y el metabolismo de los medicamentos, haciendo aún más relevante el estudio de los efectos del reloj biológico en procesos patológicos 30. Las enzimas de tipo I, que en su mayoría son microsomales, están coordinadas para expresarse cuando los animales están activos y es más probable la ingestión de alimentos 31. Las de tipo II, que en su mayoría son lipofílicas y solubilizan los medicamentos para su excreción, se expresan mayormente en el período contrario al de actividad del día, pero cada grupo de enzimas tiene una hora específica en que funciona óptimamente 31. Por último, las de tipo III son transportadores que llevan los medicamentos desde la sangre hacia los órganos de excreción y tienen expresión circadiana en las diferentes regiones de los órganos donde ocurre el transporte 31. En este grupo, se encuentran los transportadores de la familia ABC, como MDR (multidrug resistant protein 1) que es responsable de la excreción de medicamentos quimioterapéuticos de las células tumorales 31. El entendimiento de las variaciones diurnas en la función de los procesos metabólicos tendría implicaciones terapéuticas considerables en la clínica 32 (Figura 1).
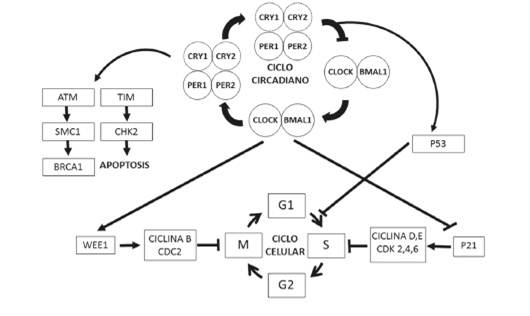
Figura 1 Relación entre el ciclo circadiano y el ciclo celular. El reloj circadiano está constituido por proteínas como BMAL1, CLOCK, PERIOD 1 y 2 y CRYPTOCROME 1 y 2, que ejercen control sobre proteínas como p21 y WEE1, que controlan pasos decisivos en el ciclo celular; además, PER1 regula proteínas como ATM (Ataxia- Telangectasia Mutated) y TIM (Timeless) que regulan la apoptosis, entre otras
DESINCRONIZACIÓN DEL SISTEMA CIRCADIANO Y CÁNCER
Estudios epidemiológicos demuestran una relación significativa entre el riesgo de desarrollar cáncer y eventos que distorsionan los ritmos circadianos, como la exposición constante a la luz. Teniendo en cuenta que aproximadamente 25 %-30 % de los trabajadores tienen turnos nocturnos, en especial en fábricas, transporte, comunicaciones y el sector hospitalario 33, es de gran importancia encontrar la relación entre la desincronización de los ritmos circadianos y la incidencia de cáncer. Por ejemplo, algunas investigaciones han demostrado un aumento en la incidencia de cáncer de seno en mujeres que trabajan de noche o en turnos rotados, como enfermeras y asistentes de vuelo 34. Por otro lado, las personas que laboran de noche tienen patrones de metilación alterados en varios genes, incluyendo los genes reloj cry2 y clock 35. Tales estudios sugieren alteraciones del sistema circadiano como posibles factores de riesgo no genético en el desarrollo de cáncer de seno 36.
CRONOFARMACOLOGÍA EN CÁNCER
La quimioterapia es uno de los procedimientos más efectivos contra el cáncer 37. Los medicamentos antineoplásicos son diseñados para interrumpir la proliferación y supervivencia de las células tumorales, pero usualmente también afectan las células normales del paciente 38. Incluso las nuevas tecnologías que buscan tener blancos más específicos en las células cancerosas, presentan efectos secundarios que interfieren en el tratamiento exitoso del cáncer o que, incluso, podrían ser fatales para los pacientes 37. Por esta razón ha sido necesaria la búsqueda de estrategias para contrarrestar los efectos adversos de estos medicamentos, por ejemplo, la cronofarmacología, o sea, la administración de tratamientos de acuerdo con los ritmos biológicos; su función consiste en aumentar la tolerancia y efectividad de los medicamentos mediante su administración a horas específicas del día 39. El concepto de cronofarmacología ha surgido a partir de evidencia que muestra que tanto la proliferación de las células como los mecanismos responsables de la farmacocinética y la farmacodinamia de los agentes antineoplásicos ocurren a horas específicas del día 40) (41. Estudios experimentales en ratones han demostrado que la hora de administración modifica la toxicidad y la tolerancia de más de 40 agentes quimioterapéuticos incluyendo, entre otras, las principales clases farmacológicas como los antimetabolitos, las antraciclinas y los derivados del platino 30) (40) (42. Para la mayoría de estos medicamentos, la dosis letal varía de 2 a 10 veces dependiendo del tiempo de administración en ratones de laboratorio 37. Notablemente, el tiempo de mayor eficacia de los medicamentos antineoplásicos coincide con el tiempo de menor toxicidad 40.
De la misma manera, ensayos clínicos en humanos han demostrado que la quimioterapia administrada a horas específicas del día produce beneficios significativos en pacientes con diferentes tipos de cáncer 39) (41) (43) (44. En particular, se han hecho estudios exhaustivos en cáncer de colon en el que la efectividad del medicamento es mejor y los efectos secundarios disminuyen. Además, se ha estudiado el efecto de la cronofarmacología en leucemia linfocítica aguda y cánceres ginecológicos. A continuación se detalla una revisión de los estudios clínicos de estos tres tipos de cáncer.
CRONOTERAPIA EN EL TRATAMIENTO DE LA LEUCEMIA
En los años ochenta, el grupo de Hematología y Oncología del Hospital Saint Justine en Canadá investigó el efecto circadiano del metotrexato (MTX) y de la 6-mercaptopurina (6MP) en 118 pacientes pediátricos en remisión de leucemia linfocítica aguda (LLA). Los resultados mostraron que los pacientes tenían 4,6 veces más riesgo de recaídas cuando el MTX y la 6-MP se administraban por la mañana en vez de por la tarde 45. Posteriormente, en 1993, se evaluó de nuevo la misma cohorte de pacientes en remisión y se encontró que había 2,6 veces más riesgo de recaídas cuando dichos medicamentos se administraban por la mañana, sugiriendo un efecto favorable de su administración en horas de la noche 45. Un estudio reciente en pacientes pediátricos con LLA en mantenimiento con MTX y 6-MP no encontró diferencias significativas en la tasa de recaída con la administración de los medicamentos en la noche o en el día. Sin embargo, basados en los resultados previos y en observaciones empíricas, se continúa recomendando que el tratamiento con MTX se haga en horas de la noche 46.
CRONOTERAPIA EN EL TRATAMIENTO DEL CÁNCER DE COLON
Dado que el tratamiento de diferentes tipos de cáncer se puede hacer con más de un agente quimioterapéutico 47, se han establecido protocolos para combinar varios medicamentos antineoplásicos teniendo en cuenta las horas en que cada uno es más efectivo y menos tóxico 37. El Hospital Paul Brousse en Francia es líder en la aplicación de la cronoterapia y allí se han efectuado ensayos clínicos fase III con asignación aleatoria y multicéntricos para el tratamiento cronomodulado del cáncer de colon metastásico.
El primero de estos ensayos tuvo lugar en 1994 con 92 pacientes, en los que evaluaron la administración de 5-fluorouracilo (5-FLU) y oxiliplatino mediante bombas de infusión continua con picos a las 4 a. m. para el 5-FLU y a las 4 p. m. para el oxiliplatino, y la compararon con la administración continua sin picos en cursos de 5 días. Los resultados mostraron que la estomatitis, principal efecto adverso, era 8,7 veces más frecuente en los pacientes que recibían la terapia continua comparados con el grupo que recibía la terapia cronomodulada 48. No hubo diferencias estadísticamente significativas en los efectos tóxicos graves como diarrea, vómito o supresión hematológica. Sin embargo, dado que los pacientes eran capaces de recibir dosis mayores de 5-FLU a medida que iban pasando los ciclos, la frecuencia de neuropatía periférica grado 2 fue cuatro veces mayor en quienes recibieron la terapia cronomodulada. La dosis media de los pacientes con terapia cronomodulada fue de 700 mg/m2, mientras que la de terapia continua fue de 500 mg/m2. Esto llevó a que la terapia cronomodulada lograra una mejor respuesta objetiva que el tratamiento continuo. El resultado más significativo fue que la supervivencia de los pacientes con terapia cronomodulada fue 4,1 veces mayor que la de aquellos en terapia continua 48.
Posteriormente, en 1997, el mismo grupo hizo otro ensayo clínico fase III con asignación aleatoria en 186 pacientes. En este, la terapia cronomodulada con 5-FLU y oxiliplatino produjo neuropatía en 16 % y toxicidad de las mucosas en 14 % de los pacientes tratados. Por otro lado, la terapia continua produjo neuropatía y toxicidad en 31 % y 76 %, respectivamente 49. Estos resultados sugieren que la supervivencia de los pacientes no fue diferente con las dos terapias, pero que los efectos secundarios sí disminuyeron significativamente con el tratamiento cronomodulado, permitiendo de esa manera suministrar mayor dosis del medicamento y aumentar su eficacia 49. Adicionalmente, un ensayo clínico en 2006 en el que se compararon la terapia cronomodulada y la continua con 5-FLU y oxiliplatino en 564 pacientes, demostró mayor supervivencia en los pacientes con regímenes cronomodulados. Esta diferencia fue evidente solo para los hombres 50. Con base en los resultados ambiguos de estos tres estudios, los autores hicieron un metaanálisis para determinar la causa de las diferencias en supervivencia y encontraron distintos desenlaces dependientes del sexo y que, además, las mujeres tienen una tendencia mayor a tener tumores del colon ascendente, inestabilidad de microsatélites y mutaciones en BRAF 51. Este estudio recomendó investigar más las mutaciones presentes en mujeres que puedan generar esta dicotomía 51.
CRONOTERAPIA EN CÁNCER DE OVARIO Y ENDOMETRIO
En otras clases de medicamentos antineoplásicos como las antraciclinas, también se ha encontrado evidencia del beneficio de la terapia cronomodulada. En 1990 el grupo del Hospital Paul Brousse en Francia llevó a cabo un ensayo clínico fase II con 28 pacientes con diagnóstico de carcinoma epitelial de ovario comparando el uso de doxorrubicina a las 6 a. m. y a las 6 p. m. y el de cisplatino en intervalos desde las 4 a. m. a las 8 a. m. y desde las 4 p. m. a las 8 p. m. Este ensayo mostró que el grupo que recibió la doxorrubicina en la mañana y el cisplatino en la noche tuvo menos alteraciones hematológicas y renales, además de una mayor respuesta clínica que el otro grupo 52.
En 2003, el Grupo de Ginecología y Obstetricia de la Universidad de Kentucky hizo un ensayo clínico fase III en el que asignaron aleatoriamente 342 pacientes con cáncer endometrial para recibir ciclos cronomodulados de doxorrubicina a las 6 a. m. y cisplatino a las 6 p. m. o los ciclos convencionales de dichos medicamentos. No se encontraron diferencias significativas en la respuesta clínica. Sin embargo, la dosis media de doxorrubicina fue mayor en los ciclos cronomodulados que en los convencionales (246 versus 209 mg/m2) y la leucopenia relacionada con el tratamiento fue 10 % mayor en el grupo convencional 53.
IMPLICACIONES PARA LA PRÁCTICA CLÍNICA
La investigación acerca de la importancia de la hora de administración de los medicamentos ha aumentado significativamente en las últimas décadas. Incluso otros aspectos de la cronofarmacología se han desarrollado notablemente para incluir la cronofarmacocinética, que tiene en cuenta la variación cinética de los medicamentos en relación a los picos en los factores fisiológicos relevantes en cada sistema. Por ejemplo, el patrón temporal de la presión arterial sigue un ritmo circadiano con el pico máximo en horas de la mañana y puede presentar mayor riesgo en pacientes hipertensos 54. El aumento en la investigación en cronobiología ha empezado a permear todos los aspectos del cuidado de los pacientes. La variación en los procesos fisiológicos normales como el flujo sanguíneo, el tono vascular, la secreción de hormonas, la secreción gastrointestinal, y su posible alteración con la enfermedad, son aspectos que se tienen en cuenta para el cuidado hospitalario y paliativo de los pacientes 55. Incluso, se ha desarrollado una teoría para el cuidado circadiano del paciente hospitalizado (TICC, por la sigla en inglés de Theory of Inpatient Circadian Care), que propone una práctica clínica basada en el conocimiento multidisciplinario de aspectos temporales de cada paciente 55.
Sin embargo, y a pesar del esfuerzo de múltiples áreas del conocimiento, actualmente la aplicación de la cronofarmacología aún no es un aspecto predominante en el protocolo de tratamiento de los diferentes tipos de cáncer. Usualmente, la quimioterapia intravenosa se administra durante las horas del día por razones de logística y conveniencia tanto de los pacientes como del personal hospitalario. Además, si los pacientes no tienen una hora específica sugerida por el médico tratante, se toman las dosis orales de medicamentos en la mañana después del desayuno, o en la noche justo antes de dormir, y las razones más comunes son ''para tener algo en el estómago'', ''para no olvidarlo'' o ''para no sentir efectos secundarios''. El desconocimiento de la mejor hora para tomar un medicamento plantea uno de los retos más grandes a los profesionales de la salud. En el caso de la quimioterapia, con la que usualmente se busca atacar la proliferación de células cancerosas, la hora de la administración puede ser la diferencia entre un tratamiento exitoso y uno poco efectivo. Por ejemplo, el pico en la síntesis del ADN en la proliferación de células sanguíneas en la médula ósea ocurre en la mitad del ciclo de luz, alrededor de la 1 p. m. 18. Por otro lado, la expresión del glutatión, un tripéptido involucrado en la defensa de la célula contra los agentes citotóxicos precede en 5 horas a la proliferación, o sea, que ocurre alrededor de las 8 a. m. en la médula ósea 56. Estos resultados demuestran que los ciclos de las células de la médula ósea están temporalmente sincronizados, y que las células normales podrían ser más sensibles a los medicamentos citotóxicos al medio día 18. Con base en esta evidencia, sería desafortunado administrar los antimetabolitos como 5-FLU o MTX cerca de esta hora del día, pues con la administración a una hora diferente se podrían evitar los efectos tóxicos en las células sanas del paciente.
La hora de administración de la quimioterapia se debe basar en el estudio de los ritmos circadianos de los pacientes con base en la cronobiología. Con el conocimiento actual que se tiene de los ritmos circadianos y los mecanismos de acción de algunos medicamentos, no se puede predecir con precisión el tiempo óptimo de administración de la quimioterapia. Sin embargo, sí se puede tener un estimativo basado en estudios previos con algunos medicamentos.
Los modelos animales, y en particular los ratones, han sido muy valiosos en la investigación en cronofarmacología del cáncer y han sentado las bases para la aplicación en la clínica. Sin embargo, la transferencia de resultados de murinos a humanos no es inmediata por la heterogeneidad de las células cancerosas y los tejidos. Además, estudios previos han demostrado que la raza, el sexo y la actividad locomotriz son factores que influencian la efectividad de los agentes anticáncer 37. La investigación básica con cultivos celulares y modelos animales debe continuar, especialmente para encontrar los mecanismos moleculares por los que los medicamentos afectan procesos fisiológicos involucrados en el cáncer y que tienen un patrón temporal predecible. Sin embargo, hacen falta ensayos clínicos en humanos con protocolos estandarizados de administración y seguimiento minucioso.
Un enfoque personalizado, que incluya la observación de los ritmos circadianos de los procesos fisiológicos de los pacientes, es el camino hacia donde se dirige la lucha contra el cáncer 37. Un área de mejoramiento directo es el registro de la hora de administración intravenosa u oral de la quimioterapia y el consecuente análisis retrospectivo de su eficacia. Por otro lado, se deben diseñar ensayos clínicos, con diferentes protocolos de administración, que evalúen hipótesis basadas en predicciones de modelos matemáticos y resultados de estudios previos con modelos animales. Por último, la investigación interdisciplinaria, mediante el uso de sistemas de administración modulada temporalmente (por ejemplo, bombas de infusión constante de 24 horas o con liberación sinusoide) 48 podría ayudar al diseño de terapias personalizadas.
Un mejor entendimiento de las implicaciones de los ritmos circadianos en el cáncer es esencial para el desarrollo de estrategias para tratar esta enfermedad. Los investigadores de ciencias básicas biomédicas y los profesionales de la salud tienen mucho que aportar al área de la cronofarmacología del cáncer. De estrategias conjuntas entre ellos se beneficiarían no solo cada paciente en cuanto a su tratamiento y pronóstico, sino la comunidad entera que lucha contra una enfermedad tan prevalente como el cáncer.














