INTRODUCCIÓN
La nanotecnología es una disciplina extensa y heterogénea en la que se diseñan, fabrican, caracterizan y aplican estructuras en la escala nanométrica. Lo interesante es que las propiedades de las nanopartículas (NP) se pueden manipular, para modificar su tamaño o forma sin afectar su composición química (1-5).
Las NP tienen propiedades físicas y químicas únicas como su pequeño tamaño, gran área superficial, alta relación de aspecto, o sea, la proporción entre su ancho y su altura, lo que permite que tengan gran potencial para diferentes aplicaciones biomédicas (1,2). La nanomedicina es la aplicación de la nanotecnología para el diagnóstico y tratamiento de enfermedades, y para el monitoreo y control de sistemas biológicos, un área interdisciplinaria de la investigación en ciencias básicas, ingeniería y medicina (2,4,6,7).
Entre los desarrollos más importantes de la nanomedicina se encuentran sistemas de diagnóstico para la detección temprana de enfermedades (8-10), recubrimientos para mejorar la biocompatibilidad de implantes o prótesis, aditivos para mejorar la solubilidad y biodisponibilidad de fármacos (11,12), materiales para ingeniería tisular, medicina regenerativa y biomiméticos (13-15), sistemas de encapsulación, transporte y administración dirigida y controlada de fármacos y genes a tejidos o células específicas (6,9,11-13,15,16), adyuvantes para vacunas (11) y terapias antitumorales (7,17), entre otras.
Hasta la fecha se han diseñado y estudiado diversos tipos de NP, tanto orgánicas como inorgánicas, para uso en nanomedicina: NP poliméricas, cerámicas, metálicas, lipídicas, a base de carbono, nanocápsulas, dendrímeros, liposomas, micelas, Quantum Dots, poliplexos, entre otros (2,12,18) (Figura 1). Estas NP asumen nuevas propiedades y funciones que difieren marcadamente de un objeto del mismo material en una escala mayor, y son precisamente esas propiedades las que les dan la posibilidad de atravesar las barreras biológicas y llegar hasta diferentes células y tejidos, permitiéndoles interactuar con los sistemas celulares e incluso imitar los procesos biológicos (3,18).
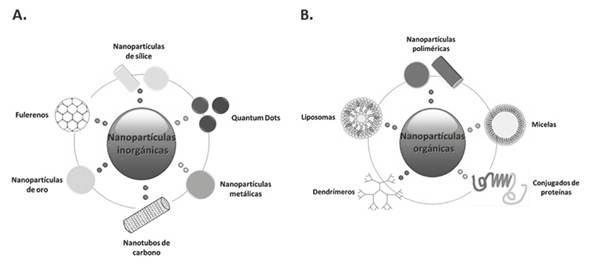
Figura 1 Nanopartículas usadas en nanomedicina. Las NP se clasifican según su composición química en los siguientes dos grupos: A. Nanopartículas inorgánicas como las de sílice, los Quatum Dots, las metálicas, los nanotubos de carbono, las de oro y los fulerenos. B. Nanopartículas orgánicas como los liposomas, las micelas, los dendrímeros, los conjugados de proteínas y las poliméricas
Es así como el uso de diferentes NP para el desarrollo de nuevas aplicaciones biomédicas va cada día en aumento. Sin embargo, los efectos perjudiciales en la salud humana y en especial los relacionados con la respuesta inmune resaltan la necesidad de estudios de seguridad e inmunomodulación previos a su implementación comercial. En esta revisión se discute la actividad inmunomoduladora de diferentes NP utilizadas en nanomedicina, según sus propiedades fisicoquímicas y los mecanismos subyacentes.
ACTIVIDAD INMUNOMODULADORA DE DIFERENTES NANOPARTÍCULAS
La diversidad química y estructural de las NP, sumada a la capacidad de llegar a diferentes células y tejidos, es ventajosa para su uso; sin embargo, esas mismas características y propiedades hacen que, cuando una NP se introduce en el organismo, el sistema inmunitario la reconozca como un agente extraño y se produzca una respuesta inmune (19,20). Además, factores como la dosis y la vía de administración, el mecanismo de acción y el sitio de la actividad -que son propiedades extrínsecas al material- también son críticos en el establecimiento de la respuesta inmune (12,21). Por esta razón, se han reportado múltiples efectos inmunomoduladores mediados por las NP en diferentes componentes de la respuesta inmune (12).
Como parte de la inmunoestimulación, las NP han mostrado propiedades adyuvantes (potenciadoras de la respuesta inmune), incluso en el contexto del cáncer, favoreciendo la eliminación de tumores secundarios refractarios al tratamiento (12). Además, se han descrito múltiples modificaciones a las NP, que les confieren efectos específicos sobre la respuesta inmune, pero que no serán consideradas en esta revisión, pues dichos efectos se asocian directamente con estas modificaciones. Por otra parte, la inmunosupresión se describe como la regulación negativa o la prevención de la activación del sistema inmune. Aunque la inmunosupresión tiene sus inconvenientes, tales como el aumento de la susceptibilidad a las infecciones causadas por microorganismos (12) y el desarrollo de neoplasias (22), también puede ser deseable para el tratamiento de enfermedades autoinmunes y para la compatibilidad de tejidos en pacientes que reciben trasplantes. A continuación se discuten los efectos inmunomoduladores reportados para las diferentes NP (Tabla 1).
Tabla 1 Inmunomodulación in vivo de diferentes nanopartículas usadas en nanomedicina
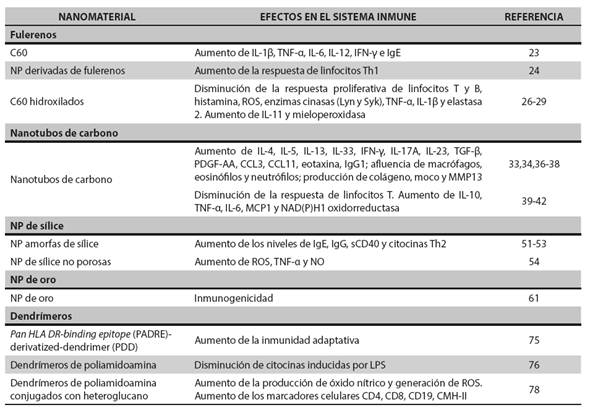
ROS: especies reactivas del oxígeno, por la sigla en inglés de reactive oxygen species; PDFG-AA: factor de crecimiento derivado de plaquetas, compuesto de dos cadenas A (-AA), por la sigla en inglés de platelet derived growth factor; CCL: ligando de quimiocina; MMP: metaloproteinasas de matriz, por la sigla en inglés de matrix metalloproteinases; MCP: proteína quimioatrayente de monocitos, por la sigla en inglés de monocyte chemotactic protein; sCD40: CD40 soluble; LPS: lipopolisacárido
Fulerenos de carbono (C60)
Representan la tercera forma molecular más estable del carbono, tras el grafito y el diamante. Los más conocidos son los formados por 60 átomos de carbono (C60). Recientemente ha aumentado su uso en la industria y la biomedicina, debido a sus propiedades fisicoquímicas, por lo que su toxicidad ambiental y en la salud humana ha motivado la investigación (23,24).
Con respecto a sus propiedades inmunomoduladoras, Park y colaboradores (23) demostraron en un modelo murino que C60 induce un aumento en la producción de citocinas proinflamatorias como IL-1β, TNF-α, IL-6 e IL-12 y de citocinas del perfil Th1, como IFN-γ. Estos hallazgos se correlacionaron con la presencia de infiltrado linfocítico en el pulmón. Además, pueden favorecer la maduración de las células dendríticas (DC, por su sigla en inglés) mediante la producción de citocinas, incluyendo IL-12p70, así como el aumento en la expresión de CD80, CD83, CD86 y CMH-II (23). Otros autores han informado un aumento en la supervivencia de los neutrófilos, que se relacionó con una mayor capacidad bactericida luego de la estimulación con C60. Dicho efecto confiere resistencia a Streptococcus pyogenes en ratones infectados (25), lo que sugiere su potencial inmunoestimulante.
Sin embargo, otros autores han informado un efecto inmunosupresor de C60. Por ejemplo, se encontró que el tratamiento con él disminuye la hipersensibilidad tipo I, al prevenir la degranulación de mastocitos y basófilos dependiente de IgE (26). En modelos murinos de artritis, se ha informado que C60 suprime la producción de citocinas proinflamatorias, reduciendo la sinovitis y mejorando la sintomatología de la enfermedad (27). La inmunosupresión mediada por C60 no siempre resulta beneficiosa para el individuo. Un estudio publicado en 2009 (28) demostró que su administración intraperitoneal en ratones con melanoma aumenta significativamente el crecimiento del tumor, mediado por la producción de óxido nítrico, así como por una reducción en la respuesta proliferativa de linfocitos T y B. También se ha informado que C60 puede afectar la función de los neutrófilos, disminuyendo la explosión oxidativa, la liberación de trampas extracelulares de neutrófilos (NET, por la sigla en inglés de neutrophil extracellular traps). la expresión de elastasa-2 y la degranulación (29).
Nanotubos de carbono
Los nanotubos de carbono (CNT, por la sigla en inglés de carbon nano tubes) son estructuras tubulares en monocapa (single-walled nanotubes) que tienen una sola pared cilíndrica, o en multicapa (multi-walled nanotubes) que pueden formarse a partir de un conjunto coaxial de CNT en monocapa, o como una sola hoja de grafito dispuesta en forma de rollo. Los CNT tienen propiedades mecánicas, eléctricas, ópticas y térmicas únicas y un enorme potencial para aplicaciones industriales y biomédicas. Sin embargo, su uso es todavía limitado debido a su baja solubilidad, su poca dispersión, su toxicidad y sus efectos secundarios en el sistema inmunológico (30,31), por lo que aún se requieren más estudios para una mejor comprensión de los mecanismos que causan dichos efectos. Diferentes estudios han demostrado que los CNT inducen inmunoestimulación in vitro e in vivo. Por ejemplo, se ha demostrado que la instilación de CNT multicapa causa alteración de la función pulmonar en ratones debido al desarrollo de inflamación asociada a Th2 dependiente de IL-33, aumento de la hiperreactividad de las vías respiratorias, reclutamiento de eosinófilos y células linfoides innatas y producción de citocinas y quimiocinas (32). Además, en ratones provocan un aumento significativo en la expresión del ARNm de citocinas incluyendo IL-4, que se asocia con un aumento en la diferenciación celular esplénica de LT CD4+ y CD8+ (33). También se ha asociado con inflamación pulmonar por infiltración de células, depósito de colágeno, formación de granulomas y una huella inflamatoria marcada por citocinas (IL-33), quimiocinas (CCL3 y CCL11) y producción de la metaloproteinasa de matriz extracelular-13 (MMP13) (34). En un estudio reciente (35) se presentaron pruebas de la generación de ROS por el sistema NADPH oxidasa en macrófagos expuestos a CNT multicapa, lo que se relacionó con daño lisosomal y producción de IL-1β. Igualmente, se ha informado que los CNT aumentan la inflamación de las vías respiratorias inducida por alérgenos, caracterizada por un aumento en los niveles de IgG1, afluencia de macrófagos, eosinófilos y neutrófilos, producción de colágeno, TGF-β1, IL-13, eotaxina y quimiocina regulada y activada del timo (TARC, por la sigla en inglés de Thymusand activation- regulated chemokine) de manera dosis dependiente (36,37). Estos efectos se asocian con un aumento de linfopoyetina estromal tímica, IL-25, IL-33 y factor estimulante de colonias de granulocitos y monocitos en las vías respiratorias. Otro estudio (30) demostró que los CNT multicapa aumentan la secreción basal de citocinas (TNF-α, IL-2, IL-5, IL-6, IL- 12/23p40 e IFN-γ) en células mononucleares de sangre periférica (CMSP) de donantes sanos estimuladas con agonistas de los TLR (por la sigla en inglés de toll-like receptors) o mitógenos. Sin embargo, inhibieron la respuesta inmune en CMSP de individuos alérgicos. Este trabajo demostró también que los CNT multicapa alteran la capacidad de los monocitos de diferenciarse a DC funcionales. Se ha informado también que tanto los CNT monocapa como los multicapa pueden promover respuestas alérgicas (38,39). En ratones sensibilizados con ovoalbúmina (OVA), los CNT aumentan la fibrosis de las vías respiratorias con elevación de los niveles de ARNm de IL-5 en ratones con asma alérgica, pero no tienen efecto en ratones sanos (39). Por el contrario, otros estudios sugieren que los CNT multicapa pueden inducir inmunosupresión en ratones, caracterizada por respuesta reducida y disfunción de linfocitos T, además de un incremento en los niveles de IL-10 y prostaglandinas (33,40,41). Asimismo, la preincubación de linfocitos T vírgenes con DC tratadas con CNT monocapa reduce la proliferación de los linfocitos T (42).
Nanopartículas de sílice
Las NP de sílice son biodegradables y en general presentan una buena biodistribución; estas características se pueden atribuir a su gran área superficial, distribución de tamaño, cristalinidad, propiedades de superficie, solubilidad y alta estabilidad química y térmica. Son fácilmente sintetizables y se pueden fabricar de distintas formas y tamaños (43,44). Aunque la sílice es generalmente considerada como un material no citotóxico, es bien conocido que como nanomaterial tiene cambios en sus propiedades fisicoquímicas, lo que puede llevar a efectos dañinos sobre las funciones celulares in vivo e in vitro (45), incluidas las del sistema inmune.
Con respecto a sus propiedades inmunoestimuladoras, se han reportado los efectos inflamatorios de nanopartículas de sílice amorfa de 30 nm en CMSP y monocitos purificados, relacionados con un aumento en la producción de IL-1β, IL-8 y ROS, así como con la activación del inflamasoma NLRP3 (46). Otros estudios indican que las NP de sílice pueden favorecer respuestas inmunes alérgicas de tipo Th2 en ratones expuestos a OVA, induciendo mayores niveles de inmunoglobulinas IgE, IgG e IgG1 (47). Estas NP también inducen la producción de TNF-α dependiente de la producción de ROS y de la activación de las proteínas cinasas activadas por mitógenos (MAPK, por la sigla en inglés de mitogen-activated protein kinases) en macrófagos, activando una respuesta inflamatoria (48,49). Chen y colaboradores (50) mostraron que células de Kupffer estimuladas con NP de sílice liberan grandes cantidades de ROS, TNF-α y óxido nítrico causando inflamación. Varios autores han referido la capacidad de las NP de sílice para activar el inflamasoma NLRP3 (46). Lee y colaboradores (43) informaron que las NP de sílice coloidales inducen mayor expresión de las citocinas proinflamatorias TNF-α, IL-1β e IL-6 en macrófagos, que las NP mesoporosas, y que estas a su vez presentan mayor actividad proinflamatoria que las NP cristalinas (51). Hirai y colaboradores (52) mostraron que las NP amorfas de sílice con diámetro de 70 y 100 nm aumentan el paso de antígenos desde el endosoma al citoplasma induciendo la presentación cruzada en DC murinas.
Diferentes estudios han evidenciado el efecto inmunomodulador de las NP de sílice, con especial atención a la participación del estrés oxidativo como mecanismo de toxicidad. Uno de ellos demuestra que las NP porosas inducen mayor estrés oxidativo y de enzimas, tales como la superóxido-dismutasa y el grupo hemo-oxigenasa-1, que las nanopartículas no porosas en células del epitelio bronquial humano (53). Passagne y colaboradores (54) encontraron que las NP de sílice inducen estrés oxidativo, dependiente del tiempo y de su tamaño. Igualmente, se ha demostrado que las NP de sílice no cristalina, de tamaño nano y submicrónico, pueden inducir una alta producción de IL-1β por mecanismos que implican la activación del inflamasoma NLRP3, en macrófagos murinos preactivados con LPS (55) y en macrófagos humanos (48,56,57). Por otro lado, Peeters y colaboradores (58) demostraron que las NP de sílice cristalina inducen la activación del inflamasoma NLRP3 en células humanas derivadas del epitelio bronquial. Dicha estimulación induce la liberación de las alarminas HMGB1 (por la sigla en inglés de high mobility group box 1) y bFGF, importantes para la potenciación de la respuesta inflamatoria sistémica.
Nanopartículas de oro (AuNP)
Son NP metálicas que presentan propiedades ópticas y electrónicas totalmente dependientes de su forma y tamaño. Las AuNP han surgido como un candidato atractivo para la administración dirigida de diversos agentes terapéuticos debido a su baja citotoxicidad, parámetros optimizables de la superficie, estabilidad y biocompatibilidad en condiciones in vivo (59,60).
Parween y colaboradores (61) demostraron que AuNP formuladas con alumbre activan la inmunidad humoral contra Plasmodium falciparum, y muestran escasa inmunogenicidad en los ratones expuestos, por lo que se sugirió que podrían ser útiles en el desarrollo de un adyuvante contra dicho parásito. Estudios recientes hallaron que tanto los macrófagos como los neutrófilos humanos internalizan las AuNP lo que aumenta la producción intracelular de ROS (62,63). También se ha demostrado que las AuNP pueden iniciar una respuesta inflamatoria mediante la activación de macrófagos tanto in vitro como in vivo (64). Uno de esos estudios halló que AuNP de 40 nm aumentan no solo la hiperreactividad de las vías respiratorias, sino también el número de neutrófilos y macrófagos en ratones sensibilizados (65). Asimismo, AuNP de 13 nm recubiertas con polietilenglicol (PEG) pueden inducir una respuesta inflamatoria aguda y apoptosis en el hígado, con presencia de numerosas vesículas citoplasmáticas y lisosomas en células de Kupffer y macrófagos del bazo. Sin embargo, otros estudios han demostrado que las AuNP tienen propiedades antinflamatorias, inhibiendo la respuesta celular inducida por citocinas proinflamatorias in vivo e in vitro (14,66).
Quatums-dots
Los Quantums Dots (QD) son una categoría particular de NP de aproximadamente 1-20 nm de diámetro, que se caracterizan por su estructura cristalina compuesta de un material semiconductor. Su fotoestabilidad los hace ideales para la formación de imágenes. Entre los más utilizados están los QD de sulfuro de cadmio y seleniuro de cadmio (67,68). Como los QD son fuertes donadores de energía, se ha demostrado que pueden inducir la generación de ROS mediante la transferencia de energía a moléculas de oxígeno cercanas, ocasionando daños en diferentes organelas y muerte celular (69).
Nguyen y colaboradores (70) informaron que la preexposición a QD suprime la respuesta inmune de macrófagos a Pseudomonas aeruginosa, debido a la reducción de los niveles de óxido nítrico, TNF-α, KC/ CXCL-1 e IL-8. También se ha informado que la inyección de QD estimula en ratones la proliferación de células inmunes como linfocitos T y macrófagos, induciendo la producción de citocinas y quimiocinas proinflamatorias (71).
Dendrímeros
Los dendrímeros son polímeros sintéticos globulares de distribución y tamaño monodisperso. Sus propiedades fisicoquímicas los hacen similares a las biomoléculas; son altamente biocompatibles, tienen una biodistribución predecible y características que les permiten interactuar con la membrana según su tamaño y carga superficial. Tienen múltiples grupos funcionales en la superficie que se pueden utilizar para acoplar diferentes moléculas biológicamente relevantes. Se destaca su uso como andamios para la presentación de antígenos, especialmente péptidos, que los hace buenos candidatos como adyuvantes en la formulación de vacunas (72,73). Córdoba y colaboradores (74) demostraron el potencial de glicodendrímeros para estimular DC y activar el sistema inmune. Se ha informado también que dendrímeros derivatizados (o sea, modificados químicamente para producir un compuesto con nuevas propiedades) con PADRE (por la sigla en inglés de pan HLA DR-binding epitope) tienen la capacidad de aumentar la eficacia de la anfotericina B liposomal y su orientación hacia las células presentadoras de antígeno, activando la respuesta inmune adaptativa como consecuencia de la activación de linfocitos T, con lo que se logra reducir la carga parasitaria en leishmaniasis cutánea murina (75).
Sin embargo, otros autores han demostrado que los dendrímeros tienen propiedades inmunosupresoras. Dendrímeros de poliamidoamina (PAMAM) conjugados con eritromicina demostraron tener actividad antibacteriana y además un gran efecto antinflamatorio, evidenciado en la supresión de la producción de óxido nítrico en macrófagos murinos activados con LPS (76). De manera similar, estos dendrímeros derivatizados con grupos alquilo protegen contra la sepsis fatal y la secreción in vivo e in vitro de citocinas inducidas por LPS (77). Además, los dendrímeros pueden afectar la estructura y actividad de moléculas inmunes; por ejemplo, los dendrímeros de PAMAM pueden afectar la estructura secundaria y la conformación de la molécula de γ-globulina, inhibir la activación del complemento y deteriorar la reacción antígenoanticuerpo de los glóbulos rojos humanos (78). Igualmente, se ha informado que en modelos murinos los dendrímeros heteroglucanos glicoconjugados pueden inducir mejoras en las funciones inmunológicas tales como la producción de óxido nítrico y la generación de ROS (79). También inducen una alta regulación de los marcadores de superficie de células inmunes (CD4, CD8, CD19, MHC-II) y de los niveles de citocinas.
Nanopartículas poliméricas
Son partículas coloidales de tamaño submicrónico usadas en diferentes aplicaciones biomédicas debido a sus propiedades como alta biodegradabilidad y biocompatibilidad, circulación prolongada y a que pueden funcionalizarse (o sea, modificarles la estructura mediante la introducción de átomos o grupos funcionales en la superficie) con un amplio espectro de agentes terapéuticos (80).
Se han informado algunas NP poliméricas como activadoras del sistema inmune al favorecer la activación de DC y linfocitos T. Por ejemplo, las NP anfifílicas de polianhídrido poseen propiedades que mimetizan componentes de los patógenos, como se evidenció en su capacidad para activar DC de manera similar al LPS (81). Las NP de polianhídrido metil vinil éter comaleico (PVMA NP) utilizadas como adyuvante activan diferencialmente las DC a través de receptores TLR2 y TLR4, de manera dosis dependiente (82-84). NP basadas en quitosano prometen ser una buena opción como adyuvantes y como sistemas para la entrega de antígenos. Por ejemplo, la vacunación intranasal con NP de quitosano cargadas con toxoide tetánico induce respuesta inmune sistémica y en las mucosas (85).
CONCLUSIÓN
El notable progreso de la nanotecnología y su aplicación en biomedicina ha ampliado los rangos y tipos de NP usadas. Esta revisión presenta una visión general de resultados recientes sobre los efectos inmunomoduladores de varias de estas NP. Tales resultados muestran que actualmente se están utilizando las NP en aplicaciones cada vez más diversas y complejas, pero aún existen muchas preguntas acerca de su papel inmunomodulador, que no se han abordado por completo.
Para las aplicaciones en nanomedicina, el efecto inmunomodulador de las NP es un arma de doble filo: se puede obtener beneficio de sus propiedades para estimular o suprimir el sistema inmune y usarlas, por ejemplo, como adyuvantes o como antinflamatorios respectivamente, pero, al mismo tiempo, es necesario evitar las respuestas inmunes indeseables (inflamación, hiperreactividad, inmunosupresión) con el fin de minimizar los efectos secundarios sistémicos. Los factores que influyen en los diferentes mecanismos de la respuesta inmune son múltiples y complejos, entre ellos: la composición química de las partículas, el tamaño, la forma, la composición y la carga de la superficie, la vía de exposición y la dosis. Igualmente, las variaciones e incluso contradicciones de los efectos inmunomoduladores de las NP reportadas a la fecha, pueden estar asociadas con las condiciones particulares de cada preparación y con los modelos celulares o animales utilizados. Por esto, para su aplicación potencial en medicina y otras áreas, es crucial investigar la relación entre las características fisicoquímicas de las NP y la respuesta inmune sistémica en diferentes modelos biológicos, pues los enfoques actuales de predicción y prevención de la inmunomodulación de las NP siguen siendo muy precarios, por lo que se deben fomentar estudios mucho más profundos.














