INTRODUCCIÓN
La sarcoidosis es una enfermedad infrecuente de etiología desconocida, descrita hace más de 80 años, caracterizada por un trastorno multisistémico con presencia de lesiones granulomatosas no caseificantes 1, generalmente con compromiso pulmonar y ganglionar, asintomático en la mitad de los casos, pero que puede afectar otros órganos. El compromiso cardíaco es variable según la región estudiada, pero en general se acepta que 5 % de los pacientes con sarcoidosis sistémica tienen infiltración cardíaca con evidencia clínica; sin embargo, estudios de autopsia indican que hasta 20 % a 30 % de los pacientes con sarcoidosis tienen afectación miocárdica 2. Kandolin y colaboradores 3 informaron en un estudio de 110 pacientes en un período de 25 años (1988 a 2012), que cerca de dos terceras partes tenían sarcoidosis cardiaca aislada.
La enfermedad ha sido reportada en todo el mundo, con tasas de prevalencia entre 4,7 y 64 por cada 100.000 personas, más altas en el norte de Europa y en afroamericanos, con predominio en mujeres 2. En un estudio finlandés reciente 3 se encontró que la prevalencia de la enfermedad ha aumentado en los últimos años, posiblemente por la mayor tasa de detección, al pasar de 0,31 por 100.000 adultos entre 2008 y 2012 a 2,2 por 100.000 adultos en 2012 3. Los sitios afectados con mayor frecuencia son el pulmón y los nódulos linfáticos torácicos, pero los granulomas no caseificantes pueden aparecer casi en cualquier órgano, más comúnmente en la piel, el hígado, el sistema gastrointestinal, los ojos y el sistema nervioso central 4.
Debido a su baja frecuencia, la evidencia disponible sobre su diagnóstico y tratamiento es escasa, por lo que las recomendaciones disponibles provienen de estudios observacionales, experiencia clínica y opinión de expertos.
METODOLOGÍA
Se revisó la literatura sobre el tema; se utilizaron en búsqueda avanzada los términos MESH ''cardiac'' y ''sarcoidosis'' sin limitación por idioma o fecha de publicación. Se obtuvieron 2033 referencias en Pubmed, 31.747 en EMBASE, 70 en Epistemonikos, 12 en LILACS y 1 en SciELO; no se incluyó búsqueda de literatura gris. Se retiraron por revisión de título los artículos no relacionados con el tema (27 090), por evaluación del título y resumen de reportes de sarcoidosis en general (1594), y las publicaciones duplicadas (5079); quedaron 100 artículos para revisión completa, de los cuales se incluyeron 51 en el artículo final por consenso de tres de los autores. La mayoría de los estudios incluidos corresponden a revisiones de la literatura, algunos son estudios de cohortes y casos y controles. No se logró recuperar ningún ensayo clínico aunque se hizo una búsqueda avanzada para el tratamiento de la enfermedad con la estrategia PIS (Paciente, Intervención, Estudio), con los términos: (''immunosuppressive agents''[Pharmacological Action] OR ''immunosuppressive agents''[MeSH Terms] OR (''immunosuppressive''[All Fields] AND ''agents''[All Fields]) OR ''immunosuppressive agents''[All Fields] OR ''immunosuppressive''[All Fields]) OR (''infliximab''[MeSH Terms] OR ''infliximab''[All Fields])) AND (''infliximab''[MeSH Terms] OR ''infliximab''[All Fields])) OR (''azathioprine''[MeSH Terms] OR ''azathioprine''[All Fields])) OR (''methotrexate''[MeSH Terms] OR ''methotrexate''[All Fields])) OR (''cyclophosphamide''[MeSH Terms] OR ''cyclophosphamide''[All Fields])) OR (''steroids''[MeSH Terms] OR ''steroids''[All Fields])) OR (''adrenal cortex hormones''[MeSH Terms] OR (''adrenal''[All Fields] AND ''cortex''[All Fields] AND ''hormones''[All Fields]) OR ''adrenal cortex hormones''[All Fields] OR ''corticosteroid''[All Fields])) AND ((((((single blind[tw] OR single blinded[tw] OR single blindedly[tw] OR single blindedness[tw] OR single blinding[tw] OR single blindly[tw] OR single blindness[tw]) OR ''double-blind method''[MeSH Terms]) OR clinical trial[pt]) OR (random allocated[tw] OR random allocation[tw] OR random allocations[tw])) OR ''randomized controlled trials as topic''[MeSH Terms]) OR randomized controlled trial[pt])) AND ((''heart''[MeSH Terms] OR ''heart''[All Fields] OR ''cardiac''[All Fields]) AND (''sarcoidosis''[MeSH Terms] OR ''sarcoidosis''[All Fields])).
FISIOPATOLOGÍA
La etiología de la enfermedad sigue siendo desconocida, pero se han propuesto factores ambientales, ocupacionales e infecciosos como los disparadores del proceso en individuos con predisposición genética, en los que la aparición de los granulomas no caseificantes sería la vía final común de la exposición antigénica y la inmunidad celular adquirida 1. El estudio de Newman y colaboradores 5, en 706 casos de sarcoidosis e igual número de controles, encontró asociación con trabajo en áreas con olores a humedad (bioaerosoles microbianos) (OR: 1,62; IC: 1,24- 2,11) y con la exposición ocupacional a insecticidas (OR: 1,61; IC: 1,13-2,28), en contraposición al tabaquismo, que se comportó como un factor protector (OR: 0,65; IC: 0,51-0,82). También se han propuesto diferentes microorganismos como agentes etiológicos, los cuales desarrollarían la enfermedad por mimetismo molecular; entre las bacterias sospechosas se incluyen Propionibacterium acnes y las micobacterias incluyendo Mycobacterium tuberculosis, pero, además, agentes virales como el de Epstein-Barr, hepatitis C y VIH 6)(7.
Se han demostrado asociaciones con el complejo mayor de histocompatibilidad (HLA por su sigla en inglés), entre otros con el HLA-DRB1*03 que parece predisponer a la enfermedad con resolución espontánea, mientras que los alelos HLA-DRB1*14 y HLA-DRB1*15 llevarían a una presentación crónica 8. Pero no se han encontrado factores específicos que expliquen el compromiso cardíaco.
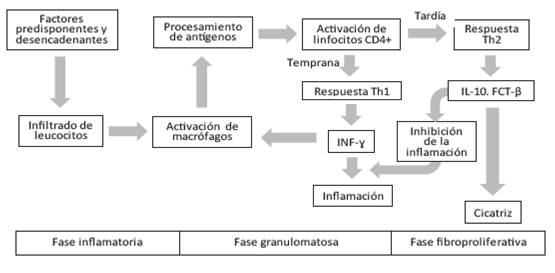
Una vez iniciado el proceso, se da una primera fase histopatológica de inflamación y edema con infiltrados leucocitarios; luego empieza una etapa de formación de granulomas no caseificantes, que pueden resolverse o progresar a fibrosis, y que aparecen por activación inicial de linfocitos T diferenciados tipo 1, que al producir interferón gamma activan los macrófagos generando la respuesta inflamatoria con formación de los granulomas; posteriormente, una vez avanzada la enfermedad, aparece una etapa fibroproliferativa en la que los linfocitos T tipo 2 producen citocinas inhibidoras como interleucina 10 y factor de crecimiento tumoral beta que atenúan la respuesta inflamatoria llevando a la fase cicatricial (Figura 1). Desde el punto de vista terapéutico, las primeras dos etapas pueden responder al uso de esteroides y terapia inmunomoduladora, mientras que la fase cicatricial tiene poca respuesta a las terapias 1)(9.
CLÍNICA
La sarcoidosis cardíaca puede ser asintomática o tener un amplio espectro de presentaciones. En varias series de pacientes con sarcoidosis extracardíaca se ha encontrado en imágenes afectación cardíaca asintomática, especialmente en resonancia magnética cardíaca con protocolo de realce tardío, con frecuencia variable entre 3,7 % y 54,9 % 10)(16.
Las manifestaciones clínicas dependen de los sitios infiltrados por granulomas. La infiltración miocárdica puede llevar a disfunción ventricular izquierda y/o derecha, aunque esto suele indicar enfermedad avanzada; se observa en 25 % a 75 % de los pacientes sintomáticos 9; sin embargo, en la actualidad, estos porcentajes podrían ser menores, pues se estudia tempranamente a los pacientes con sospecha diagnóstica de sarcoidosis extracardíaca y el diagnóstico y el tratamiento se hacen antes de que aparezca la disfunción ventricular. El compromiso ventricular derecho afecta la función sistólica del ventrículo izquierdo y es tan común o incluso más frecuente que la disfunción de este último. El pronóstico de la falla cardíaca secundaria a sarcoidosis depende de la gravedad de los síntomas (clase funcional) y del grado de disfunción ventricular 1.
Otras manifestaciones importantes son secundarias al compromiso granulomatoso del sistema de conducción, que puede llevar al bloqueo cardíaco cuando se infiltra el septo ventricular basal; dicho bloqueo puede aparecer en 23 % a 30 % de los casos, además de bloqueos de rama en 12 % a 32 % 9. Por lo general, en pacientes con sarcoidosis cardíaca los bloqueos auriculoventriculares se presentan a edades menores que los debidos a otras etiologías, lo que hace parte del diagnóstico diferencial. En estudios de autopsia también se han descrito granulomas subendocárdicos en el nodo sinusal, que pueden llevar a varios grados de disfunción 1.
Las arritmias supraventriculares se han asociado a la infiltración granulomatosa del miocardio auricular; en diferentes series se han presentado en 23 % a 36 % de los casos 1)(17)(18; la fibrilación auricular es la arritmia más frecuente y se ha asociado a la dilatación de la aurícula izquierda 18. Las arritmias supraventriculares y ventriculares se han encontrado en las etapas inflamatoria y fibrocicatricial de la sarcoidosis cardíaca 1; se ha descrito la taquicardia ventricular en 23 % de pacientes, y la muerte súbita ocurre en 25 % a 65 % de estos casos 9. Con el cardiodesfibrilador implantable se ha logrado disminuir la mortalidad en este grupo de pacientes 2. El control de las arritmias, sea farmacológico o por ablación, suele ser difícil debido a la infiltración granulomatosa difusa de la sarcoidosis 1.
DIAGNÓSTICO
La sarcoidosis cardíaca se debe buscar en todo paciente con diagnóstico establecido de sarcoidosis extracardíaca, o en aquellos sin diagnóstico previo de sarcoidosis, pero con cardiopatía, bloqueo auriculoventricular o taquicardia ventricular de etiología no clara 1. Se han establecido diferentes criterios para llegar al diagnóstico de sarcoidosis cardíaca, pero no hay estudios con resultados claros acerca de su sensibilidad y especificidad. Se recomienda el uso de los criterios propuestos por la Sociedad del Ritmo Cardíaco (HRS, por su sigla en inglés) en su documento de consenso de expertos para el diagnóstico y tratamiento de las arritmias asociadas con sarcoidosis cardíaca 2 (Tabla 1 y Figura 2). Estos criterios establecen dos rutas para llegar al diagnóstico, bien sea histológica o clínicamente mediante estudios no invasivos. Son criterios sencillos e incluyen las modalidades de imagen nuevas y mejor validadas para llegar a un diagnóstico certero; sin embargo, se debe aclarar que se requieren estudios prospectivos que los validen y comparen con los otros disponibles en términos de sensibilidad y especificidad.
Tabla 1 Criterios diagnósticos de sarcoidosis cardíaca propuestos por la Sociedad del Ritmo Cardíaco

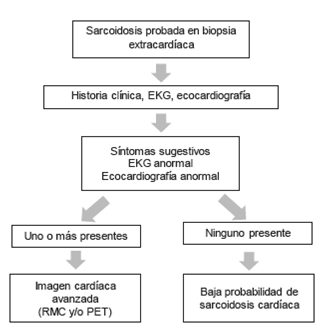
Figura 2 Proceso diagnóstico de la sarcoidosis cardiaca. Modificado de Birnie y colaboradores (2). EKG: Electrocardiograma, RMC: Resonancia magnetica cardiaca, PET: Tomografia por emision de positrones
Radiografía de tórax
No hay cambios específicos que sugieran la enfermedad. Usualmente se observa cardiomegalia cuando hay compromiso cardíaco. Si coexiste con enfermedad pulmonar se pueden observar adenopatías hiliares y cambios parenquimatosos.
Ecocardiografía
Permite detectar la cardiopatía, pero no determina ni sugiere la etiología; la imagen usual es la de una cardiopatía dilatada, con hipocinesia global, aunque pueden observarse alteraciones segmentarias de la contractilidad y disfunción diastólica. Un hallazgo típico, pero infrecuente, es el adelgazamiento del septum basal anterior, que en un paciente joven con cardiopatía dilatada es muy sugestivo de sarcoidosis 19. Con menor frecuencia puede simular una cardiomiopatía hipertrófica 20)(21.
Resonancia magnética
Las imágenes de realce tardío son fundamentales para apoyar el diagnóstico de sarcoidosis cardíaca; sin embargo, no hay un patrón patognomónico para establecerlo con esta modalidad de imagen. Se recomienda que un cardiólogo o un radiólogo con experiencia interprete las imágenes en el contexto del cuadro clínico. El patrón de realce tardío descrito más a menudo es el de una o más regiones parcheadas, que generalmente respetan el endocardio y sin la distribución de un infarto previo; sin embargo, pueden encontrarse patrones típicos de infarto agudo de miocardio 2. Por otro lado, las imágenes en T2 y las de realce temprano con gadolinio pueden detectar inflamación aguda en las fases más tempranas de la enfermedad 22.
Tomografía por emisión de positrones
El uso de la tomografía por emisión de positrones (PET, por su sigla en inglés) con 18 F-fluorodeoxiglucosa es una alternativa para la detección de enfermedad inflamatoria activa en el miocardio, fase en la cual podría revertirse con la terapia inmunosupresora. Se han descrito tres patrones de captación en pacientes con sarcoidosis cardíaca, conocidos como focal, difuso y focal sobre difuso; el más característico es el patrón focal, que puede o no acompañarse de defectos de perfusión en reposo y de anormalidades en el movimiento de la pared 23.
Biopsia endomiocárdica
En general, en el paciente con sospecha de sarcoidosis se prefiere tomar la muestra para biopsia de un tejido extracardíaco como nódulos linfáticos o pulmón, dados su buen rendimiento diagnóstico y el bajo riesgo de complicaciones; sin embargo, en casos de sarcoidosis cardíaca aislada, o cuando no se ha logrado llegar al diagnóstico con muestras de tejido extracardíaco, la biopsia endomiocárdica puede ser una alternativa para confirmarlo. La presencia de granulomas no caseificantes es casi patognomónica para el diagnóstico de la enfermedad; sin embargo, se debe tener en cuenta que la biopsia endomiocárdica tiene baja sensibilidad, dado el patrón parcheado característico del compromiso cardíaco en la sarcoidosis, por lo que es positiva en menos del 25 % de los casos 24. Para mejorarle la sensibilidad, se ha propuesto la obtención de muestras guiadas por estudio electrofisiológico (mapeo electroanatómico), o por imágenes (resonancia magnética cardíaca o PET) 2. Desde el punto de vista histológico, se debe hacer diagnóstico diferencial con la miocarditis de células gigantes; la presencia de daño del miocito, de eosinófilos y de focos de miocarditis linfocítica favorece el diagnóstico de miocarditis de células gigantes, mientras que los granulomas y la fibrosis son más frecuentes en la sarcoidosis cardíaca.
TRATAMIENTO
La terapia farmacológica está dirigida por las guías estándar de falla cardíaca con inhibidores de la enzima convertidora de angiotensina (IECA), betabloqueadores, antialdosterónicos, todos a las dosis máximas toleradas. Las terapias avanzadas como resincronización, dispositivos de asistencia ventricular y trasplante también hacen parte de las opciones para considerar de acuerdo con las guías de falla cardíaca; pero se deberá tener presente qué tan avanzado es el compromiso multisistémico, especialmente a la hora de plantear la opción de trasplante cardíaco.
Corticosteroides
Se debe iniciar el tratamiento de forma precoz e intensiva 25)(29 en pacientes con sarcoidosis cardíaca que en las imágenes tengan signos de inflamación activa (edema en T2 en la resonancia magnética cardíaca o la PET) y que presentan disfunción grave del ventrículo izquierdo, debido a que una vez se progresa de la fase granulomatosa a la fibrótica la terapia inmunosupresora tiene poca capacidad para alterar el curso de la enfermedad 28. A pesar de la escasez de estudios con asignaciones aleatorias y controladas se acepta ampliamente que la terapia inicial debe ser con corticosteroides, pero siguen siendo controvertidas la dosis óptima y la duración del tratamiento.
Función ventricular: los datos reportados en la literatura indican que la terapia con esteroides se asocia con el mantenimiento de la función ventricular en pacientes que la tienen normal en el momento del diagnóstico; además, pueden ayudar a mejorar la fracción de expulsión del ventrículo izquierdo en pacientes con disfunción leve a moderada; y generalmente no hay mejoría en los pacientes con disfunción grave del ventrículo izquierdo 26. La prednisona se inicia a la dosis de 30 a 40 mg/día durante 8-12 semanas, con disminución gradual durante un período de meses hasta que se establece una dosis de mantenimiento efectiva mínima.
Arritmias: por sí solos, los esteroides son inefectivos para prevenir la taquicardia ventricular tanto la no sostenida como la sostenida. Solo ha habido un estudio que mostró disminución de los complejos ventriculares prematuros, pero en pacientes con fracción de expulsión del ventrículo izquierdo mayor de 35 % 30. Pese a la poca evidencia, la inmunosupresión sigue siendo indicación IIa en pacientes con sarcoidosis cardíaca con frecuentes ectopias ventriculares y arritmias sostenidas o no sostenidas con evidencia de inflamación miocárdica 2)(25.
Alteraciones de la conducción: estudios observacionales han encontrado reversión del bloqueo auriculoventricular de alto grado en 47 % de los casos 1. Un consenso reciente de expertos da tres recomendaciones (todas de clase IIa) para el tratamiento de los trastornos de conducción en los pacientes con sarcoidosis cardíaca, a saber: 1) implantación de marcapasos permanente en pacientes con indicación de acuerdo con las guías, incluso si el bloqueo auriculoventricular revierte transitoriamente; 2) la inmunosupresión puede ser útil en pacientes con sarcoidosis cardíaca con bloqueo Mobitz II o bloqueo cardíaco de tercer grado; 3) un cardiodesfibrilador implantable puede ser útil en pacientes con sarcoidosis cardíaca e indicación para la implantación de marcapasos definitivo 2.
No existen datos específicos sobre el uso de la terapia de resincronización en pacientes con sarcoidosis cardíaca, aunque la respuesta parece ser similar a la de los pacientes con otros tipos de cardiopatías 31. El grupo de expertos de la HRS sugieren que esta terapia se debe guiar según las directrices generales de la guía de falla cardíaca, específicamente en resincronización para implantar este dispositivo 2.
Supervivencia: los esteroides pueden mejorar la supervivencia de los pacientes, pero no hay claridad completa sobre la dosis. Un estudio de cohorte retrospectiva mostró que no había diferencias en la supervivencia a 6 años comparando dosis altas (> 40 mg) con dosis bajas (< 30 mg) 19.
Agentes inmunosupresores ahorradores de esteroides
Dados los efectos adversos de la terapia con corticosteroides, es atractivo el uso de agentes ahorradores de esteroides. Estarían indicados en pacientes refractarios a la terapia con esteroides (persistencia de las manifestaciones clínicas o empeoramiento de la inflamación del miocardio a la luz de las imágenes), o que presenten efectos adversos graves a los mismos. Se han utilizado exitosamente varios agentes inmunosupresores: ciclofosfamida, metotrexate, micofenolato mofetil y ciclosporina; sin embargo, son pocos los datos basados en la evidencia sobre eficacia y superioridad.
Debido a la importancia fisiopatológica del factor de necrosis tumoral alfa en la formación de granulomas, existen informes sobre el uso de infliximab 27)(32)(33)(34, con mejoría tanto de la inflamación miocárdica en las imágenes como de los desenlaces clínicos. El infliximab plantea un riesgo de infección digno de tener en cuenta, por ejemplo: se han informado casos de criptococosis diseminada fatal en pacientes con sarcoidosis cardíaca 35.
Antiarrítmicos
No hay evidencia disponible del tratamiento para las arritmias supraventriculares o ventriculares en cuanto a eficacia y seguridad. Las arritmias generalmente recurren al suspender la terapia farmacológica. Los betabloqueadores, los calcioantagonistas y la amiodarona son los fármacos utilizados con mayor frecuencia para suprimir estas arritmias; la amiodarona es el antiarrítmico prescrito más frecuentemente en pacientes que no han respondido al tratamiento con esteroides. Se deben evitar los antiarrítmicos Clase IC (como la propafenona) debido a la cicatrización del miocardio en la sarcoidosis cardíaca y al riesgo de efectos adversos en pacientes con cardiopatía estructural 2. La terapia farmacológica es insuficiente en pacientes con arritmias ventriculares sostenidas y se debe plantear la implantación de un cardiodesfibrilador y/o la ablación 36.
Cardiodesfibrilador implantable
Hay pocos datos específicos en la literatura con respecto al uso del cardiodesfibrilador implantable en la población con sarcoidosis cardíaca 37)(38)(39. La decisión de implantar este dispositivo se basa en el consenso de expertos de la HRC del 2014 2 (Tabla 2).
Ablación con catéter (estudio electrofisiológico)
Puede tener un papel para reducir la carga arrítmica de la taquicardia ventricular, en los pacientes refractarios a los glucocorticoides y antiarrítmicos (recomendación IIa); sin embargo, la eficacia de este procedimiento puede ser limitada por el compromiso difuso de la enfermedad en el miocardio 2)(36)(40)(41.
Cirugía y trasplante
La resección quirúrgica de los aneurismas ventriculares es un método reportado para disminuir el sustrato arritmogénico ventricular; sin embargo, no hay evidencia clara de su beneficio, y se ha dejado de utilizar este procedimiento en pacientes con falla cardíaca de otras etiologías. En el seguimiento en una clínica de falla cardíaca se puede plantear el trasplante, dependiendo de lo avanzado del compromiso de otros órganos 42)(43; en algunos casos el diagnóstico de la enfermedad se hace postrasplante, en el análisis histopatológico del corazón explantado 44. Puede ocurrir recurrencia de la sarcoidosis cardíaca, pero se desconoce su incidencia 45)(46.
SEGUIMIENTO
Se sugiere un seguimiento clínico estricto, hacer a los 3 meses ecocardiografía de control con evaluación de la deformación longitudinal (longitudinal strain) y a los 3 a 6 meses PET o resonancia magnética cardíaca 47; en pacientes con remisión completa se pueden hacer cada 6 meses los controles imaginológicos posteriores. Es importante el control con monitoreo Holter a los 3 y 6 meses 48.
PRONÓSTICO
La sarcoidosis sin afectación cardíaca es una enfermedad relativamente benigna, con recuperación en 28 % a 70 % de los casos y desaparición de las lesiones en el término de 2 años 49. El pronóstico es variable dependiendo de los órganos afectados. Se han descrito tasas de supervivencia de 60 % a 90 % a 5 años en pacientes con sarcoidosis cardíaca 19. Kandolin y colaboradores 3 encontraron que las tasas de supervivencia dependían de la forma de presentación: con o sin falla cardíaca; en pacientes cuya presentación fue sin dicha falla, las tasas de supervivencia libre de trasplante fueron de 97 %, 90 % y 83 % a los 1, 5 y 10 años, respectivamente; en contraste, en pacientes que se presentaron con falla cardíaca, la tasa de supervivencia libre de trasplante a los 10 años fue solo de 53 %.
Dado que la sarcoidosis cardíaca varía en cuanto a la presentación clínica, la gravedad y la afectación multisistémica, es difícil establecer su pronóstico e historia natural 50. Sin embargo, se han identificado factores de riesgo y variables independientes que predicen la mortalidad; una de las variables más importantes es la reducción en la fracción de expulsión del ventrículo izquierdo: si es mayor de 50 % se ha asociado con un 89 % de supervivencia a los 5 años, comparado con solo 59 % cuando es menor de 50 %. Por otro lado, se consideran factores independientes de mortalidad el incremento de un estado funcional, el aumento del 10 % del diámetro diastólico basal y la presencia de taquicardia ventricular sostenida 19. El tratamiento también influye en el pronóstico: los pacientes que reciben la terapia con esteroides cuando está indicada, tienen una supervivencia del 75 %, frente a los no tratados que tienen solo el 10 % de supervivencia. La mayoría de las muertes por sarcoidosis cardíaca son secundarias a la insuficiencia cardíaca congestiva o a las arritmias ventriculares 51.