INTRODUCCIÓN
El trasplante renal es el tratamiento de elección en los niños con enfermedad renal crónica terminal, originada en muy diversas enfermedades renales primarias o secundarias1)(2)(3. La supervivencia de estos trasplantes depende de factores técnicos e inmunológicos, pero ha mejorado, tanto en niños como en adultos, por los muchos avances ocurridos en los últimos 15 años1.
Este trabajo es una revisión de la literatura sobre la terapia inmunosupresora en el trasplante renal en niños y sus principales complicaciones. Su objetivo es generar una base de conocimientos en los estudiantes, internos, residentes, pediatras y médicos generales que se encuentran laborando o rotando en hospitales donde se hacen trasplantes renales en pediatría.
Algunos aspectos del trasplante de órganos en niños son similares a los de los adultos, tales como: las drogas inmunosupresoras utilizadas para la terapia de inducción y de mantenimiento, la creatinina como principal marcador bioquímico, los mecanismos de rechazo del injerto y la utilización de los criterios de rechazo de Banff para su clasificación. Pero otros aspectos difieren entre los niños y los adultos, a saber: los factores inmunológicos, las causas de enfermedad renal terminal, la técnica quirúrgica, el esquema de inmunización antes del trasplante, el metabolismo de las distintas drogas utilizadas y las tasas de infecciones y complicaciones4.
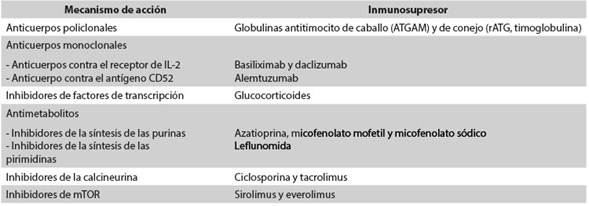
Los avances en los trasplantes renales y de otros órganos han surgido con la aparición de una lista considerable de agentes (Tabla 1) utilizados en dos regímenes de terapia inmunosupresora: primero en la fase de inducción5 y luego en la de mantenimiento6. Los nuevos esquemas inmunosupresores utilizados en la actualidad para la terapia inductora y la de mantenimiento han permitido mejorar la supervivencia del injerto renal5)(6.
TERAPIA DE INDUCCIÓN
El mayor riesgo de rechazo del órgano trasplantado ocurre en las primeras semanas o meses después del trasplante; pasado este período, el riesgo es intermedio durante el primer año del trasplante y posteriormente baja, pero queda latente el resto de la vida6. Existen dos estrategias para disminuir este riesgo: la primera consiste en suministrar altas dosis de los inmunosupresores convencionales; la segunda se basa en la utilización de anticuerpos monoclonales o policlonales contra antígenos de los linfocitos T. La decisión de utilizar dichos anticuerpos depende del órgano que se va a trasplantar, del riesgo inmunológico del receptor y de si se van a utilizar bajas dosis de inmunosupresores en la terapia de mantenimiento6. Los anticuerpos policlonales más utilizados son las globulinas antitimocito de caballo (ATGAM) y de conejo (rATG). Los anticuerpos monoclonales más usados son aquellos contra el receptor de IL-2 (basiliximab y daclizumab) y el dirigido contra el antígeno CD52 (alemtuzumab). En Colombia se cuenta con ATGAM, rATG y basiliximab, pero no con daclizumab y alemtuzumab.
Anticuerpos policlonales
Son muy usados en el trasplante de órganos sólidos. Se preparan mediante la inoculación de caballos o conejos con linfocitos o timocitos humanos, seguida de la purificación de los anticuerpos IgG. La ATGAM y la rATG (timoglobulina) producen una marcada inmunosupresión porque se unen a diferentes antígenos de superficie de los linfocitos T, células asesinas naturales (natural killer cells) y células B evitando así el rechazo7. La dosis utilizada es de 1,5 mg/kg/día por 3-5 días8. Entre sus efectos adversos se encuentra el síndrome de liberación de citocinas, resultado de la activación, lisis y destrucción de los linfocitos6. También se han reportado reacciones anafilácticas9)(10. Además, aumentan el riesgo de infecciones postrasplante y el de malignidad. Otras reacciones incluyen leucopenia, trombocitopenia, exantema, prurito y choque. Para disminuir estas reacciones se utiliza una premedicación con esteroide, antihistamínico y acetaminofén11. La timoglobulina ha permitido disminuir el rechazo agudo y minimizar la inmunosupresión en el trasplante de órganos sólidos. Se ha usado la terapia de inducción con timoglobulina en el trasplante renal de alto o mediano riesgo inmunológico y en pacientes con riesgo de función retardada del injerto12. En Colombia están disponibles las dos globulinas antitimocito, pero nuestro grupo de trasplantes utiliza la leporina.
Alemtuzumab
También denominado con su nombre comercial: Campath1H. Es un anticuerpo monoclonal contra el antígeno CD52, el más frecuentemente encontrado en la superficie celular de los linfocitos T y B, cuya función no es totalmente conocida. También se expresa en algunos monocitos y células NK. El alemtuzumab causa una depleción profunda de los linfocitos, monocitos y células NK. La recuperación de los linfocitos alcanza el 80 % de los valores normales entre los 12 y 18 meses de seguimiento13. Fue aprobado para el tratamiento de leucemia linfocítica crónica de células B. Sin embargo, diferentes grupos de investigadores lo utilizan con resultados satisfactorios como terapia de inducción en el trasplante renal14. Evaluado en ensayos clínicos ha demostrado bajas tasas de rechazo agudo en trasplante renal comparado con otros agentes usados en la terapia de inducción15. Según lo informado por Calne y colaboradores16, se lo ha utilizado como terapia de inducción en trasplante renal en niños desde 1998. Ha mostrado resultados satisfactorios en la terapia de inducción en el trasplante renal pediátrico3)(17)(18)(19)(20)(21)(22)(23. Estudios de alemtuzumab han revelado beneficios en los pacientes de bajo y alto riesgo inmunológico24. Entre los efectos adversos se describe la reacción inicial a la primera dosis, que puede suprimirse con un bolo de corticoide endovenoso junto con acetaminofén y antihistamínicos6. En comparación con otros agentes, no se ha descrito aumento de las infecciones ni de la malignidad13.
Vélez y colaboradores23 hicieron un estudio descriptivo retrospectivo en el que evaluaron niños trasplantados renales entre 2006 y 2010, que recibieron terapia de inducción con alemtuzumab, daclizumab y timoglobulina. Encontraron que la supervivencia del injerto renal fue mejor en el grupo de alemtuzumab (87,5 %) comparado con las otras dos terapias de inducción: timoglobulina y daclizumab (80 %). Este grupo de trasplante renal tuvo una experiencia con el uso de alemtuzumab en 21 niños trasplantados renales, entre 2005 y 2012; todos fueron de donante fallecido, con una supervivencia de los pacientes a 6, 12, 24, 36 y 60 meses luego del trasplante renal de 100 %, 100 %, 95,2 %, 95,2 % y 95,2 %, respectivamente. La supervivencia del injerto renal a 6, 12, 24, 36 y 60 meses fue de 95,2 %, 95,2 %, 90,5 %, 85,7 % y 85,7 %, respectivamente. Estos resultados son similares a los de otros grupos de trasplante renal en pediatría18)(19)(20. Por decisiones de la industria farmacéutica, el alemtuzumab fue retirado de Colombia en 2012, y aunque durante el tiempo que estuvo disponible su uso fue off label, se han publicado experiencias de su seguridad y efectividad. Actualmente nuestro protocolo utiliza basiliximab, como terapia de inducción en los pacientes de bajo riesgo inmunológico y timoglobulina en los de alto riesgo (sensibilizados, antecedentes de trasplantes previos y/o múltiples transfusiones).
Anticuerpos contra el receptor de IL-2
Dos anticuerpos contra el receptor de IL-2 han logrado un lugar importante en el trasplante de órganos: basiliximab y daclizumab, ambos aprobados por la FDA (Food and Drug Administration). El daclizumab es un anticuerpo monoclonal humanizado y el basiliximab, un anticuerpo monoclonal quimérico que se une a la subunidad CD25 del receptor de la interleucina 27. La dosis utilizada en trasplante renal es un bolo de 20 mg IV en el momento del trasplante seguido por un segundo bolo al cuarto día postrasplante8. Sus efectos adversos son infrecuentes, entre ellos las reacciones de hipersensibilidad25.
TERAPIA DE MANTENIMIENTO
Generalmente consiste en un esquema que combina el uso de tres drogas inmunosupresoras convencionales: glucocorticoides, inhibidores de la calcineurina, antimetabolitos e inhibidores de mTOR. Existe una gran cantidad de regímenes que combinan estas drogas, el más usado consiste en utilizar un corticoide con un inhibidor de la calcineurina y un antimetabolito. Pero esta variedad de uso depende del riesgo inmunológico del receptor y de la inmunogenicidad del injerto6)(14.
Se utilizan muchos agentes inmunosupresores en el trasplante renal pediátrico, los más usados son los siguientes:
Glucocorticoides
Constituyen el medicamento aceptado universalmente como primera línea contra el rechazo agudo de órganos trasplantados. Los dos más usados para prevenir dicho rechazo son la prednisolona y la prednisona, sin diferencias en su eficacia y farmacocinética. La prednisona se metaboliza en el hígado a su compuesto activo prednisolona26. La metilprednisolona a altas dosis es la primera línea de tratamiento contra el rechazo en muchos centros en todo el mundo11. Los corticoides cruzan fácilmente la membrana plasmática, se unen a receptores específicos ubicados en el citoplasma celular, que se encuentran normalmente unidos a chaperonas (incluidas las proteínas de choque térmico) cuya función es proteger y prevenir la localización nuclear del receptor27. Al unirse el corticoide y su receptor, se produce la disociación molecular de las chaperonas, lo que desencadena un rápido transporte del complejo al núcleo, donde se une a secuencias específicas de DNA, conocidas como elementos de respuesta a glucocorticoides (GRE, por su sigla en inglés)28.
Su mecanismo de acción se basa en los efectos inmunomoduladores y antinflamatorios, estabilizan las membranas lisosomales, suprimen la síntesis de prostaglandinas, reducen la histamina y disminuyen la permeabilidad capilar29. Pero son muchísimos sus efectos adversos: diabetogénesis, retención de líquidos por actividad mineralocorticoide, hipokalemia, hipertensión arterial, redistribución de la grasa, atrofia de las glándulas suprarrenales, cataratas, glaucoma, úlcera péptica, síndrome de Cushing, necrosis avascular de la cabeza femoral, osteoporosis, psicosis y mala cicatrización11)(27)(28. Existen protocolos libres de esteroides con suspensión temprana de estos. Deluchhi y colaboradores30 mostraron su experiencia en 55 pacientes pediátricos que recibieron esteroides hasta el sexto día, comparados con un grupo control que continuó con los esteroides. A los 5 años de seguimiento observaron, en el grupo que suspendió los esteroides, un impacto favorable en el crecimiento, función renal estable sin aumento en el riesgo de rechazo agudo ni trastorno linfoproliferativo postrasplante30.
Agentes antimetabolito
Son los inhibidores de la síntesis de los nucleótidos, de las purinas (azatioprina y micofenolato mofetil) y de las pirimidinas (leflunomida).
Azatioprina
Fue el primer inmunosupresor utilizado en el trasplante. Es una prodroga sintética, que necesita ser metabolizada a 6-mercaptopurina al remover el grupo imidazólico, luego por acción de dos enzimas, la tiopurina-metiltransferasa (TPMT) y la xantina-oxidasa, se convierte a ácido 6-tioúrico, 6-metilmercaptopurina y 6-tioguanina. Estos compuestos se incorporan al DNA y detienen la replicación11. El 50 % de los pacientes presentan supresión medular (anemia, leucopenia y trombocitopenia) como principal efecto adverso. También pueden ocurrir con este medicamento manifestaciones gastrointestinales como náuseas, vómitos, hepatitis, colestasis y raramente pancreatitis28, y efectos adversos dermatológicos como alopecia, verrugas, herpes zóster, hiperpigmentación y aumento del riesgo de neoplasias31. Existen centros de trasplante de órganos donde no se cuenta con las técnicas necesarias para la determinación de la TPMT, por lo que en estos países se recomienda hacer monitorización de la función hepática y detección de eventos adversos cutáneos.
Micofenolato mofetil y micofenolato sódico
Son prodrogas producidas por especies del hongo Penicillium, que necesitan ser hidrolizadas en el hígado al compuesto inmunosupresor activo, ácido micofenólico, que inhibe de forma no competitiva principalmente la enzima inosina-monofosfato deshidrogenasa (IMPDH) tipo II, bloqueando la producción de nucleótidos de guanosina, como guanosinamonofosfato (GMP)32. El micofenolato mofetil fue aprobado por la FDA en 1995 para uso en trasplante renal33. El ácido micofenólico tiene múltiples efectos celulares: disminuye la síntesis de citocinas, produce depleción de monocitos y macrófagos, altera la formación de anticuerpos, inhibe la glicosilación, disminuye la actividad de la enzima óxido nítricosintetasa inducible (iNOS) y disminuye la replicación bacteriana28. Los efectos adversos más importantes son gastrointestinales: vómito, náuseas, anorexia, dolor abdominal, diarrea y dispepsia. Otros efectos secundarios son: mielosupresión (anemia, leucopenia y trombocitopenia), aumento de infecciones virales (citomegalovirus y herpes simple) y por Candida albicans11. Para mejorar los efectos gastrointestinales adversos y asegurar su eficacia terapéutica se desarrolló una presentación de micofenolato sódico con cubierta entérica (EC-MPS)34.
Inhibidores de la calcineurina
Ciclosporina
Obtenida del hongo Hypocladium inflatum gams y usada como agente inmunosupresor por más de dos décadas. Se la ha utilizado ampliamente en el tratamiento del rechazo a trasplantes y de la enfermedad injerto versus huésped28. Para actuar se une a una proteína intracelular, la ciclofilina, y forma el complejo ciclosporina-ciclofilina, que se une directamente a la calcineurina, inhibiendo la desfosforilación de NF-AT (factor nuclear de células T activadas), con la consecuente inhibición de la expresión de ciertas citocinas, como IL-2 e IL-435. Sus principales efectos adversos están relacionados con la concentración de la droga e incluyen: nefrotoxicidad, hipertensión, dislipidemia, hiperplasia gingival, hirsutismo y neurotoxicidad (temblores, parestesias y cefalea)36. Además, independientemente de la concentración puede inducir microangiopatía trombótica37 y diabetes mellitus postrasplante38.
Tacrolimus
Se conoce también con el nombre de FK506. Es un macrólido obtenido del hongo Streptomyces tsukubaensis. Su mecanismo de acción es parecido al de la ciclosporina: forma un complejo al unirse con la proteína fijadora de FK506-12 (FKBP12), para inhibir la calcineurina, produciendo el bloqueo de la desfosforilación de NF-AT y su translocación al núcleo39. Sus efectos adversos son similares a los de la ciclosporina (tales como nefrotoxicidad, neurotoxicidad y diabetogénesis), pero tiene menos efectos cosméticos que esta14)(33.
Inhibidores de mTOR
Se dispone actualmente de dos inhibidores mTOR: sirolimus (rapamicina), introducido primero, y everolimus, una molécula modificada de sirolimus, aprobada más tarde. La principal diferencia entre los dos es la vida media más corta de everolimus40. La rapamicina (sirolimus) es un macrólido lipofílico obtenido del hongo Streptomyces higroscopicus. Su mecanismo de acción se parece al del tacrolimus, pues el sirolimus se une también a la proteína FKBP12, pero, a diferencia del tacrolimus, no inhibe la actividad de la calcineurina, sino que el complejo sirolimus-FKBP12 es un inhibidor muy específico de la proteína mTOR (mammalian target-of-rapamycin), necesaria para la progresión de los linfocitos T desde la fase G1 a la fase S del ciclo celular40. Ensayos clínicos y estudios observacionales de conversión de anticalcineurínicos a inhibidores de mTOR han mostrado beneficio en la función del injerto renal41. Entre los principales efectos adversos están: metabólicos (dislipidemias), hematológicos (pancitopenia), dermatológicos (eritema y aftas), renales (proteinuria) y alteraciones leves de las enzimas hepáticas. Estos efectos se pueden controlar reduciendo la dosis42. También puede ocurrir neumonía intersticial que cede al suspender el medicamento43.
El grupo de trasplante renal pediátrico del Hospital Pablo Tobón Uribe, en Medellín, no utiliza el protocolo libre de esteroides, sino un régimen que combina un corticoide (prednisolona), con un inhibidor de la calcineurina (ciclosporina o tacrolimus) y un antimetabolito (azatioprina, micofenolato de mofetil). Se utilizan inhibidores de mTOR (sirolimus y everolimus) cuando hay indicaciones claras tales como: nefrotoxicidad por anticalcineurínicos, trastornos linfoproliferativos o cáncer, y en casos escogidos de pacientes con infecciones virales como el virus BK.
COMPLICACIONES DEL TRASPLANTE RENAL
Entre las principales complicaciones del trasplante renal pediátrico se encuentran el rechazo agudo del injerto, las infecciones virales (por poliomavirus-BK y citomegalovirus) y la aparición de malignidades.
El rechazo del injerto renal se produce cuando el sistema inmunológico del receptor reacciona contra el injerto, desencadenando una serie de mecanismos que pueden llevar a la destrucción y pérdida de este44. Clínicamente el rechazo se puede clasificar en hiperagudo (ocurre en los primeros minutos, casi siempre después de liberar el clamp, momento en que ocurre la perfusión del injerto en el procedimiento quirúrgico); agudo (días a semanas), agudo tardío (después de tres meses) y crónico (meses o años después del trasplante)45. También se puede clasificar teniendo en cuenta los hallazgos fisiopatológicos y los mecanismos de daño: celular-intersticial, vascular, humoral. La gravedad (extensión del daño e inflamación histológica) se puede graduar con base en la clasificación de Banff46)(47. La forma más común de rechazo agudo es la celular que se inicia por dos vías distintas de alorreconocimiento; la directa, cuando las células presentadoras de antígenos (CPA) del donante migran del injerto a los nódulos linfáticos del receptor y presentan los antígenos del donante al linfocito T del receptor; y la indirecta, cuando las CPA del receptor procesan proteínas del injerto y posteriormente las presentan al linfocito T del receptor44)(48. En ambas vías de alorreconocimiento están implicados el complejo mayor de histocompatibilidad (CMH), los distintos subgrupos de células T (TH1 y TH2) y la coestimulación45)(49. Los anticuerpos que pueden mediar el rechazo de tipo humoral son aquellos dirigidos contra moléculas HLA, antígenos de la célula endotelial y antígenos del complejo ABO en células endoteliales y eritrocitos50. Generalmente, el rechazo humoral (o rechazo mediado por anticuerpos) se manifiesta como hiperagudo o agudo, en pacientes presensibilizados; sucede en el postrasplante temprano o en pacientes que desarrollan anticuerpos donante-específicos en el período del postrasplante tardío51.
Los tipos de infecciones que se presentan después del trasplante se pueden predecir de acuerdo con el tiempo postrasplante. Durante el primer mes las infecciones son iguales a las que presenta cualquier paciente inmunocompetente sometido a un procedimiento quirúrgico (nosocomiales, aspiración, infección asociada a catéter, infección de la herida quirúrgica, infección derivada del donante, entre otras). Entre el primero y el sexto mes prevalecen las infecciones oportunistas virales como citomegalovirus, Epstein Barr, herpes virus, poliomavirus. Después del sexto mes aparecen infecciones asociadas a la comunidad parecidas a las de la población general52.
Las infecciones por virus oportunistas (principalmente por virus BK, citomegalovirus y Epstein-Barr) han aparecido después del trasplante y probablemente estén relacionadas con los distintos regímenes de inmunosupresores usados en la actualidad, los cuales son más potentes que en décadas pasadas4.
La infección por el virus BK puede expresarse como nefropatía asociada a poliomavirus BK (NAPBK)53)(54. Ocurre entre 4 % y 12 % de los receptores de trasplante de riñón55. El virus BK (VBK) pertenece a la familia de los poliomavirus, junto con el virus Jacob Creutzfeldt (VJC), el virus KI (Instituto Karolinska), el virus WU (Universidad de Washington), el virus del carcinoma de células Merkel y el virus 40 Simiano (SV40)56. La infección por este virus se puede detectar por serología, citología urinaria y la determinación de ácidos nucleicos en plasma u orina por medio de la reacción en cadena de la polimerasa cuantitativa (PCR-Q)57. Para el diagnóstico definitivo de NAPBK se requiere una biopsia del injerto renal con la finalidad de demostrar histológicamente la replicación del virus en el tejido renal58)(59. La tasa de pérdida del injerto secundaria a esta nefropatía es de 50 % a 100 % a los 24 meses en centros sin búsqueda activa del virus BK, motivo por el cual es de gran importancia un diagnóstico temprano de la enfermedad por medio de la realización rutinaria de PCR-Q en el período postrasplante60.
La infección por citomegalovirus (CMV) se puede presentar en receptores de trasplantes renales por infección primaria (el virus es transmitido al receptor por el injerto del donante), reactivación viral (cuando el virus latente en el receptor se activa después del trasplante) o reinfección viral (cuando el virus trasmitido del donante se superpone a un virus reactivado endógenamente)61. Se puede presentar como una enfermedad invasiva en el primer año del trasplante después de completar la profilaxis, y manifestarse con fiebre, neutropenia, linfadenopatías, pancreatitis, neumonitis, trombocitopenia, invasión gastrointestinal, coriorretinitis o meningoencefalitis62. Para el diagnóstico se cuenta con pruebas cuantitativas como la reacción en cadena de la polimerasa (PCR) y la detección del antígeno pp6563.
Entre las enfermedades malignas asociadas al trasplante renal, la más frecuente en niños es el trastorno linfoproliferativo postrasplante (PTLD, por la sigla en inglés de post-transplant lymphoproliferative disorder); se trata de un grupo heterogéneo de enfermedades linfoproliferativas que aparecen después del trasplante de órganos sólidos y hematopoyéticos64. Es una complicación grave cuya incidencia ha aumentado con la introducción de los nuevos agentes inmunosupresores65 y alcanza el 1 % a 2 % de los trasplantes renales66, o sea, 20 veces más frecuente que en la población no trasplantada65. Tiene una distribución bimodal en los pacientes con trasplantes de órganos sólidos, el primer pico ocurre en el primer año postrasplante y el segundo, a los 5 años67. La infección por el virus de Epstein Barr (VEB) es importante en la fisiopatología, porque induce la transformación maligna al infectar las células B68. En los individuos inmunocompetentes la respuesta de los linfocitos T previene el crecimiento de los clones malignos, lo que no sucede en los pacientes inmunocomprometidos, debido a que dicha respuesta se encuentra deteriorada por la inmunosupresión a la que están expuestos69. La clasificación histológica más usada es la de la Organización Mundial de la Salud (2008), en la que se separan las lesiones en cuatro categorías: lesiones tempranas, PTLD polimórfico, PTLD monomórfico y PTLD Hodgkin70. El tratamiento de estas lesiones puede incluir la reducción de la inmunosupresión, su cambio hacia un régimen basado en un inhibidor mTOR, el uso de anticuerpos monoclonales anti-CD20 (rituximab) o la administración de quimioterapia citotóxica69.