INTRODUCCIÓN
Existen más de 100 agentes infecciosos pertenecientes a la familia Herpesviridae, que se divide en tres subfamilias: Alfa-, Beta- y gamma-herpesviridae, esta última incluye el herpesvirus humano tipo 4 o virus de Epstein-Barr (VEB) que tiene un acentuado tropismo por linfocitos B, aunque también puede infectar células T, NK y epiteliales1)(2)(3.
Según la estadística mundial, en países en vías de desarrollo 90 % de los niños se infectan con VEB desde edades tempranas (menos de 3 a 16 años); mientras que en países desarrollados, la infección primaria se presenta en más del 50 % de los casos a edades más tardías (adolescencia y adultez)4)(5)(6)(7. En Colombia, y concretamente en el departamento del Cauca, no existen cifras sobre la epidemiología del VEB, lo que refleja un vacío de conocimiento en este asunto de salud pública y la importancia de abordar este problema en nuestra región.
El VEB se transmite de persona a persona por contacto con la saliva durante el beso, por la sangre, el contacto sexual, los trasplantes o la vía perinatal7. La mayoría de las personas toleran la infección durante toda la vida, sin consecuencias adversas para la salud, porque el sistema inmune controla la producción de viriones8; sin embargo, el virus se puede reactivar periódicamente, como resultado de la alteración en la inmunidad celular9. Durante la infección crónica activa se detectan títulos elevados de anticuerpos contra antígenos de la cápside viral y antígenos tempranos del VEB, así como una gran cantidad de ADN y ARN del virus; además, histológicamente son evidentes la linfadenitis, hemofagocitosis, meningoencefalitis o hepatitis persistente10. El cuadro clínico varía según el estado inmunitario del hospedero; la infección primaria en niños inmunocompetentes suele ser asintomática, y en adolescentes y adultos jóvenes las manifestaciones clínicas corresponden principalmente a mononucleosis infecciosa (MI)4)(11)(12.
Desde 1970 se han publicado investigaciones sobre la relación entre VEB y cáncer13; la recopilación de estos resultados llevó a la Agencia Internacional para la Investigación del Cáncer (IARC, por su sigla en inglés) y a la Organización Mundial de la Salud (OMS) a clasificarlo como agente carcinógeno de tipo I14. Esta revisión recopila, expone y analiza los antecedentes que relacionan la presencia del VEB con el desarrollo de linfomas, carcinoma nasofaríngeo, cáncer de mama, cáncer gástrico y cáncer de pulmón; además, informa sobre las técnicas moleculares ideales para identificar el virus en pacientes con cáncer. Se espera despertar en el lector el interés por profundizar en este campo, teniendo en cuenta que las investigaciones son escasas en Colombia y principalmente en el departamento del Cauca. Por otra parte, debido a que la relación VEB-cáncer es un punto crítico de discusión, el reconocimiento temprano de esta interacción podría mejorar el tratamiento y el pronóstico del paciente con cáncer.
ASOCIACIÓN DEL VIRUS DE EPSTEIN-BARR CON CÁNCER
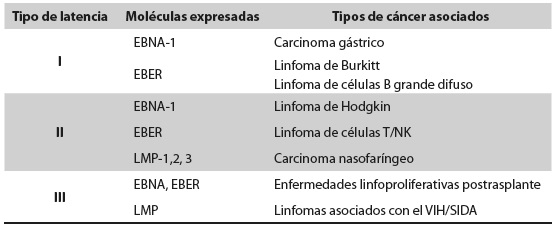
En las últimas décadas se ha logrado demostrar la causalidad y los mecanismos por los cuales algunos virus pueden llevar al desarrollo de cáncer; el VEB no ha sido la excepción, y como resultado, se han propuesto nuevas estrategias preventivas y terapéuticas para abordar esta asociación. El VEB puede infectar células epiteliales y de la línea linfoide, con especial tropismo por células B3)(4)(9)(15. Una vez en el interior celular, el virus es regulado por mecanismos epigenéticos y ha evolucionado para aprovechar la maquinaria epigenética de la célula huésped, establecer una infección latente y posteriormente avanzar a la fase productiva del ciclo lítico16. Durante este proceso, el virus inmortaliza a la célula, estimula la proliferación, induce la expresión de BCL-2 y favorece la evasión de la apoptosis y la respuesta inmune4)(15. La infección latente se caracteriza por la persistencia viral con expresión restringida, ya que el sistema inmune del hospedero inmunocompetente reduce la replicación viral después de la infección y el VEB permanece en el individuo por el resto de la vida, sin causar síntomas agudos de la infección ni dar lugar a antígenos detectables, aunque con el potencial de reactivación y replicación lítica3)(4)(9)(17)(18. Los linfocitos B con infección latente dejan de proliferar, forman centros germinales, se diferencian a linfocitos B de memoria que contienen el genoma del VEB en forma de episomas, y expresan determinadas proteínas latentes de membrana (LMP), proteínas de localización nuclear o antígenos nucleares (EBNA) y dos micro-ARN (EBER-1 y -2), dependiendo del programa de latencia en que se encuentren (I, II, III). Estas moléculas están implicadas en la alteración de las vías de señalización celular y pueden promover el desarrollo de diferentes tipos de tumores de origen epitelial, linfoide o mesenquimal (Tabla 1)9)(19)(20)(21. Por ejemplo, durante la latencia de tipo I el patrón de expresión de EBNA-1 y EBER se asocia con el cáncer gástrico y el linfoma de Burkitt (LB); la latencia de tipo II se encuentra estrechamente relacionada con el linfoma de Hodgkin y el carcinoma nasofaríngeo; y la latencia tipo III está ligada a enfermedades linfoproliferativas postrasplante y a linfomas asociados con el VIH/ SIDA (Tabla 1)4)(6.
VEB Y LINFOMAS
El patrón de reconocimiento del VEB en enfermedades linfoproliferativas está definido por los genes que se expresan o permanecen latentes; así, en la latencia tipo I se expresan predominantemente EBNA-1, EBER y BARF, como en el LB; la latencia tipo II se presenta cuando el VEB infecta linfocitos B primarios y se expresan principalmente EBNA-1, LMP-1, -2A y 2B, por ejemplo en el linfoma de Hodgkin y el linfoma de células T/NK; y la latencia tipo III se presenta cuando se expresan todos los genes latentes (EBNA-1, -2, -3A, -3B, -3C,-LP; LMP-1, -2A, -2B; EBER-1, -2, y BART), este patrón se encuentra típicamente en enfermedades linfoproliferativas postrasplante asociadas a VEB, linfomas asociados con el SIDA y líneas celulares linfoblastoides (Tabla 1)22)(23.
EL VEB fue el primer virus asociado a tumores humanos al ser detectado en linfoblastos cultivados de LB24. Posteriormente, las observaciones de cultivos celulares de LB, mediante microscopía electrónica, permitieron determinar la morfología y biología del virus25. Más adelante, Zur Hausen y colaboradores13 corroboraron la presencia del VEB en biopsias de LB y, además, demostraron su presencia en carcinoma nasofaríngeo; y Weiss y colaboradores26 demostraron por primera vez la presencia de VEB en linfoma de Hodgkin, específicamente en células de Reed Sternberg que expresan EBER, EBNA-1, LMP-1 y 227.
En 1997, Glaser y colaboradores28 hicieron un estudio epidemiológico internacional para hallar la relación entre el VEB y el linfoma de Hodgkin; el estudio contó con 1546 pacientes clasificados por sexo, edad, etnia, subtipo histológico, país de residencia y grado de infección por VEB (determinado por los niveles de expresión de EBER y LMP-1). Los resultados mostraron que 50 % de los pacientes eran positivos para VEB y que este se relacionó mayormente con hispanos, con el subtipo celular mixto, con niños de recursos económicos bajos y provenientes de regiones menos desarrolladas y con hombres jóvenes. Estos resultados mostraron la complejidad de la asociación entre el VEB y el cáncer, y la importancia de nuevos estudios para establecer variables epidemiológicas de mayor asociación.
Se ha demostrado que el VEB es un cofactor importante en el linfoma de Burkitt endémico (africano) y que está presente en 65 % de los linfomas de Hodgkin9)(29; además, está implicado en 50 % de los linfomas sistémicos de linfocitos B, no Hodgkin, de células NK/T y en el total de los linfomas primarios del sistema nervioso central23)(30)(31. El linfoma de Burkitt se clasifica en tres variantes clínicas, de las cuales la endémica y la esporádica se han asociado predominantemente a la infección por VEB, mientras que la tercera es la asociada al virus de la inmunodeficiencia humana32. Estudios posteriores demostraron que el VEB actúa como un factor de crecimiento transformante en células B primarias; todos los casos de LB están relacionados con translocaciones cromosómicas que resultan en la activación constitutiva del oncogén c-MYC33.
En general, los linfocitos B y las células epiteliales infectados por el VEB mantienen una infección latente por la unión del virus al receptor CD21 y por la activación de CD23, lo que se relaciona con la inmortalización de las células B34. Para evadir el sistema inmune, el virus expresa oncogenes como LMP-1 (receptor de CD40), que activa las vías de señalización NF-kβ, JAK/STAT y BCL-2 relacionadas con la producción de citocinas (IL-10) y que influyen en la proliferación celular, la angiogénesis y la respuesta inflamatoria22)(35. Por otra parte, el gen EBNA induce la expresión de genes celulares para la producción de ciclina D y de genes virales como vIL-10 (viroquina), que inhiben la activación de monocitos a través de células T36, acción fundamental para la transformación maligna de los linfocitos B. Por último, EBER-1 y -2, presentes en el núcleo de las células infectadas, se unen al ADN para proporcionar estabilidad y mantener la integridad del genoma viral en la división celular37.
VEB Y CARCINOMA NASOFARÍNGEO (CNF)
El CNF se diferencia en tres variantes histológicas o tipos, a saber: I, carcinoma queratinizante de células escamosas; II carcinoma no queratinizado mal diferenciado; III, carcinoma nasofaríngeo indiferenciado (60 % de los casos). De estos, los de tipos II y III muestran una fuerte asociación con VEB, mientras que el tipo I se relaciona con el tabaquismo y el alcohol38. El CNF es endémico en el Norte de África, el Sureste de Asia y otras regiones orientales, y son raros los casos reportados en Europa Occidental, América del Norte y América del Sur39.
Zur Hausen y colaboradores13 describieron en 1970 la primera evidencia de la asociación entre VEB y CNF. En el mismo año, Henle y colaboradores40 hicieron un estudio para cuantificar anticuerpos antiVEB en pacientes de África Oriental, Hong Kong, India y Francia que padecían tumores de cabeza y cuello. Los resultados mostraron que 84 % de los pacientes con CNF tenían títulos altos para VEB, a diferencia de los que padecían otros tipos de tumores; además, demostraron que al agrupar los pacientes con CNF por estadios de la enfermedad, los títulos anti-VEB aumentaban con la gravedad del carcinoma. Se encontraron diferentes patrones de expresión molecular asociados al VEB en muestras de CNF; la detección de EBER mostró que el virus infectaba prácticamente todas las células tumorales, por lo que se catalogó este micro-ARN temprano del virus como marcador de infección latente tipo II, acompañado de la transcripción de EBNA-l, LMP-l y -2. La expresión de LMP-1 fue variada dentro de células del mismo tumor, lo que podría interpretarse como un patrón mixto de latencia tipos I y II41.
La detección del VEB en células de CNF se hace comúnmente al identificar el antígeno nuclear EBNA-1, presente en más de 80 % de las muestras42; mientras que no se han detectado los genes que codifican para EBNA-2, -3 y -LMP, por lo que se presume que son silenciados en las células tumorales43)(44. Otro indicador específico de la presencia del VEB en el CNF es la expresión de EBER, debido a que no se detecta en epitelios respiratorio y nasofaríngeo normales, ni en tejido adyacente al tumor45. Matalka y colaboradores46 detectaron EBER en 92,3 % de las biopsias de CNF; los resultados indicaron que no existe diferencia en la tasa de detección entre hombres y mujeres o adultos y niños; además, observaron que el VEB se localizaba de preferencia en el espacio nasal posterior, mientras que biopsias obtenidas de nódulos linfáticos cervicales fueron negativas
Las LMP-1 y -2 también se han identificado en CNF, aunque existe controversia con respecto a su expresión por la marcada variabilidad entre los resultados de diversos estudios47)(48. La expresión de LMP-1 es más uniforme en etapas tempranas del CNF y en carcinoma in situ, lo que sugiere que esta proteína puede facilitar la progresión de la enfermedad 49, debido a que concentraciones bajas de la proteína son suficientes para inducir cambios morfológicos y fenotipos invasivos en células de CNF in vitro50)(51. LMP-1 contribuye a la inmortalización de células B y a la transformación y proliferación de fibroblastos (in vivo) y de ciertas líneas de células epiteliales (in vitro)52, promueve la motilidad, la invasión, las metástasis53)(54, la transición epitelio-mesenquimal55 y la angiogénesis56)(57.
Una característica adicional de la expresión génica de VEB en CNF es la intensa producción de transcritos BARF1 con sentido positivo mediante la endonucleasa de restricción BamH. Se ha encontrado BARF1 en más de 85 % de las biopsias de CNF en humanos y se ha demostrado que actúa como oncogén, con la capacidad de inducir proliferación y trasformación celulares y de conferirle mayor agresividad al tumor infectado58.
La Figura 1 esquematiza la manera cómo el VEB, después de infectar las células del epitelio nasofaríngeo, podría dar lugar al desarrollo del cáncer.
VEB Y CÁNCER DE MAMA (CM)
En 1995, Labreque y colaboradores59) publicaron el primer informe de la asociación VEB-CM y demostraron que 21 % de los 91 tumores evaluados fueron positivos para el virus. Bonnet y colaboradores60 sugirieron en 1999 el posible rol del virus en la patogénesis del CM, ya que más de 50 % de las biopsias con CM invasivo primario presentaron amplificación de tres regiones del genoma del VEB: EBER-2, BZLF1 (BamHIZ Leftward Frame 1) y BNLF1 (BamHI N Leftward Frame), mientras que solamente se detectó el virus en el tejido sano peritumoral en 10 % de los casos. En 2012, Glenn y colaboradores61 detectaron el VEB en 68 % de las muestras de CM evaluadas y analizaron 32 estudios publicados sobre la asociación VEB-CM, 25 de los cuales se basaron en análisis por reacción en cadena de la polimerasa (PCR) convencional; de estos, 84 % fueron positivos para VEB en tejido canceroso. En ese mismo año, Zekri y colaboradores62 detectaron EBNA-1 y EBER en 45 % de mujeres egipcias y en 28 % de mujeres iraquíes con CM invasivo; lo anterior indica que la presencia del ADN viral en pacientes con CM puede diferir entre grupos con distribución y características demográficas distintas, lo que podría explicarse por las variaciones del HLA en la población.
Diferentes estudios publicados en las últimas décadas han sustentado el potencial oncogénico de este virus en tejidos mamarios humanos63)(64)(65; sin embargo, aún existe controversia, porque algunos informes no demuestran la asociación66)(67; por ejemplo, Khan y colaboradores68 detectaron el VEB en 50 % de los casos de CM, pero el análisis histológico mostró que el virus estaba presente en linfocitos infiltrantes del tumor y no en células malignas. Algunos autores explican las discrepancias respecto a la asociación VEBCM, por el uso de diferentes técnicas de detección, los genes virales evaluados, los tipos histológicos tumorales, la variación epidemiológica de la infección y el origen geográfico de los casos8)(62)(63)(68)(69.
Pese a la disparidad de los antecedentes, no se debe descartar que la infección por VEB tenga un papel en el CM porque existe evidencia de características virales que podrían conferirle potencial oncogénico. El VEB codifica para la proteína BARF0, que promueve la actividad oncogénica de las células tumorales cultivadas mediante la activación de señales HER-2 y HER-3; a su vez, estas señales favorecen la activación de las cascadas ERK/Akt y el crecimiento celular independiente de anclaje70. También se ha demostrado in vitro que la oncoproteína LMP-1 interactúa con el virus del papiloma humano, disminuye la apoptosis y favorece la proliferación de las células cancerígenas, por lo que la coexistencia de los dos virus podría contribuir al desarrollo de algunos tipos de CM62.
VEB Y CÁNCER GÁSTRICO (CG)
Helicobacter pylori es el principal factor de riesgo para el desarrollo de CG71; no obstante, se ha demostrado que polimorfismos genéticos y la infección por VEB también tienen un papel importante en esta enfermedad72. En 1990, Burke y colaboradores73 describieron la asociación VEB-CG: detectaron el virus mediante PCR en pacientes con CG linfoepitelial indiferenciado. Posteriormente, en 1998, Hsieh y colaboradores74 detectaron el virus en 20,7 % de las muestras de adenocarcinoma de tipo difuso, y en 5,9 % de muestras no tumorales, lo que sugiere que la infección pudo haber ocurrido en la etapa temprana del desarrollo del CG. Truong y colaboradores75 detectaron VEB en 83 % de pacientes con CG y observaron ausencia de la proteína LMP-1, lo que sugiere que no es necesaria en el sostenimiento del estado maligno del tumor, pero podría participar en la fase temprana y posteriormente ser regulada a la baja.
Recientemente, dados los soportes de la asociación VEB-CG, la nueva clasificación molecular del CG incluye un subtipo denominado CaGVEB76, del cual se conocen dos tipos histológicos: el carcinoma gástrico similar al linfoepitelioma o carcinoma gástrico con estroma linfoide (85 % a 95 % de los casos) y el adenocarcinoma (5 % a 15 % de los casos)77)(78)(79. Se sabe que el CaGVEB se presenta en 2 % a 20 % de la población mundial. Anualmente se diagnostican de 200 000 a 876 000 casos nuevos de CaGVEB, que causan 69 081 a 90 000 muertes cada año77)(80)(81)(82)(83. En Colombia, la tasa más alta de mortalidad por CaGVEB se reporta en regiones montañosas y la más baja, en regiones planas; es más frecuente en hombres jóvenes y el subtipo histológico predominante es el adenocarcinoma de tipo difuso84.
Se han propuesto dos mecanismos por los que el virus podría desencadenar el CG: 1) por acción independiente; 2) por sinergia con H. pylori. En cuanto al primer mecanismo, se ha encontrado que EBNA-1 es esencial para mantener el estado de latencia del VEB en el CG y es el único antígeno del virus expresado en todas las neoplasias asociadas al mismo85)(86. Los EBER están sobreexpresados en el CG de tipo intestinal cuando se compara con el de tipo difuso; se ha demostrado que estos micro-ARN están involucrados en los siguientes fenómenos: oncogénesis, adhesión celular, señales de transducción, regulación de la apoptosis, expresión y secreción del factor de crecimiento similar a la insulina y del factor de crecimiento autocrino de las células gástricas cancerígenas75)(85)(87.
Respecto a la sinergia con H. pylori, se han planteado algunas hipótesis sobre cómo la interacción entre los dos patógenos podría favorecer el desarrollo del CG: a) un efecto aditivo de la inflamación (gastritis grave) producida por los dos agentes infecciosos incrementaría el daño tisular, con mayor riesgo de desarrollar lesiones precancerosas; b) interacción entre moléculas del VEB (Zta, factor de transcripción involucrado en el ciclo lítico) y de H. pylori (CagA, oncoproteína que induce pérdida de la polaridad de las células epiteliales) mediada por la proteína cinasa C72)(88)(89)(90; c) producción de monocloroamina oxidante por parte de H. pylori, compuesto que favorece la replicación del VEB latente en el epitelio gástrico; induce cambios morfológicos y la expresión del antígeno temprano (EA) del virus en células cancerígenas91; sin embargo, se desconocen las implicaciones directas que tendría este último mecanismo en el desarrollo del CG.
VEB Y CARCINOMA PULMONAR (CP)
No se considera al VEB como un factor de riesgo principal en el desarrollo de CP; sin embargo, algunas investigaciones evidencian la asociación VE-CP. En 1978 se informó92 el caso de un hombre de 40 años con una neoplasia primaria en el lóbulo superior del pulmón izquierdo; diferentes características indicaron que podría estar relacionada con el VEB: morfológicamente el tumor recordaba una variante no queratinizada del CNF y el perfil serológico mostró un drástico incremento en los títulos de anticuerpos contra el antígeno de cápside viral (VCA, por su sigla en inglés), EA y EBNA durante la evolución de la enfermedad. Chen y colaboradores analizaron diferentes tipos de CP en busca de VEB, por medio de PCR e hibridación in situ (ISH) para EBER-1 y encontraron que todos los carcinomas similares a linfoepitelioma (LE) eran positivos para el virus y para la oncoproteína bcl-293; esto sugiere que el virus podría tener un rol importante en la carcinogénesis94. Aunque el LE es el subtipo de CP más asociado a la infección por VEB95, dicha asociación ha sido controversial. En 2001 se analizaron seis pacientes con LE primario de pulmón y no se detectó el genoma viral en ninguno de ellos; los autores, basados en el análisis de información previa, sugirieron que la asociación entre VEB y LE de pulmón podría estar influenciada por factores raciales y geográficos, pues se ha detectado el virus en pacientes asiáticos y no en occidentales diagnosticados con este tipo de cáncer96. De igual manera, Chu y colaboradores97 evaluaron en 2004 la infección por VEB en 23 casos de pacientes americanos con carcinoma de células pequeñas, usando diferentes metodologías; solamente nueve de ellos fueron positivos con una sola técnica. Dada la falta de concordancia entre los ensayos, estos resultados se interpretaron como falsos positivos y se concluye que la evidencia de la infección no es convincente.
La discrepancia en la asociación aún se mantiene. En 2011, Koshiol y colaboradores98 utilizaron tecnología de última generación (microarreglos y PCR en tiempo real) para la detección del VEB en CP; sin embargo, los resultados no fueron consistentes entre las dos técnicas, lo que se explicaría probablemente por la falta de correlación entre los niveles de pre-microARN (cuantificados por microarreglos) y micro-ARN maduros (cuantificados por PCR) en el CP. En 2013, Jafarian y colaboradores99 encontraron el genoma del VEB solo en 5 de 48 muestras de CP y en 2 de los 42 controles, por lo que concluyeron que el virus no tiene un papel importante en el cáncer no similar a LE, pero podría participar en el desarrollo de otros tipos de CP como el carcinoma de células escamosas. Controles con infiltrados linfopolimorfonucleares crónicos podrían haber influido en los resultados y reflejar diferencias no significativas entre los grupos.
Pese a lo anterior, recientemente se ha encontrado que la activación y sobreexpresión de EBI3 es determinante en la progresión del CP; esta proteína se asocia a un mal pronóstico y podría ser un biomarcador incluso en etapas tempranas de CP, o como un blanco terapéutico molecular para este tipo de cáncer100.
TÉCNICAS DE DETECCIÓN DE VEB EN TUMORES
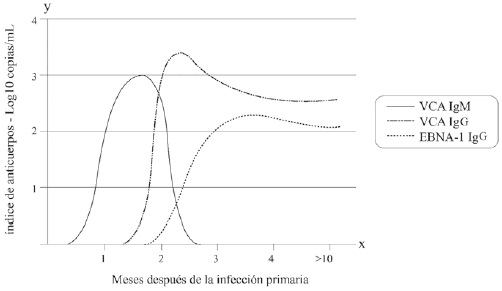
Hay varias técnicas para la detección de VEB en tumores. Desde los años 90 se han usado metodologías moleculares como Southern blot, PCR, inmunohistoquímica, ISH para la detección de los antígenos virales y amplificación basada en secuencia de ácidos nucleicos9)(11. Para detectar anticuerpos específicos (IgG, IgM o IgA) dirigidos contra los antígenos VCA, EA y EBNA, se han empleado inmunofluorescencia indirecta, aglutinación, ensayo por inmunoabsorción ligado a enzimas (ELISA), inmunocromatografía y Western blot. Los primeros que se detectan son los anticuerpos IgM frente a los VCA y, posteriormente, aparecen los IgG anti-EA e IgG anti-VCA (Figura 2)9)(15.
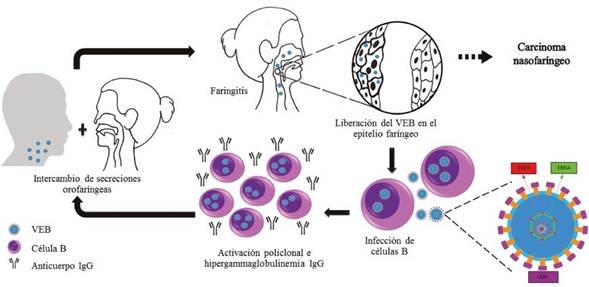
Figura 2 Rol del VEB en el carcinoma nasofaríngeo. Una vez el VEB invade las glándulas salivales o el epitelio faríngeo, se multiplica en ellos para luego liberarse en la saliva y secreciones respiratorias. En ocasiones, el virus transforma las células del epitelio faríngeo para dar origen al carcinoma nasofaríngeo. El VEB infecta linfocitos B, que posteriormente sufren activación policlonal y semanas después producen anticuerpos IgG. Estas células estimulan la producción de linfocitos atípicos, que eliminan e inhiben las células B infectadas por el virus y suprimen la producción de inmunoglobulinas
En algunos tipos de cáncer (por ejemplo, CM) la detección del virus es laboriosa debido a la baja carga viral61; para superar este inconveniente se han utilizado técnicas como PCR in situ con el fin de lograr mayores sensibilidad y especificidad60, pues la PCR convencional no puede probar la presencia del virus en células tumorales8)(66. De igual manera, la ISH para la detección de EBER (conocida como EBERISH) es una de las técnicas recomendadas para estas investigaciones y se ha convertido en el estándar de oro para la detección del virus, dada la mayor especificidad en cuanto a localización celular, y la alta sensibilidad, como resultado de la abundante expresión de estas moléculas en el lugar de la infección14. Recientemente se ha estado utilizando la captura por microdisección láser, posterior a la amplificación por PCR, con el fin de hacer un análisis molecular preciso de las poblaciones celulares purificadas, confirmar la localización del virus en el tejido tumoral64 y sacar conclusiones contundentes respecto a la asociación de la infección viral con el desarrollo de cáncer.
CONCLUSIONES Y PERSPECTIVAS FUTURAS
Esta revisión abre muchas preguntas que podrían abordarse en el futuro, tales como: ¿realmente es el VEB el agente causal de todos los tipos de cáncer con los que se ha asociado? ¿El cuadro clínico del paciente con cáncer VEB positivo empeora respecto a un VEB negativo? ¿Dada la prevalencia del VEB en la población habría mayor riesgo de desarrollar CNF dentro de algunos años, tal como sucede en países asiáticos? ¿H. pylori actúa en sinergia con VEB en el desarrollo del CG y, si es así, de qué forma? ¿El tratamiento de la infección viral en los pacientes con cáncer podría mejorar su pronóstico y calidad de vida? ¿Existe un mecanismo molecular común que explique el papel del VEB en las diferentes malignidades? ¿Puede el virus interactuar con biomarcadores expresados en los diferentes tipos de cáncer?
Los avances tecnológicos recientes posibilitan abordar estas preguntas y asumir los retos de la detección del VEB en tejidos tumorales. Como resultado de esta revisión, nuestro grupo de investigación en Inmunología y Enfermedades Infecciosas de la Universidad del Cauca iniciará un proyecto para detectar este herpesvirus en biopsias de pacientes con adenocarcinoma gástrico de tipo intestinal, una enfermedad prevalente en el Suroccidente colombiano. De resultar positiva la asociación, investigaciones posteriores se deberán enfocar en el análisis exhaustivo de genes y proteínas virales que alteran las vías de señalización célula - matriz extracelular - célula, favoreciendo la transformación maligna y la perpetuación del microambiente tumoral. La investigación sobre estas asociaciones es de gran significancia ya que podría ser un indicador de utilidad pronóstica y diagnóstica; además, podría ser un blanco molecular para lograr mejores terapias y justificar campañas de prevención de la transmisión de virus con potencial oncogénico8)(101.
Dado que el rol del VEB en el desarrollo de cáncer ha sido bien documentado mundialmente, es necesario incrementar los esfuerzos en la investigación de este problema en nuestro país y a nivel regional, debido al gran impacto social que tendría sobre los comportamientos culturales inadecuados que en la actualidad favorecen la transmisión del virus. Esperamos que la presente revisión sea de utilidad para ampliar el conocimiento de los lectores, actualizar la información sobre algunos conceptos específicos, métodos diagnósticos y aspectos patogénicos del VEB en la carcinogénesis. Todo lo anterior con el fin de establecer estrategias de prevención, diagnósticos acertados, desarrollar terapias más eficaces y ofrecer mejores pronósticos en pacientes oncológicos VEB positivos.