INTRODUCCIÓN
El virus linfotrópico humano tipo 1 (HTLV-1), se clasifica dentro de la familia Retroviridae debido a su estructura genómica, y está catalogado como un oncovirus por su patogenicidad1. Fue aislado por Poeisz y colaboradores a partir de células T malignas presentes en personas que padecían un tipo de neoplasia conocida como linfoma cutáneo de células T2. Actualmente la infección por el virus, que aún carece de tratamiento específico, afecta globalmente al menos a 5 a 10 millones de personas y se distribuye por todas las latitudes del mundo incluso países no endémicos, como resultado de la inmigración de portadores procedentes de zonas endémicas y de habitantes nativos que tienen relaciones sexuales con ellos3. Su período de incubación puede abarcar desde años hasta décadas y su transmisión ocurre por contacto sexual, transfusiones sanguíneas, uso compartido de agujas y de madre a hijo por la leche materna4)(5.
El virus invade principalmente los linfocitos T CD4+ y CD8+, generando trastornos como leucemia/linfoma de células T en el adulto (LTA) y una mielopatía inflamatoria crónica y progresiva conocida como mielopatía asociada al HTLV-1 (MAH), caracterizada por un cuadro clínico de paraparesia espástica simétrica y alteraciones vesicales, entre otra variedad de síntomas6. Además de ser el agente etiológico de estos trastornos, el virus está relacionado con otras enfermedades, entre ellas, uveítis, tiroiditis, artritis, síndrome de Sjögren, cistitis crónica, polimiositis, carcinoma, tuberculosis, estrongiloidiasis. En el caso de estas dos últimas la relación se basa en que el virus produce cierto grado de inmunosupresión7)(8.
No todas las personas infectadas por el retrovirus desarrollan procesos patológicos: entre 1 % y 5 % de ellas desarrollan LTA y entre 3 % y 5 %, MAH; las demás permanecen como portadores asintomáticos por el resto de la vida9)(10. Sin embargo, en zonas endémicas como en el departamento del Cauca, la mayoría del personal de la salud desconoce la existencia de este virus, que puede llegar a ser mortal, pero es infrecuente y de difícil diagnóstico, además de que su sintomatología se puede confundir fácilmente con la de otros procesos neurológicos. Con esta revisión se pretende compilar la información más sobresaliente acerca del virus HTLV-1 y su manifestación neurológica más común, la paraparesia espástica, con el fin de ampliar el conocimiento sobre los aspectos básicos de esta enfermedad, contribuir a la difusión de un problema de salud poco conocido y de esta manera evitar que el virus pase inadvertido en la población.
HISTORIA
En 1980, HTLV fue el primer retrovirus humano descubierto, aislado de un paciente con linfoma cutáneo de células T2. En 1982, Yoshida y colaboradores11 identificaron un virus tipo C como causa de una enfermedad previamente descrita en 1977 en Japón, conocida como leucemia de células T en el adulto (LTA); tiempo después se demostró que este virus y el HTLV tenían secuencias genómicas idénticas, por lo que recibió el nombre de “HTLV tipo 1” y su enfermedad asociada “leucemia/linfoma de células T en el adulto”12. Posteriormente, se describieron tres tipos más de HTLV, de los cuales HTLV-1 y HTLV-2 se conocen como agentes etiológicos de enfermedades en seres humanos, mientras que HTLV-3 y HTLV-4 se han asociado con enfermedades en animales13)(14. En la isla de Martinica en el Caribe, al estudiar pacientes que presentaban “paraparesia espástica tropical” (PET), Gessain y colaboradores15 encontraron en 1985 anticuerpos para HTLV-1. Un año después, investigadores japoneses reportaron la asociación del virus con un trastorno similar al que denominaron “mielopatía asociada al HTLV-1” (MAH)16, lo que generó cierta confusión en el momento de usar los términos PET y MAH, razón por la cual la Organización Mundial de la Salud (OMS) recomendó utilizar los nombres PET/ MAH (en español) o TSP/HAM (en inglés) para los dos síndromes17. En años recientes se ha demostrado que el virus no solo afecta las regiones tropicales por lo que la sigla PET no es totalmente adecuada y se recomienda el uso de la sigla MAH.
EPIDEMIOLOGÍA
El HTLV es de origen africano, se cree que en el pasado fue transmitido desde primates infectados a seres humanos no infectados18. Paulatinamente se diseminó a nivel global, como resultado del tráfico viral causado por las migraciones humanas desde zonas con alta prevalencia a otras de prevalencia baja o nula; actualmente de 5 a 10 millones de personas están afectadas por el virus, con excepción de la Antártida y el Polo Norte19)(20. Las zonas endémicas del virus son las regiones intertropicales de África (Guinea, Zaire, Gabón), el sur de Japón, la cuenca del Caribe, áreas localizadas de Irán, Melanesia, Australia y países de Sudamérica: Perú, Chile, Brasil y Colombia20)(21.
Se considera que las tasas de prevalencia del virus en Japón son las más altas del mundo: se calcula que había un total de 1,08 millones de portadores virales en la población general entre los años 2006 y 200722. En África, la prevalencia es de 0,2 % en algunas regiones del Este y alcanza más del 25 % en la región central; Gabón es el principal foco endémico del continente africano23. Europa ha reportado casos en Francia, Reino Unido, Rumania y España; en este último país se informaron 253 casos de HTLV-1 hacia finales del año 201320)(24. Con respecto a Sudamérica, se han informado casos en Brasil, Perú, Venezuela, Argentina y Colombia, y es más frecuente encontrarlo en personas con raíces africanas o en poblaciones indígenas25)(26)(27)(28.
En Colombia, Zaninovic describió en 1981 el caso de un paciente con PET en la región de Tumaco (Nariño)17. Aunque inicialmente esta enfermedad fue considerada como una treponematosis, en 1988 se la asoció con la infección por HTLV-1 y se calculó una prevalencia inicial del 0,098 % del virus en dicha región29. Posteriormente, en el Cauca (1991)30 se describieron dos casos de pacientes procedentes de la región andina de Belalcázar con una mielopatía de evolución lenta e invalidante; estos casos fueron los primeros informados en la población indígena, demostrando que la PET no necesariamente es prevalente en zonas costeras.
Hasta el momento, la distribución del virus en Colombia varía considerablemente de una zona geográfica a otra, afecta a personas de todas las razas y condiciones sociales, y se calcula que la prevalencia varía entre 7,5 % y 10 % en las zonas costeras del Pacífico31. Se han informado casos en los siguientes departamentos: Nariño, Cauca, Cundinamarca, Amazonas, Putumayo, Antioquia, Valle del Cauca, Córdoba y Risaralda, y en poblaciones indígenas como los embera17)(19)(32)(33)(34)(35)(36)(37)(38)(39.
Entre 2010 y 2014 se informaron 7 casos de HTLV-1 en las regiones de Nariño, Putumayo, Valle del Cauca, Risaralda y Caribe. Los más recientes han sido los tres casos reportados por Ruiz y Ramírez (2013) en el municipio de Salahonda (Nariño)19)(35)(37)(40. Pese a las cifras mostradas anteriormente, existen regiones donde no se han llevado a cabo estudios epidemiológicos del virus, lo que ha limitado el conocimiento de su prevalencia.
MEDIOS DE TRANSMISIÓN
A diferencia de otros retrovirus como el VIH, el HTLV-I es menos infeccioso y su transmisión suele requerir el contacto directo entre células41; se transfiere mediante aquellas que contienen el provirus y con algunas excepciones por viriones libres1. Se han descrito cuatro vías de transmisión: vertical (madre a hijo), por transfusiones sanguíneas, por contacto sexual y por el uso compartido de agujas, especialmente en usuarios drogodependientes intravenosos42.
La transmisión vertical ocurre principalmente por la leche materna, en cuyo caso el riesgo de infección para los niños nacidos de madres seropositivas para el virus depende de factores como la carga proviral en la leche materna, la duración de la lactancia materna (más de seis meses), la edad de la madre y la concordancia del alelo del complejo mayor de histocompatibilidad HLA (antígenos leucocitarios humanos) clase 1 entre la madre y el hijo43)(44. De acuerdo con diversos estudios en poblaciones endémicas, la tasa total de transmisión vertical es mayor del 25 %45 y la transmisión durante la gestación o en el parto ocurre en menos del 5 % de los hijos de madres infectadas5. Se calcula que el riesgo de infección del virus por transfusiones de sangre contaminada es del 50 % al 70 %, y que disminuye cuando la sangre se mantiene almacenada por más de una semana44)(46.
Respecto a la transmisión por contacto sexual, se considera que la infección es más prevalente en mujeres, ya que es alta la probabilidad de transmisión de hombre a mujer, debido a que hay mayor población viral en el semen, donde el virus se replica más rápido. Sin embargo, el riesgo de transmisión de mujer a hombre aumenta si este último presenta úlceras en el pene como consecuencia de enfermedades de transmisión sexual como sífilis, herpes simple genital y linfogranuloma venéreo19)(41.
Varios países han adoptado medidas con el fin de evitar o disminuir el riesgo de infección por el virus. Japón les hace la prueba serológica para el virus a todas las mujeres lactantes y en caso de resultar positiva, se suspende la lactancia materna47. En situaciones como esta, en Perú recomiendan suspenderla siempre y cuando la familia del lactante pueda garantizar una alimentación artificial adecuada y segura; de lo contrario, se sugiere mantener la lactancia por un período no mayor de seis meses7. Esta medida ha tenido consecuencias positivas, ya que la prevalencia en la población de Okinawa (Japón) disminuyó de 9,1 % entre 1968 y 1970 a 7,8 % entre 1981-1984 y a 6,3 % entre 1996 y 199847, lo cual demuestra que esta medida es efectiva y puede regular en parte la incidencia del virus en regiones endémicas.
VIRUS LINFOTRÓPICO HUMANO TIPO 1 (HTLV-1)
El HTLV-1 es un retrovirus tipo C clasificado en el género Deltaretrovirus perteneciente a la subfamilia Orthoretrovirinae, al que se le han demostrado propiedades oncogénicas48. Posee una estructura redondeada, envuelta por una bicapa proteolipídica equipada con glicoproteínas virales transmembrana (gp21) y proteínas de superficie (gp46)5. Su cápside tiene forma icosaédrica y su nucleocápside tiene aproximadamente 100 nm de diámetro; esta última alberga proteínas como p19, p24 y p15, que a su vez encierran el componente enzimático (integrasas, transcriptasa inversa y proteasas) del virus5)(49. Su genoma está constituido por dos cadenas simples de ARN, de polaridad positiva, formadas por 9032 nucleótidos aproximadamente, que incluyen genes como gag, pro, pol y env, que codifican para diversas proteínas esenciales para el funcionamiento viral50)(51. El gen gag, por ejemplo, codifica para diversas proteínas de la nucleocápside (p15, p19 y p25); el gen pro codifica para la enzima proteasa viral; el gen env codifica para las glicoproteínas gp21 y gp46 y el gen pol codifica para las enzimas integrasa, proteasa y transcriptasa reversa50)(51.
Además, el virus presenta una región adicional llamada pX, encargada de codificar para proteínas reguladoras como Tax (p40), Rex (p27) y HBZ, implicadas en los procesos de infección, persistencia y proliferación virales, y otras proteínas estructurales como p12, p13, p21 y p3048.
MECANISMO DE ACCIÓN
El virus tiene como principal blanco de infección los linfocitos T CD4+, aunque también es capaz de infectar linfocitos T CD8+, células B, células dendríticas y células sinoviales51.Cuando ocurre la infección de células T CD4+, en su fase inicial o asintomática el HTLV-1 induce la activación de las células T CD8+, hecho que lleva a dos eventos: disminución del número de células infectadas y elevación de las citocinas proinflamatorias44. La infección de estas células, con excepción de las dendríticas, se da por un mecanismo conocido como “contacto célula-célula” o “sinapsis viral” mediante el cual se dispone un área de contacto de aproximadamente 26 nm entre ambas células, generando una ruta que permite la transferencia de viriones libres desde la matriz extracelular de la célula infectada hacia la matriz extracelular de la célula sana52)(53. En las células dendríticas los viriones libres entran directamente a la matriz extracelular de la célula sana53.
Algunos viriones entran al citoplasma de la célula huésped, donde se produce la transcripción del ARN genómico viral en una cadena doble de ADN, que se integra de modo aleatorio al genoma del huésped51)(54. De esta manera, el virus toma el control celular, genera un aumento del número de copias del genoma viral (proceso que se mantiene por la expansión clonal de linfocitos T) y promueve la expresión de genes reguladores virales como tax, rex, HBZ, entre otros51)(55. Receptores como el transportador de glucosa 1 (GLUT-1), la neuropilina-1 (NRP-1) y el proteoglicano heparán sulfato están implicados en el proceso de unión y entrada del virus a la célula huésped54.
El papel que cumple el gen tax ha sido clave para mejorar la comprensión de la patogénesis, ya que activa el factor nuclear κβ (NF-κβ) y la transcripción de genes involucrados en el crecimiento y proliferación virales, e inhibe la apoptosis por supresión de las proteínas p16 y p53 y la degradación de la proteína del retinoblastoma (Rb), siendo capaz de iniciar procesos que conducen a la aparición de LTA51)(56. Las células infectadas por el virus que expresan el gen tax son blanco del sistema inmune; sin embargo, después de los estados iniciales de infección, el virus es capaz de detener la producción de tax y de esta manera evadir el sistema inmune57.
La proteína HTLV-1 Basic Leucine Zipper factor (HBZ) estimula la proliferación celular a través del E2F-1 y permite el avance sobre el punto de control G1/S del ciclo celular, lo que lleva a la transformación maligna en LTA48)(58. Esta proteína también suprime la expresión del gen tax, facilitando la evasión de las células infectadas por el HTLV-1 frente al efecto citotóxico de las células T CD8+48)(51)(58.
En el individuo infectado, el HTLV-1 induce la producción de citocinas neurotóxicas (TNF-α, IFN-γ, IL-2) y quimiocinas (CXCL9, CXCL10) que pueden lesionar lenta y silenciosamente los segmentos medulares comprometidos51)(59. De igual manera, las células T reguladoras (Treg) infectadas disminuyen de forma drástica la expresión del factor regulador de transcripción Foxp3 y de citocinas antiinflamatorias (IL-10 y TGF-β) afectando su función51 (Figura 1).
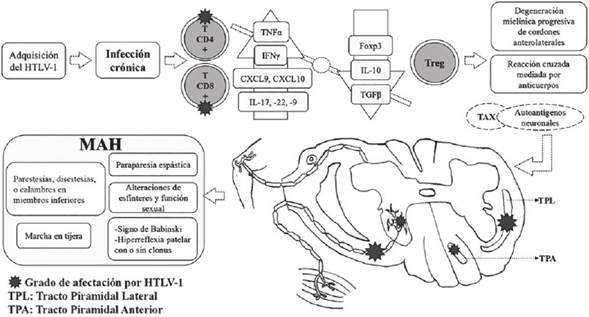
Figura 1 Patogénesis del HTLV-1 en la MAH. Luego de la infección primaria, el HTLV-1 promueve una serie de fenómenos inflamatorios que favorecen el aumento de los niveles de las citocinas TNF-α, IFN-γ e IL-17, y la disminución del factor de transcripción Foxp3 y de las citocinas IL-10 y TGF-β, por parte de los Treg. De esta manera, se desarrolla una respuesta inflamatoria por reacción cruzada contra los autoantígenos neuronales, gracias a su similitud con la proteína viral Tax. La afección de los cordones medulares en uno o más segmentos determina la aparición de las manifestaciones clínicas características de la MAH
Se han reconocido otras subpoblaciones de células T en los segmentos medulares afectados por HTLV-1: células Th17 productoras de IL-17 e IL-22, y células Th9 productoras de IL-9, citocina promotora de la proliferación celular e inhibidora de la apoptosis, funciones que podrían favorecer y prolongar la inflamación y la degeneración tisular relacionadas con la infección crónica51. Niveles elevados de IL-17 en pacientes infectados por HTLV-1 están involucrados en la estimulación y la prolongación del proceso inmunopatológico de la MAH51 (Figura 1).
MIELOPATÍA ASOCIADA AL HTLV-1 (MAH)
Patogenia
Se ha descrito, como posible mecanismo patogénico de la MAH, la proliferación espontánea que surge en los linfocitos T CD4+ y CD8+ infectados por el virus HTLV-1, los cuales, por razones desconocidas, atraviesan la barrera hematoencefálica (BHE) y entran al sistema nervioso central, donde producen citocinas proinflamatorias como IFN-γ y TNF-α, desencadenando un proceso inflamatorio que termina con la degeneración axomielínica en los cordones anterolaterales de la médula espinal torácica y/o lumbar51)(60. Además, se sugiere la existencia de antígenos virales similares a antígenos propios de las células gliales; como resultado, los linfocitos T infectados atraviesan la BHE, atacan las células gliales y producen una respuesta autoinmune con inflamación y daño en el sistema nervioso61 (Figura 1).
La respuesta del individuo contra el HTLV-1 depende esencialmente de su sistema inmune. Se han encontrado polimorfismos genéticos que modulan la expresión de alelos HLA, como el HLA-DRB1, que se expresa altamente en pacientes con MAH59. En contraste, se ha descrito que existe un factor protector dado por los alelos HLA-A y HLA-Cw, que se asocian a una carga proviral menor en individuos asintomáticos, lo que determina menor susceptibilidad a desarrollar MAH44.
Cuadro clínico, evolución y diagnóstico diferencial
La paraparesia espástica asociada al HTLV-1 se clasifica como un trastorno neurológico de la motoneurona superior de causa exógena, inflamatorio y desmielinizante, que afecta principalmente la médula espinal y el cerebro. Se considera la manifestación neurológica más común del HTLV-1 y se presenta por lo general en personas mayores de 40 años, aunque se han reportado casos desde los 20 años; afecta en mayor proporción a mujeres que a hombres de todas las razas y condiciones sociales28)(37. Se inicia como una mielopatía de forma lenta, silenciosa y progresiva, caracterizada principalmente por lesiones del tracto piramidal, con menor afectación de las columnas posteriores (propiocepción y vibración) y de las columnas laterales medulares (dolor y tacto superficial)54.
Los pacientes aquejan ciertos signos y síntomas que son comunes e inespecíficos. Algunos de ellos podrían ser considerados prodrómicos de la enfermedad tales como: parestesias, disestesias, sensación quemante o calambres en los miembros inferiores y alteraciones de los esfínteres y de la función sexual. Estos dos últimos pueden anteceder muchos años a la paraparesia, e incluyen aumento de la frecuencia miccional, nicturia, incontinencia urinaria, intestino neurogénico y disfunción eréctil40)(60)(62. Concomitante o posteriormente, se presentan dolor en la región lumbar en 70 % de los pacientes, ataxia cerebelosa (5 % a 20 %) y disminución de la fuerza con espasticidad progresiva en ambos miembros inferiores (paraparesia espástica) en 97,8 % de los casos aproximadamente, conservando por lo general la fuerza en los miembros superiores40)(63. La debilidad e hipertonía musculares se inician de forma asimétrica en una pierna, pero con el paso del tiempo hay compromiso de la otra, y es posible encontrar mioclonías en una o ambas piernas54. Esta debilidad aumenta progresivamente, y en la mayoría de los casos aparece marcha espástica o en tijera, en la que los pacientes caminan con las rodillas en aducción y los pies en abducción, cruzándose las rodillas alternadamente a medida que avanzan con dificultad. El deterioro de la marcha puede evolucionar hasta llegar al punto en que se vuelve incapacitante y el paciente debe hacer uso de objetos que le ayuden a desplazarse, tales como bastones, muletas y caminadores. Finalmente, cerca de un tercio de los pacientes terminan en silla de ruedas y cerca de la mitad requieren prótesis para deambular19)(37.
El examen neurológico no muestra alteraciones en la esfera mental ni en los nervios craneales; sin embargo, también se puede presentar hiperreflexia patelar y aquiliana con o sin clonus y signo de Babinski o sus sucedáneos, de forma bilateral19)(37. Se ha informado que hasta 33 % de los pacientes pueden desarrollar algún déficit motor en las extremidades superiores, y en algunas ocasiones se encuentra el signo de Hoffman54)(60. Los trastornos sensitivos son mínimos e incluyen hipoestesias distales en las extremidades, raramente a nivel torácico y lumbar, así como hipopalestesia y alteraciones en la propiocepción en los tobillos y pies54)(63. Tanajura y colaboradores64 observaron en 2015 el desarrollo de signos y síntomas neurológicos hasta en 30 % de los infectados asintomáticos en una cohorte seguida por 8 años, reafirmando también la alta frecuencia de presentación de síntomas urinarios. El progreso de la enfermedad suele ser de varios meses a años, pero en algunos pacientes el comienzo es agudo seguido de rápido deterioro de la condición clínica, que en 10 % a 20 % de los casos puede llevar a alteraciones graves de la marcha durante los primeros tres meses. Esta rápida evolución clínica ocurre generalmente en pacientes mayores de 60 años54)(65.
En un estudio llevado a cabo en 2006 por Olindo y colaboradores66, se calculó que el tiempo que transcurre desde el inicio de la enfermedad hasta que el paciente comienza a usar bastón, caminador o silla de ruedas es de 6, 13 y 21 años, respectivamente. Otras complicaciones asociadas a la MAH pueden incluir retención urinaria, infecciones urinarias recurrentes, falla renal, alteraciones del aparato respiratorio, coinfecciones con Strongyloides stercoralis ,VIH y neumonías8.
El diagnóstico diferencial incluye una amplia variedad de trastornos cuya presentación clínica se puede confundir fácilmente con la MAH. Estos trastornos incluyen, entre otros: esclerosis lateral primaria, esclerosis múltiple, síndromes meníngeos, síndrome del cono medular, esclerosis lateral amiotrófica, infección por VIH y polimiositis67)(68. La polimiositis forma parte de las miopatías inflamatorias asociadas al HTLV-1 de las que se han reportado varios casos69)(70)(71)(72; puede aparecer sola o como una complicación tardía de la MAH y es un diagnóstico importante para tener en cuenta en pacientes con MAH que desarrollen un patrón de debilidad muscular más proximal, mialgias y concentraciones elevadas de creatina fosfoquinasa (CPK); a diferencia de la polimiositis idiopática, esta tiene un curso más prolongado con resistencia a la terapia con esteroides69)(72. Araújo y colaboradores68 establecieron en 2009 una clasificación de los trastornos en los que consideran obligatoria la búsqueda de HTLV-1: polimiositis, infección por VIH y esclerosis múltiple; y de aquellos en los que es aconsejable su búsqueda: síndrome del cono medular, miositis por cuerpos de inclusión y esclerosis lateral amiotrófica.
DIAGNÓSTICO CLÍNICO Y MOLECULAR
El diagnóstico del HTLV-1 se hace mediante la detección de anticuerpos específicos contra el virus tanto en sangre como en líquido cefalorraquídeo (LCR), utilizando ensayos de tamizaje como el inmunoensayo ligado a enzimas (ELISA)73. En cuanto a este, si el primer resultado es reactivo, se recomienda repetir la prueba; si el segundo también lo es, la muestra se considera verdaderamente positiva. La desventaja de la prueba de ELISA es que no permite distinguir entre los subtipos de HTLV7. Esta dificultad en la identificación de los subtipos virales se debe a que los virus HTLV-1/HTLV-2 presentan homología del 60 % de su genoma6; por tanto, es necesario hacer la prueba de Western Blot (Wb), que confirma la infección y define el resultado para anticuerpos contra HTLV-1/273. En caso de que tanto el ELISA como el Wb den resultados indeterminados, se recomienda hacer la prueba de reacción en cadena de la polimerasa anidada (nPCR) para confirmar si el HTLV es tipo 1 o 228.
El HTLV-1 es un virus que casi nunca sale de las células humanas. Por eso, a diferencia del VIH, la carga viral del HTLV-1 en plasma es indetectable. Sin embargo, la carga proviral, que corresponde al porcentaje de células mononucleares de sangre periférica (PBMC, por la sigla en inglés) que contienen ADN del HTLV-1 en su genoma, es una alternativa para medir la cantidad del virus y se la considera uno de los mejores marcadores biológicos que pueden predecir tanto el riesgo de inicio de la PET, como la progresión de su incapacidad7)(44)(609(61. Otra muestra que se puede estudiar es el LCR, donde la carga proviral es mucho más alta que en las PBMC; se encuentran valores que oscilan entre 1131-6040 y 254-3841 copias/104 células, respectivamente54)(61.
La carga proviral se considera baja si la proporción de PBMC infectadas es menor del 1 %, y elevada si es mayor del 5 %74. Se ha observado que en pacientes con cargas provirales elevadas se presenta una progresión más rápida de los síntomas que en aquellos con cargas provirales bajas, posiblemente porque aumenta la proliferación o la migración de las células T infectadas hacia el SNC60. Existen casos de personas infectadas con el virus que presentan cargas provirales elevadas y, sin embargo, nunca desarrollan la enfermedad, lo que sugiere la existencia de factores adicionales relacionados con la patogénesis del HTLV- 1, que deben ser investigados75.
La OMS publicó en 1989 un reporte que resume las manifestaciones clínicas mencionadas y presenta otras que se pueden encontrar en el transcurso de la enfermedad76. Estos criterios, aunque se siguen usando en gran medida, presentan algunos defectos importantes principalmente porque involucran síntomas de muchos síndromes en uno solo; además, los pacientes rara vez se presentan con todas las manifestaciones neurológicas principales61. Con el fin de complementar los criterios de la OMS, De Castro Costa y colaboradores77 diseñaron una nueva guía de diagnóstico de la MAH, definiendo el diagnóstico como “definitivo”, “probable” y “posible” (para más información, ver el artículo original).
Los estudios de laboratorio muestran títulos positivos de anticuerpos anti-HTLV-1 tanto en LCR como en sangre37. Los resultados de los análisis del LCR pueden ser normales o revelar bandas oligoclonales de IgG y aumento de la síntesis intratecal de anticuerpos anti HTLV-1, niveles normales de glucosa, pleocitosis mononuclear, hiperproteinorraquia que oscila entre 50-210 mg/dL y elevación de los niveles de citocinas como TNF-α, IL-6 e INF-γ54)(61. El recuento de leucocitos en sangre es normal; sin embargo, se evidencian linfocitos atípicos llamados “linfocitos en flor” que se consideran como un signo patognomónico de la infección por HTLV-1; representan el 1 % del total de leucocitos, razón por la cual se los debe buscar cuidadosamente54. Además, por razones desconocidas, en 40 % a 60 % de los casos se pueden presentar falsos positivos en pruebas como VDRL (Venereal Disease Research Laboratory) sin que esto signifique que el daño medular sea causado por Treponema pallidum63.
TRATAMIENTO
La terapia probada hasta la fecha ha sido amplia, pero con éxito limitado; en su mayor parte se ha enfocado en reducir los niveles de carga proviral. Fármacos antirretrovirales como zidovudina, lamivudina y raltegravir no muestran eficacia antiviral en ensayos clínicos; pese a que se observa inhibición de la replicación viral in vitro, los resultados in vivo no muestran mejoría clínica ni reducción de la carga proviral78)(79)(80. Esto podría explicarse por los escasos ciclos continuos de replicación viral en la mayoría de los portadores, lo que favorecería probablemente el escape del virus del mecanismo de acción de estos fármacos, el cual utiliza la división de la célula huésped como forma alternativa de replicación81)(82.
Por otro lado, con los corticosteroides orales (prednisona) o intravenosos (metilprednisolona) se han logrado beneficios a corto plazo, particularmente en la fase inicial de la enfermedad, cuando la inflamación predomina sobre la desmielinización; sin embargo, emplearlos en dosis altas causa efectos secundarios tempranos y tardíos, por lo que no se recomienda su uso a largo plazo8. El ácido valproico también ha demostrado ser capaz de reducir la carga proviral y bloquear la expresión de HBZ, contrarrestando la estimulación de tax y con ello la replicación viral; no obstante, uno de los efectos adversos es la generación de radicales libres, por lo que se sugiere acompañarlo con antioxidantes83)(84.
Otras opciones terapéuticas son las siguientes: danazol, pentoxifilina, anticuerpos monoclonales, plasmaféresis, azatioprina, ciclosporina e interferones, algunos de ellos con buenos resultados, pero con varias limitaciones por lo que aún se debate su uso8)(44)(54)(85. En 2015 Boostani y colaboradores86 obtuvieron resultados promisorios con una terapia triple consistente en dosis de 180 microgramos de IFN-α una vez a la semana, 10-20 mg/kg/día de ácido valproico y 5 mg/día de prednisolona durante 6 meses. Se observó una disminución notable de la carga proviral, así como de los títulos de anticuerpos antiHTLV-1, la expresión de HBZ y de tax, y un mejoramiento significativo en las alteraciones motoras y la espasticidad después de los 6 meses de tratamiento, sin reportar efectos adversos86. Terapias novedosas con prosultiamina (derivada de la vitamina B1) y mogamulizumab (anticuerpo monoclonal) son bastante esperanzadoras, pero aún se encuentran en investigación82)(87. Por el momento, el tratamiento es sintomático y rehabilitador, enfocado en el control de la espasticidad, el dolor neuropático y las alteraciones de los esfínteres61)(67.
CONCLUSIONES Y PERSPECTIVAS FUTURAS
La paraparesia espástica es una enfermedad que se ha ido expandiendo mundialmente tanto a regiones tropicales como no tropicales. En Colombia, los antecedentes de la presencia del HTLV-1 en la región Pacífica y su gran endemicidad en departamentos cercanos al Cauca, reflejan la necesidad de convertir la sospecha y detección del HTLV-1 en un evento de registro obligatorio en todas las instituciones de salud del país. Para ello será indispensable registrar estadísticamente los casos del virus en la región; de gran utilidad serán las cifras aportadas por los bancos de sangre que acaten la resolución 000437 del 2014 promulgada por el Ministerio de Salud y Protección Social88, y a mediano plazo crear estrategias para el control de la infección. Lo anterior se convertiría en la línea basal para generar acciones de prevención que promuevan el reconocimiento de la enfermedad por la población, a fin de intervenir en la cadena de transmisión del virus. En este sentido, de acuerdo con la literatura revisada, y basándose en el hecho de que el virus se transmite de madre a hijo a través de la leche materna, resultaría adecuado implementar la detección de anticuerpos para HTLV-1 como parte del control prenatal en regiones endémicas del país, tal y como lo han hecho otros países suramericanos.
Por otra parte, a pesar de los resultados promisorios de algunas terapias, en la actualidad no existe un tratamiento eficaz acordado internacionalmente para la MAH. Esto podría explicarse en parte, por las limitaciones encontradas en los ensayos clínicos como las siguientes: pequeño tamaño de muestra, escaso tiempo de seguimiento de los pacientes, dificultad para reclutar pacientes en fases tempranas de la enfermedad, falta de ensayos clínicos aleatorizados y poco interés de la industria farmacéutica y de los países desarrollados en este tipo de enfermedad.














