INTRODUCCIÓN
La retinopatía del prematuro (ROP, por sus siglas en inglés Retinopathy of Prematurity) es una enfermedad proliferativa de la vasculatura retiniana que afecta prematuros de bajo peso, puede causar pérdida visual severa y constituye la principal causa de ceguera prevenible en la infancia1. En los países desarrollados la prevalencia de ROP alcanza el 5 a 8 % y en los países en vía de desarrollo puede alcanzar hasta el 30 %2. En un estudio realizado en la ciudad de Medellín se encontró una prevalencia del 18,2 %3. La ceguera debida a ROP varía significativamente entre los países; en países desarrollados causa el 3-11 % de ceguera pediátrica2 y en América Latina ha sido reportada como responsable del 4,1 al 38 %4.
La ROP es una enfermedad bifásica con una primera fase aguda de obliteración vascular inducida por oxígeno5, donde al nacer prematuramente se torna el ambiente hiperóxico y disminuyen los niveles de factor de crecimiento del endotelio vascular (VEGF), lo que constituye un estímulo para la proliferación vascular normal. Posteriormente, en una segunda fase proliferativa o tardía, se produce un nuevo estímulo pro-angiogénico deficiente que lleva a formación de neovasos y vascularización anormal, alta producción de radicales libres y generación de gran estrés oxidativo6,7; todo lo cual puede traccionar y desprender la retina y conducir a ceguera8,9. El VEGF por tanto juega un papel importante en la patogénesis de la enfermedad5.
La ablación de la retina con termoterapia transpupilar láser es el estándar de tratamiento actual; en casos específicos como opacidad de medios o en centros donde no hay acceso al uso de láser todavía se utiliza la crioterapia10. El objetivo del tratamiento es la ablación de la retina avascular lo que conduce a la regresión de la neovascularización (NV); sin embargo, se presentan casos que no se resuelven con la termoterapia transpupilar por la persistencia de estímulo pro-angiogénico en algunos pacientes.
Los principales espectros de la ROP asociados con estos críticos desenlaces son: 1) la retinopatía agresiva posterior que, de acuerdo a la clasificación internacional revisada de ROP11, por definición tiene un curso severo de rápida progresión con tortuosidad vascular en 4 cuadrantes, en zona I y II, y que no sigue las etapas clásicas de la ROP y 2) la enfermedad umbral: estadio 3 en zona I con PLUS (término para definir tortuosidad arteriolar con dilatación venosa en al menos 2 cuadrantes del polo posterior)12. Estas dos entidades han sido evidencia de falla en tratamiento estándar solo con láser, y aparentemente han mostrado mejor respuesta al tratamiento con el uso de antiangiogénicos10,13.
El uso de agentes anti-VEGF se ha descrito desde 2007 para ROP11. La administración de drogas y alimentos de los Estados Unidos (The Food and Drug Administration, FDA) aprobó el bevacizumab (Avastin, Genentech, San Francisco) intravenoso en 2004 para el tratamiento de cáncer de colon metastásico, comprobando reducción en el número y tamaño de los vasos nutricios de células metástasicas. El uso “offlabel” para enfermedades neovasculares a nivel oftalmológico se inició después13. Posteriormente los estudios multicéntricos, aleatorizados como el BEAT ROP del 2011, entre otros, evidenciaron la eficacia del Bevacizumab intravítreo (Roche AG, Basilea, Suiza) para estadios de ROP5,7,13. El Ranibizumab (Lucentis, Genentech, San Francisco) para tratamiento de ROP se ha estudiado en la literatura en pocas series de casos en combinación con láser, cuenta con registro Invima en nuestro país pero su uso es “offlabel” para ROP. Aunque es un anticuerpo análogo al bevacizumab, el cual no tiene registro Invima14.
En este estudio se presenta el efecto de terapia antiangiogénica con ranibizumab como segunda línea de tratamiento, después de la falta de resolución completa con el tratamiento previo con termoterapia transpupilar en prematuros con ROP umbral y agresiva posterior a una mediana seguimiento de 23,5 meses.
MÉTODOS
Diseño del estudio: cohorte histórica.
Escenario: la población de estudio estuvo constituida por los prematuros del programa de ROP de la Clínica Universitaria Bolivariana de la ciudad de Medellín, institución de tercer nivel de complejidad con énfasis en la atención materno fetal que cuenta con 187 camas y tres unidades de atención neonatal especializadas. Los pacientes fueron evaluados entre enero de 2008 y agosto de 2015.
Participantes: se incluyeron neonatos con una edad gestacional por amenorrea ≤ 33,4 semanas y un peso al nacer de ≤ 1800 gramos, que tuvieran ROP recurrente o que no mejoró inicialmente con termoterapia transpupilar porque continuó progresión de neovascularización, retinopatía agresiva posterior o enfermedad umbral de acuerdo con la clasificación internacional revisada de ROP14. Se excluyeron pacientes con presencia de patologías oculares diferentes asociadas.
Los cuatro pacientes habían recibido termoterapia con láser y ante no mejoría de la neovascularización recibieron ranibizumab. El protocolo de tratamiento aplicado fue: aplicación de Ranibizumab (Lucentis®) 0,25 mg/0,025 ml.
Intervención: bajo anestesia general, medidas de asepsia y antisepsia estándar, se coloca blefaróstato y a 3 mm del limbo se colocan 0,025ml de ranibizumab con aguja 27-gauge. Se realiza paracentesis siempre para disminuir la hipertensión ocular, se formula antibiótico con esteroide tópico por 5 días.
Seguimiento: se realizó seguimiento clínico a las 24 horas, a los siete días de tratamiento, luego a los 15 días y posteriormente mensualmente durante el primer año y luego semestralmente durante 90 meses en promedio. Se tomó agudeza visual entre los 13 y 90 meses. Los desenlaces primarios fueron la regresión de la neovascularización y la ausencia de recurrencia. Los desenlaces secundarios fueron agudeza visual y ausencia de complicaciones oculares como desprendimiento de retina, ceguera o complicaciones sistémicas.
Plan de Análisis: las variables categóricas se presentan como frecuencias absolutas y relativas. Las variables continúas como mediana y rango. Se estimó la densidad de incidencia para la resolución completa de la ROP con su IC 95 %15. Se utilizó el programa estadístico Epidat versión. 4.1.
Aspectos éticos: los autores se adhieren a la declaración de Helsinki versión 2013 y el estudio fue aprobado por el comité ética en investigaciones de la Universidad Pontificia Bolivariana. Se tomó consentimiento informado a los padres para realizar el tratamiento con un medicamento “off-label” para la enfermedad.
RESULTADOS
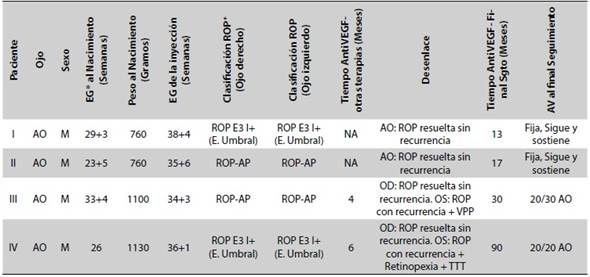
Ocho ojos de cuatro pacientes de género masculino fueron incluidos en el estudio. La edad gestacional fue 28+1 semanas, rango 23+5 a 33+4, y la mediana del peso al nacimiento fue 930 gr, rango 760 a 1130. Todos ellos tuvieron como factor de riesgo para retinopatía de la prematuridad la ventilación mecánica, oxigenoterapia y sepsis. Además, tres de estos cuatro pacientes tuvieron anemia y no recibieron lactancia materna. Cuatro de los ojos evaluados fueron clasificados como ROP agresiva posterior y cuatro como enfermedad umbral.
Todos los pacientes habían recibido termoterapia transpupilar láser como tratamiento inicial y debido a que continuaba el proceso de neovascularizacion se decide colocar terapia antiangiogénica con ranibizumab 0.025 ml dosis única en ambos ojos. En dos ojos de dos pacientes se requirió terapia adicional a la terapia antiangiogénica, posterior a la intervención (25 %; IC 95 % = 3,2-65). Un paciente requirió vitrectomia vía pars plana en un ojo, a los 4 meses, por presentar hemorragia vítrea a pesar del tratamiento realizado. Otro paciente requirió retinopexia con banda en un ojo debido a que estaba en un estadio 4 A.
Se evaluaron agudezas visuales a los 13, 17, 30 y 90 meses, respectivamente. Se encontró resolución de la neovascularización en 6 de los 8 ojos, densidad de incidencia 48 x 100 personas año (IC 95 % = 17,6-100), con una mediana de seguimiento de 23,5 meses, rango 13-90 meses. No se reportaron complicaciones sistémicas ni oculares asociadas al uso del antiangiogénico (Tabla 1).
DISCUSIÓN
La ROP es una patología cada vez más prevalente por la mayor tasa de nacimientos a edades gestacionales más tempranas; y constituye un problema de salud pública por el impacto de años de vida ciegos de estos pacientes. En América Latina además se presentan formas más graves, explicadas probablemente por falta de tamización en el prematuro, la mala identificación de los factores de riesgo para ROP, menos monitorización del oxígeno, nacimientos más tempranamente y por ende de menor peso al nacer, entre otras causas16. Los tratamientos disponibles han tenido buena efectividad en diferentes series, pero cuando se presentan casos refractarios al tratamiento o sin respuesta, el oftalmólogo se enfrenta a un reto. En datos preliminares de un estudio previo no publicado, de 295 pacientes evaluados en la CUB entre 2009-2014 el 65 % de las ROP tenían resolución espontanea, el 31 % requerirían terapia laser y el 4 % requirió laser e intervenciones adicionales.
Dentro de las alternativas terapéuticas para estos casos difíciles están los anti-VEGF. La mayoría de los estudios se han realizado con bevacizumab por haber sido el primer antiangiogénico utilizado en el mundo; y hay muy pocos reportes con ranibizumab y solo uno que compara ambos medicamentos en ROP. Arámbulo et al., sugieren que el bevacizumab escapa del vítreo a la circulación sistémica por su peso y composición molecular; mientras que el ranibizumab es una molécula más pequeña que tiene gran actividad, con tiempo de vida medio más corto en el vítreo comparado con el bevacizumab16. Lo anterior implicaría una mejoría en la eficacia clínica con menores efectos adversos sistémicos, hallazgo comprobado por Erol et al., en su estudio del 2015 que incluyó 36 ojos de 20 pacientes, en el cual comparaba los efectos de ranibizumab y bevacizumab en ROP, encontrando que la incidencia de la resolución de la enfermedad fue mayor en el grupo de ranibizumab17.
Nosotros evaluamos el comportamiento del Ranibizumab como terapia complementaria después de la termoterapia transpupilar láser en pacientes que no resuelven la retinopatía, con una edad gestacional media en los pacientes de 28+1 semanas, similar a lo reportado en una serie amplia con 66 ojos en china por Yi Su et al., que fue de 29,8 ± 1.6 semanas (rango: 27.0-33.6 semanas)18. El peso al nacimiento fue un poco menor a lo reportado en otras series con 930 gr (760-1130), comparado con el estudio chino de 1291 ± 211 gr (rango: 650-1650 gr) y el brasilero de 1,272 ± 255 gr (rango: 900-1,900 gr). La edad media de aplicación del tratamiento fue similar en nuestro estudio con 35,6 semanas y en el chino 35,8 ± 1.6 semanas (rango: 32,7-38,4 semanas), nuestro seguimiento fue más largo de 12 meses. El tiempo desde la terapia transpupilar láser hasta la terapia intravitrea con antiangiogénico o hasta la recurrencia y la realización de segundos tratamientos fue de 6,9 ± 1,8 semanas (rango: 4-8 semanas) para el estudio chino. En el nuestro en un paciente fue hasta de 24 semanas, lo que indica que pueden presentarse complicaciones y falta de resolución de la retinopatía incluso a más tiempo de seguimiento.
En este estudio no se encontraron complicaciones asociadas al procedimiento, ni sistémicas ni oculares, similar a lo reportado por Arámbulo et al.,16, pero diferente a lo reportado por Menkel et al., quienes en su serie reportan aumento de la presión intraocular en la mitad de los casos y en un caso infección respiratoria alta19. Las complicaciones pueden ocurrir con todas las inyecciones intravítreas20. Jang et al.,21 reportaron un paciente con ROP estadio 3 en zona I bilateral que fue tratado con termoterapia transpupilar láser más ranibizumab, con regresión completa 3 meses después del tratamiento pero con desprendimiento de retina bilateral después de este tiempo. Honda et al., informaron en un paciente contracción aguda de la membrana proliferativa que dio lugar a desprendimiento de retina en forma de embudo después de bevacizumab intravítreo para ROP etapa 4A22, lo que indica la importancia del seguimiento estrecho23.
En informes recientes, el anti-VEGF se utilizó como terapia de primera línea con regresión completa de la neovascularización sin la necesidad de tratamiento adicional5. En el estudio realizado por Baumal et al., se concluye que la terapia con Ranibizumab puede ser de utilidad en casos de difícil resolución, resulta en regresión completa y rápida de la neovascularización, pero requiere seguimiento estrecho24.
El presente estudio tiene como limitaciones el ser un diseño retrospectivo y con ausencia de grupo control. Adicionalmente, el número de casos presentados dado la baja prevalencia general y el tiempo de seguimiento no uniforme pueden limitar la aplicabilidad de los resultados. En conclusión, en esta pequeña cohorte de pacientes en un seguimiento hasta 7 años sugiere que la terapia intravitrea de ranibizumab para ROP, en casos que no resuelven la neovascularizacion completamente con la termoterapia transpupilar láser, sirve como complemento para un adecuado desenlace del tratamiento de la retinopatía del prematuro.