INTRODUCCIÓN
Los virus transmitidos por garrapatas (VTG) pertenecen a las familias Flaviviridae, Bunyaviridae, Reoviridae, Asfarviridae y Orthomyxoviridae, y son causantes de diferentes enfermedades en humanos y animales1. Desde el punto de vista epidemiológico, las dos primeras familias son las más importantes debido a que abarcan la mayoría de los VTG, y agrupan las especies con mayor incidencia y letalidad1,2,3. Las enfermedades producidas por estos virus están ampliamente distribuidas en el mundo, pero algunas de ellas están restringidas a ciertas regiones geográficas4.
Según datos de la Organización Mundial de la Salud (OMS), el 17 % de las enfermedades infecciosas que afectan a humanos son transmitidas por vectores, y en el mismo sentido, en los últimos 30 años se ha aumentado la incidencia de diferentes enfermedades transmitidas por garrapatas (ETG)5,6.
Alrededor del mundo se han reportado varios estudios que han detectado virus transmitidos por garrapatas. Así por ejemplo, en Norteamérica, se han realizado estudios de detección del virus Powassan y algunos Phlebovirus circulantes en los Estados Unidos (EE. UU)7,8,9. Mientras tanto, en algunos países del continente europeo como Italia, Finlandia, Países Bálticos, Polonia, Alemania y Eslovenia se ha trabajado principalmente en la detección del virus de la encefalitis transmitida por garrapatas10,11,12,13,14, y en Asia, se han publicado estudios que detectaron el virus CrimeaCongo en Irán15,16.
Debido a la creciente importancia epidemiológica que están teniendo los VTG, esta revisión pretende englobar el conocimiento actual de estos agentes y las enfermedades que producen, así como exponer las estrategias abordadas en prevención y tratamiento de las mismas.
Familias de virus transmitidos por garrapatas
El genoma de las cinco familias (Flaviviridae, Bunyaviridae, Reoviridae, Asfarviridae y Orthomyxoviridae) que incluyen virus transmitidos por garrapatas está compuesto por ácido ribonucleico (ARN), con la excepción del de la familia Asfarviridae, a la cual pertenece el virus de la fiebre porcina africana (African Swine Fever Virus, ASFV), cuyo genoma está compuesto por ácido desoxirribonucleico bicatenario (ds-ADN)1. Dado que existen múltiples diferencias entre dichas familias (en sus mecanismos patogénicos, la distribución geográfica, los vectores, las tasas de prevalencia y de mortalidad), es importante describir las características de cada una de ellas; algunos aspectos relevantes de estos virus se presentan en la Tabla 1.
Tabla 1 Resumen de virus transmitidos por garrapatas, sus principales vectores y su distribución geográfica
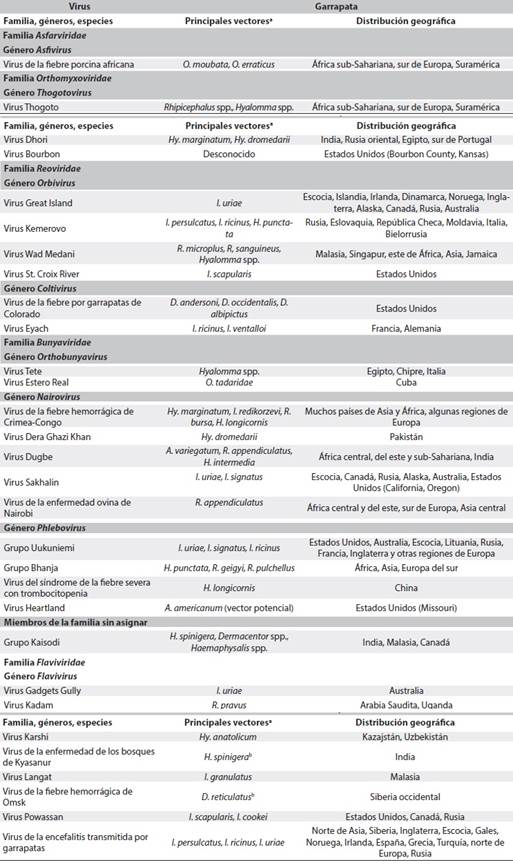
ªAmblyomma (A.), Dermacentor (D.), Haemaphysalis (H.), Hyalomma (Hy.), Ixodes (I.), Rhipicephalus (R.), Ornithodoros (O.). bOtras especies de garrapatas están posiblemente implicadas en la transmisión, pero las especies descritas son los principales vectores
Familia Flaviviridae
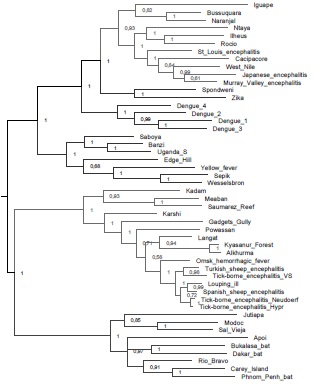
La familia Flaviviridae comprende 4 géneros, Pestivirus, Hepacivirus, Pegivirus y Flavivirus, de los cuales sólo el último contiene VTG. Aunque muchos de los virus pertenecientes al género Flavivirus son transmitidos por mosquitos, también se incluyen 12 especies diferentes de VTG, de los cuales, 8 son transmitidos por vectores de la familia Ixodidae y 4 de la familia Argasidae1. Estos flavivirus transmitidos por garrapatas constituyen un subgrupo claramente diferenciado dentro del género, formando un clado o grupo monofilético en la filogenia del género Flavivirus (Figura 1); esto indica que todos ellos comparten un ancestro común a partir del cual se diferenciaron en las diferentes especies.
Los corchetes a la derecha indican el tipo de vector que transmite cada subgrupo de virus, ya sean mosquitos de los géneros Culex o Aedes, o garrapatas. Los números próximos a cada nodo indican la probabilidad posterior del clado correspondiente. El análisis fue realizado en el programa MrBayes 3,2 utilizando el modelo GTR+G+I y fue corrido por 1.000.000 de generaciones. El árbol está enraizado en el punto medio y fue editado en el programa FigTree 1.4.
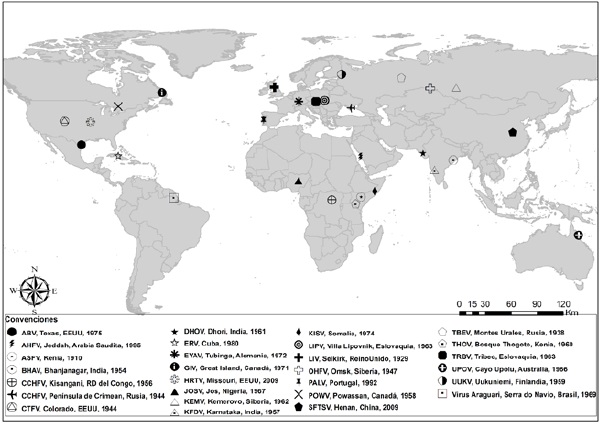
Entre los VTG más representativos (Figura 2), se encuentran el virus de la encefalitis transmitida por garrapatas (Tick-Borne Encephalitis Virus, TBEV), el virus Powassan (Powassan Virus, POWV), el virus de la fiebre hemorrágica de Omsk (Omsk Hemorrhagic Fever Virus, OHFV) y el virus de la enfermedad de los bosques de Kyasanur (Kyasanur Forest Disease Virus, KFDV).
Los símbolos indican la ubicación y la fecha del primer aislamiento. Las siglas de los virus son las siguientes: ABV, Virus Aransas Bay; AHFV, Virus de la fiebre hemorrágica de Alkhurma; ASFV, Virus de la fiebre porcina africana; BHAV, Virus Bhanja; CCHFV, Virus de la fiebre hemorrágica de Crimea-Congo; CTFV, Virus de la fiebre por garrapatas del Colorado; DHOV, Virus Dhori; ERV, Virus Estero Real; EYAV, Virus Eyach; GIV, Virus Great Island; HRTV, Virus Heartland; JOSV, Virus Jos; KEMV, Virus Kemerovo; KFDV, Virus de la enfermedad de los bosques de Kyasanur, KISV, Virus Kismayo; LIPV, Virus Lipovnik; LIV, Virus Louping ill; OHFV, Virus de la fiebre hemorrágica de Omsk; PALV, Virus Palma; POWV, Virus Powassan; SFTSV, Virus del síndrome de la fiebre severa con trombocitopenia; TBEV, Virus de la encefalitis transmitida por garrapatas, THOV, Virus Thogoto; TBRV, Virus Tribeč; UPOV, Virus Upolu. UUKV, Virus Uukuniemi.
Virus de la encefalitis transmitida por garrapatas (TBEV)
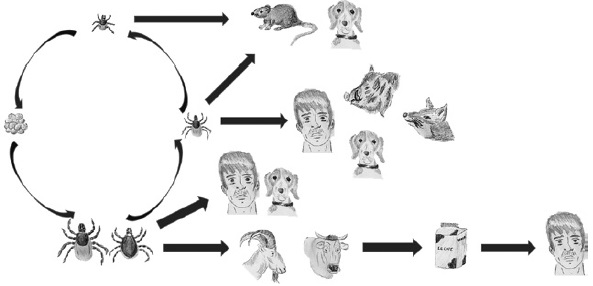
Es endémico en las regiones donde están distribuidos los vectores de los complejos Ixodes ricinus e I. persulcatus, se encuentra en gran parte del continente europeo, Rusia, Siberia, Japón, norte y sur de Corea, Mongolia y China en Asia1,4,17,18. TBEV es considerado el agente transmitido por garrapatas más importante dentro del género Flavivirus debido a la presentación de cientos de casos de encefalitis en humanos (de 10.000 a 15.000 casos por año en Europa y Asia)19 y la observación de casos en Europa, China, norte de Asia y Siberia4,17,18. El ciclo de transmisión de este virus puede ser observado en la Figura 3.
1) Las garrapatas del género Ixodes son vectoras del virus, el cual puede ser transmitido transestadial y transovarialmente. 2) Las garrapatas adultas infectadas transmiten el virus a humanos, caninos y ganado por su picadura. 3) El ganado productor de leche puede transmitir el virus en productos lácteos. 4) El consumo de productos lácteos derivados de animales infectados puede ocasionar infección en humanos. 5) La picadura de ninfas infectadas puede transmitir el virus a humanos, roedores, caninos y animales salvajes como zorros y jabalíes. 6) Las larvas juegan un papel limitado en la transmisión del virus a roedores y caninos.
Entre los años 2005-2009, los países con los niveles más altos de incidencia por cada 100.000 habitantes por año fueron Eslovenia con 14.1 casos, Estonia con 11.1, Lituania con 10.6 y Letonia 8.819. En contraste, en Austria la incidencia fue baja (0,6 - 1,2), debido a la alta tasa de vacunación contra este virus20. A pesar de que en Europa existe un sistema de vigilancia diseñado para prevenir la propagación de TBEV y disminuir su prevalencia, en algunas regiones no ha sido posible, ya que la vigilancia y los sistemas de notificación no son obligatorios en todos los países21,22.
La sintomatología de la encefalitis transmitida por garrapatas generalmente tiene un curso bifásico. En la primera fase aparecen síntomas de tipo gripal, fiebre, mialgia, artralgia y algunas veces conjuntivitis. La segunda fase comienza luego de 4-7 días, se inicia el compromiso del sistema nervioso central (SNC) causando meningoencefalitis, que va acompañada de rigidez de cuello, ataxia, fotofobia, confusión, pérdida de la memoria y paresias de las extremidades4,23.
Un subtipo de TBEV es el virus Louping ill (LIV), el cual es transmitido principalmente por garrapatas I. ricinus y es causante de encefalitis en ovejas. Este virus circula en el Reino Unido, España, Grecia y Turquía, presentando una sintomatología similar a la producida por TBEV23,24.
Actualmente ningún tratamiento antiviral es completamente efectivo contra las infecciones causadas por VTG. Para los pacientes con TBEV el tratamiento solo se basa en medidas de soporte. También se han usado inmunoglobulinas específicas luego de 96 horas de exposición con un 60 % de efectividad25,26. Las infecciones por TBEV pueden prevenirse usando medidas de protección personal que eviten el contacto con garrapatas y aplicando un esquema completo de vacunación contra el virus, el cual brinda un 98 % de inmunidad contra la infección4,27,28. Hasta la fecha se han desarrollado 4 vacunas inactivadas con formaldehído que son efectivas contra varias cepas del virus26.
Virus Powassan (POWV)
Está relacionado antigénicamente con TBEV, pero pueden ser diferenciados serológicamente29. POWV tiene mayor relevancia en EEUU, donde se han presentado diversos casos de encefalitis con una tasa de letalidad hasta del 60 %, aunque está menos asociado a brotes esporádicos comparado con TBEV30. Durante el año 2011, el Centro de Control y Prevención de Enfermedades Infecciosas (Center for Disease Control and Prevention, CDC) confirmó que sólo en el estado de Nueva York se presentaron 12 casos de encefalitis por este virus entre los años 2001-201031.
POWV se aisló por primera vez de humanos en Powassan, Ontario, Canadá en 1958 (Figura 2) a partir de tejido cerebral de un niño que murió de encefalitis32, aunque el mismo virus fue aislado años antes en garrapatas Dermacentor andersoni recolectadas en Colorado en 195233. Posteriormente se mostró que este virus es transmitido por I. cookei e I. scapularis1,34.
La sintomatología causada por POWV es muy similar a la producida por TBEV, los pacientes desarrollan encefalitis luego de un periodo de incubación de 1-4 semanas, acompañada de fiebre, fotofobia, dificultad respiratoria y signos neurológicos como parálisis, convulsiones y coma24,26. Un 50 % de los pacientes que logran recuperarse permanecen con secuelas del SNC que los lleva a la muerte en 1-3 años4. Para este virus no hay un tratamiento antiviral adecuado; se sugiere tratar los síntomas y proporcionar medidas de soporte. No hay una vacuna disponible para POWV y las vacunas para TBEV no son activas frente a POWV4.
Virus de la fiebre hemorrágica de Omsk (OHFV)
Fue aislado por primera vez en 1947 en el distrito de Omsk (Siberia occidental) (Figura 2), a partir de un paciente con fiebre hemorrágica. Su transmisión está asociada con la actividad estacionaria de las garrapatas D. reticulatus y D. marginatus4,35. Entre 1988-1997 se presentaron 165 casos en Novosibirsk, en donde se reportó una seroprevalencia cercana al 35 %35 y una tasa de letalidad de 0,5-3,0 %26.
La infección por OHFV tiene un periodo de incubación de 3-7 días, los pacientes presentan fiebre (39-40° C), cefalea, mialgias y manifestaciones hemorrágicas, observándose epistaxis, hemoptisis, hemorragias intestinales y cutáneas. Algunos pacientes experimentan una mejoría y luego desarrollan una segunda fase febril más severa que la anterior24,26.
Hasta la fecha no existe una vacuna disponible para OHFV, pero algunos autores sugieren que la vacuna para TBEV tiene reactividad cruzada contra OFHV24. Otras medidas preventivas son evitar el contacto con fluidos de animales o personas infectadas y reducir la exposición a la picadura de garrapatas infectadas24,26. En cuanto al tratamiento no hay un medicamento antiviral efectivo, se sugiere tratar las manifestaciones hemorrágicas36.
Virus de la enfermedad del Bosque de Kyasanur (KFDV)
Es endémico en la India, principalmente en el Estado de Karnataka, región donde en 1957 se reportó el primer caso (Figura 2). En dicha región se producen brotes anuales de la infección, la cual tiene un desenlace fatal entre el 2 % y el 10% de los casos1,30. Su transmisión se da particularmente por garrapatas del género Haemaphysalis (principalmente H. spinigera)37,38, las cuales son más abundantes en regiones endémicas, aunque también puede ser transmitido por los géneros Ixodes, Dermacentor y Rhipicephalus1,30,38.
Existe además una variante genética de KDFV denominada virus de la fiebre hemorrágica de Alkhurma (Alkhurma hemorrhagic fever virus, AHFV), con el cual comparte alto nivel de identidad, ya que sólo presentan un porcentaje de diversidad del 3,0 % en la secuencia aminoacídica y 8.4 % en la secuencia nucleotídica39. Este virus tiene una letalidad hasta del 25 %, y los primeros reportes se dieron a partir de un brote que se presentó en 1995 en Jeddah, Arabia Saudita26,30. Posteriormente, se han confirmado más casos en Arabia Saudita, cerca de los límites entre Egipto y Sudán e Italia. El virus ha sido aislado de las garrapatas Hyalomma dromedarii y Ornithodoros savignyi, las cuales parasitan a camellos38.
Los síntomas de la infección por KFDV y AHFV se asemejan entre ellos e inician luego de 3-8 días de exposición. La enfermedad tiene dos fases, durante la primera se presenta fiebre, mialgias, hemorragias en el tracto gastrointestinal, epistaxis, hemoptisis, petequias y sangrado en general de las membranas mucosas. La mayoría de pacientes experimentan una mejoría después de dos semanas, luego se inicia la segunda fase caracterizada por síntomas neurológicos como temblores, rigidez de cuello, visión borrosa, fotofobia y cefalea26,38.
Para tratar KFDV y AHFV se recomiendan medidas de soporte, ya que normalmente esta infección es autolimitada. En cuanto al tratamiento antiviral, se ha usado ribavirina, inductores de interferón e interferón alfa-2b (IFN α-2b), pero la efectividad de éstos no ha sido evaluada con estudios clínicos26. Por otro lado, para la prevención de la infección se han producido varias vacunas, sin embargo, la mayoría de ellas no ha presentado efectividad38.
Familia Bunyaviridae
La familia Bunyaviridae, recientemente reclasificada como orden Bunyavirales, comprende alrededor de 400 virus, clasificados en 13 géneros, que afectan animales o plantas, la mayoría de los cuales son transmitidas por artrópodos. Sólo los géneros Orthobunyavirus, Nairovirus y Phlebovirus contienen VTG1.
Dentro del género Orthobunyavirus se encuentran el grupo antigénico Tete (TETE) y el virus Estero Real (Estero Real Virus, ERV) como los únicos VTG, ya que los demás virus de este género son transmitidos por mosquitos; sobre estos dos virus no se tiene mucha información y no se han reportado casos en humanos. El género Nairovirus incluye el virus de la fiebre hemorrágica de Crimea-Congo (Crimean-Congo Hemorrhagic Fever Virus, CCHFV), y en el género Phlebovirus están los virus de los grupos antigénicos Bhanja (BHA) y del síndrome de la fiebre severa con trombocitopenia (Severe Fever with Thrombocytopenia Syndrome, SFTS) / Heartland (HRT) como algunos de los más importantes.
Virus de la fiebre hemorrágica de Crimea-Congo (CCHFV)
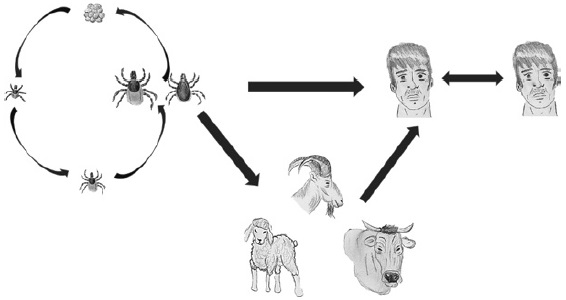
Fue aislado por primera vez entre 1944 y 1945 en la Península de Crimea y posteriormente en la República Democrática del Congo en 1956 (Figura 2), confirmándose posteriormente que los virus eran indistinguibles antigénicamente, pero fue sólo hasta 1970 que se nombró como CCHFV40,41,42. Este virus está asociado a garrapatas del género Hyalomma, especialmente H. marginatum, aunque también ha sido aislado de garrapatas del género Dermacentor, Ixodes y Rhipicephalus42. Se presentó un brote con más de 2500 casos en Turquía a inicios del 200243,44 y alrededor de 13,800 casos en Rusia durante 1999 al 20104. Su ciclo de transmisión se puede observar en la Figura 4 y su letalidad aproximada es del 30 %43.
1) El virus es transmitido transestadial y transovarialmente en garrapatas del género Hyalomma. 2) Las garrapatas adultas infectadas infestan animales salvajes y animales de granja transmitiendo el virus. 3) Las garrapatas adultas pueden infestar a los humanos y transmitir directamente el virus. 4) Los humanos pueden adquirir el virus por contacto con animales infectados mediante procedimientos veterinarios o por transferencia de garrapatas infectadas 5) El virus puede transmitirse entre humanos por contacto con fluidos o tejidos de personas infectadas o por el paso de garrapatas infectadas de una persona a otra.
En humanos, la enfermedad presenta 4 fases: incubación, pre-hemorrágica, hemorrágica y convaleciente. La fase de incubación dura entre 3-7 días, posteriormente en la fase pre-hemorrágica hay aparición de fiebre, mialgias, mareos y aumento de la irrigación sanguínea en el cuello, pecho y cara; esta fase generalmente persiste durante 1-7 días. En la fase hemorrágica aparecen petequias, hematomas, sangrados y puede llegar a causar hemorragias cerebrales; tiene una duración entre 3-5 días. Las personas que sobreviven a la fase anterior, entran en la fase de convalecencia, en la que se ha reportado afección del sistema nervioso periférico, visión borrosa, dificultad respiratoria, pérdida de la audición y la memoria42. Hasta la fecha el tratamiento de CCHF se basa en medidas de soporte, el antiviral más usado es ribavirina, pero su efectividad en pacientes no ha sido demostrada totalmente45.
Grupo antigénico Bhanja (BHA)
Es un grupo antigénico que incluye los virus Kismayo, Forecariah, Palma (PALV), Lone Star y Bhanja (BHAV), siendo este último el más representativo dentro del grupo. BHAV fue aislado en 1954, al oriente de India en la región de Bhanjanajar (Figura 2), a partir de garrapatas Haemaphysalis intermedia; posteriormente, se ha encontrado asociado a otras especies de garrapatas como H. marginatum, H. punctata, H. detritum y algunas pertenecientes a los géneros Rhipicephalus y Amblyomma. Estos virus se han aislado en Croacia, Bulgaria, Rumania, Eslovaquia y Yugoslavia46,47 y estudios serológicos reportaron anticuerpos en más del 50 % de los rumiantes en Italia, Croacia, Bulgaria y Eslovaquia46. Reportes de seroprevalencia en humanos y diferentes animales (vacas, cabras, ardillas y ovejas), sugieren que BHAV está presente no solo en Europa sino también en África y Asia. Dichos virus se han asociado con enfermedad febril en rumiantes y en humanos, causando en estos últimos, encefalitis o meningoencefalitis48,49.
Virus del síndrome de fiebre severa con trombocitopenia (SFTSV)
El primer caso fue informado en las regiones de Henan y Hubei en China en 2009 (Figura 2) y actualmente es considerado endémico en este país, con seroprevalencias hasta del 6.4 % y letalidad que puede ir hasta el 12 %. Entre los años 2011-2014 se reportaron 3500 casos, siendo el grupo más afectado los hombres mayores de 35 años y agricultores (97 %)50,51,52. Corea del Sur y Japón también han reportado casos, mientras que en Missouri (EE.UU) se aisló el virus Heartland (HRTV) en 2009, el cual está emparentado filogenéticamente con SFTSV50,51,52. Haemaphysalis longicornis es la garrapata principalmente asociada con SFTSV, aunque también se ha detectado el virus en R. microplus, mientras que HRTV ha sido detectado y aislado a partir de garrapatas Amblyomma americanum51.
La infección por estos virus consta de 4 fases: incubación, febril, falla multiorgánica y convalecencia. La fase de incubación dura entre 5-14 días. En la fase febril se presenta cefalea, mialgia, trombocitopenia, leucopenia, dura entre 5-11 días. La fase de falla multiorgánica se caracteriza por la afección del corazón, hígado, pulmones y riñones, dura entre 7-14 días. La fase de convalecencia aparece a los 11-19 días, en donde se empiezan a resolver los síntomas50. Aún no se ha establecido ningún tratamiento específico y la ribavirina no ha mostrado tener buena efectividad. Actualmente no existe vacuna para la prevención de esta infección, por lo que se recomiendan medidas para evitar la picadura por garrapatas51.
Familia Reoviridae
Comprende 15 géneros, pero sólo Orbivirus y Coltivirus incluyen VTG1,53. Se han identificado alrededor de 60 Orbivirus transmitidos por garrapatas, de los cuales 36 serotipos se han reunido en un grupo antigénico denominado virus Great Island (GIV)54; entre los Coltivirus se destaca el virus de la fiebre por garrapatas de Colorado (Colorado Tick Fever Virus, CTFV), y el virus Eyach (EYAV)1,55.
Grupo antigénico virus Great Island (GIV)
Dentro del grupo se encuentra el virus Great Island, el cual se aisló por primera vez de garrapatas I. uriae en Newfoundland, Canadá (Figura 2). Dos miembros emparentados, el virus Tribeč (TRBV) y el virus Lipovnik (LIPV) se aislaron de garrapatas I. ricinus en Eslovaquia y se ha reportado anticuerpos en cabras y humanos56. El virus Kemerovo (KEMV) es otro miembro del grupo que fue aislado en garrapatas I. persulcatus y de humanos con meningitis aséptica en Kemerovo (Siberia). También se han encontrado anticuerpos para KEMV en ganado, aves, roedores y humanos. En éstos últimos los anticuerpos se han asociado con la presentación de enfermedad febril, meningoencefalitis y polirradiculitis4,56.
Virus de la fiebre por garrapatas de Colorado (CTFV)
Este agente se ha asociado principalmente con las garrapatas D. andersoni en Norteamérica (EE.UU, Canadá)1,55. Un total de 75 casos fueron confirmados en varios estados de EE.UU57 y un estudio realizado con garrapatas recolectadas en dos parques en EE.UU durante el 2010 mostró que el 99 % eran D. andersoni y el 21 % de estas estaban infectadas con CTFV58.
En cuanto a la sintomatología, CTFV tiene un periodo de incubación entre 3-5 días, y presenta un cuadro febril con cefalea, mialgia, leucopenia, fotofobia y debilidad26,57. Hasta la fecha no se ha desarrollado ninguna vacuna contra CTFV, y el tratamiento está basado en medidas de soporte. La ribavirina y los análogos de nucleósidos han demostrado tener un efecto inhibitorio in vitro26.
Virus Eyach (EYAV)
Se aisló inicialmente de I. ricinus y de I. ventalloi en Francia y Alemania a finales de 1970, su distribución se ha extendido a otros países como la antigua Checoslovaquia donde se han encontrado anticuerpos en suero y líquido cefalorraquídeo (LCR) en el 12 % de pacientes con síndromes neurológicos. En Alemania se ha reportado una seroprevalencia de 0.9 % en roedores y conejos, mientras que en Francia del 1.4 % en caprinos, ovinos y ciervos1,24,59.
Familia Asfarviridae
Contiene sólo el género Asfivirus, el cual posee el virus de la peste porcina africana (African Swine Fever Virus, ASFV) como única especie. Este virus fue aislado por primera vez en Kenia en 1921 (Figura 2) y se introdujo en Europa en 1957 a través de Portugal y desde esta época hasta el 2000 fue reportado en varios países europeos y latinoamericanos1,4,60. Posteriormente, varios de estos países lograron, por medio de la implementación de un programa de erradicación, eliminar el virus, pero aún es enzoótico en la isla de Cerdeña (Italia). En el año 2007 el ASFV se extendió a Europa y el Cáucaso61, lugares que junto con África y Cerdeña actualmente se consideran enzoóticos1,60.
ASFV es transmitido por garrapatas blandas de las especies Ornithodoros moubata en África y O. erraticus en el suroeste de Europa61, ocasionando una enfermedad en cerdos y jabalíes que puede alcanzar cifras de letalidad cercanas al 100 %. La peste porcina africana (PPA) se presenta en diversas formas: hiperaguda, aguda, subaguda, crónica y asintomática, tiene un periodo de incubación entre 4-19 días. La PPA se acompaña de fiebre, anorexia, tos, diarrea, abortos, incoordinación, trombosis y hemorragias generalizadas4,23. Todo lo anterior contrasta con la situación en humanos, en quienes aún no se han reportado casos4. Para este virus no hay vacuna ni tratamiento, por lo que la recomendación es prevenir que los cerdos entren en contacto con el agente, y con este fin se deben implementar programas de higiene y sanidad para los criaderos4,61.
Familia Orthomyxovirida
Abarca 4 géneros de virus de la Influenza y tres géneros más; uno de ellos, el género Thogotovirus, que contiene varios VTG62. Al género Thogotovirus pertenecen los virus Araguari, Aransas Bay (ABV), Dhori (DHOV), Jos (JOSV), Thogoto (THOV), y los virus Upolu (UPOV), todos estos asociados con garrapatas. THOV y DHOV se han asociado con encefalitis o meningoencefalitis en humanos, pero para DHOV solo se han reportado casos de infección accidental en el laboratorio63,64. En el 2014 se aisló un nuevo virus emparentado genéticamente con los anteriores, al cual los autores proponen denominarlo virus Bourbon y que sea incluido dentro del género63.
UPOV fue aislado por primera vez de garrapatas O. capensis que se encontraban colonizando una gaviota en el cayo Upolu (Australia) y ABV fue recuperado del mismo género de garrapatas, pero éstas fueron recolectadas de un nido de aves marinas en Texas en 197562. THOV fue aislado en 1960 en el bosque Thogoto (Kenia) a partir de garrapatas R. decoloratus recolectadas en cabras, extendiéndose luego a otras regiones de África y Europa23. Igualmente, JOSV fue aislado en garrapatas del mismo género en Nigeria, pero inicialmente se recuperó de suero de vacas en 196764. El virus Araguari se aisló de zarigüeyas en Brasil y DHOV fue aislado en India en garrapatas Hyalomma dromedarii recolectadas de camellos, también se encuentra reportado en Portugal, Egipto y Rusia (Figura 2),65.
Recientemente se describió un nuevo virus aislado a partir de mosquitos en Colombia denominado virus Sinu66, y aunque no se trata de un agente viral encontrado en garrapatas, es un hallazgo indicativo de que podría existir una gran variedad de virus desconocidos presentes en estas, pero no han sido identificados hasta la fecha debido a la ausencia de estudios en el país que detecten estos nuevos agentes.
Hasta el momento, solo THOV y DHOV se han reportado produciendo enfermedad en humanos, generando encefalitis o meningoencefalitis63,64,65. Ensayos en modelos murinos para estudiar su fisiopatología han sugerido que estos virus producen necrosis celular aguda en varios órganos como bazo, hígado y médula ósea64.
CONCLUSIONES
Según la literatura revisada, es evidente que para la región Neotropical hacen falta estudios sobre los VTG presentes en la región, ya que la gran mayoría de reportes provienen de las regiones Neártica y Paleártica.
También vale la pena resaltar que la diversidad de garrapatas de la región Neotropical (América del Sur, Centroamérica, Antillas, parte de México y EE.UU) es muy diferente a la encontrada en las demás regiones zoogeográficas67, por lo tanto, es posible que las garrapatas de esta región sean potenciales vectores, tanto de virus desconocidos como de VTG previamente identificados.
Es importante tener en cuenta que en Colombia están presentes varios géneros de garrapatas que han sido asociadas con la transmisión de VTG, tales como Ixodes, Dermacentor, Amblyomma, Haemaphysalis y Rhipicephalus1, los cuales podrían estar actuando como vectores de estos virus en el país, ya que no se conocen estudios donde se realice una búsqueda de VTG en Colombia.
Diversos factores pueden influir en la introducción de VTG a regiones donde previamente no habían sido reportados, como el cambio climático, los viajes intercontinentales, el transporte de animales de abasto, fauna silvestre y animales domésticos, las aves migratorias, entre otros41. Debido a lo anteriormente mencionado, el TBEV podría ser uno de los VTG con mayor probabilidad de introducción a la región Neotropical, incluso en Colombia, puesto que este virus se encuentra ampliamente diseminado en el continente europeo y asiático, presentándose un gran número de casos anualmente19.
En el continente europeo se investiga principalmente TBEV, mientras que en Asia y África, las investigaciones están encaminadas a la búsqueda y control de CCHFV, el cual es considerado uno de los virus más letales entre los VTG. Para Norteamérica, los estudios se basan principalmente en POWV y CTFV, y en menor medida para HRTV, ya que se trata de un virus recientemente descubierto.
En Suramérica solo se tiene reporte del virus Araguari en Brasil que fue aislado a partir de zarigüeyas y parece estar relacionado con VTG (THOV y DHOV), sin embargo, aún se desconoce completamente su potencial patogénico y su ecología. Recientemente, investigadores de Sao Paulo, Brasil, caracterizaron genéticamente el virus Cacipacoré, el cual fue aislado de garrapatas Amblyomma cajennense recolectadas de un capibara enfermo68.
Considerando el panorama actual de los estudios de VTG en la región Neotropical y las particularidades de la misma, es muy probable que existan otros VTG aún no identificados que podrían tener algún impacto en salud pública y la salud animal.