INTRODUCCIÓN
Las bebidas conocidas como energizantes son preparados estimulantes, compuestos de cafeína e hidratos de carbono (glucosa, glucoronolactona, fructosa o sacarosa), acompañados de suplementos dietarios (taurina, vitaminas, minerales) o extractos vegetales y aditivos acidulantes (ácido cítrico y citrato de sodio), conservantes (benzoato de sodio), saborizantes (cítrico) y colorantes. Vienen usualmente de forma líquida y gasificada. La primera bebida energizante apareció en los Estados Unidos en 1949 y fue comercializada como “Dr. Enuf”1, pero la popularidad y la expansión por todo el mundo comenzaron en 1987, con el lanzamiento en Austria de la bebida conocida como “Red Bull”. En 2013 ya se había calculado un consumo anual de este tipo de bebidas superior a los 5800 millones de litros2.
En los Estados Unidos se calcula que aproximadamente 30 % de las personas jóvenes consumen regularmente bebidas energizantes, y de estos, dos tercios están entre 13-35 años y la mayoría (64 %) son hombres3.
En la Unión Europea, aunque hay variabilidad entre los países, se encontró que la mayor prevalencia de consumo fue del 68 % en los adolescentes, del 30 % en los adultos y del 18 % en los niños4. En Colombia, no se tiene un estudio de prevalencia que abarque toda la población, pero hay publicaciones en estudiantes del área de la salud como, por ejemplo, en Tunja, donde se encontró una prevalencia de consumo en los últimos 6 meses del 53,7 %5, o en Medellín, donde se encontró que el 31 % de las personas entre 18-50 años, de los estratos 5 y 6, acostumbran consumir este tipo de bebidas, y que ello es más frecuente en las de 18-25 años6. Aunque los fabricantes defienden que estas bebidas son seguras y la mayoría de los consumidores lo percibe así, se han publicado reportes de casos de eventos adversos por su uso, lo cual ha generado inquietud.
Las preocupaciones que surgen alrededor de todo esto, se basan principalmente en los siguientes argumentos: a) el uso indiscriminado de las bebidas energizantes va en aumento y cada vez más informes sugieren que las personas están consumiendo más de 400 mg/día de cafeína, valor que comúnmente se ha referenciado como “seguro”7; b) aunque la cafeína y su concentración sean etiquetadas en las bebidas energizantes, es factible que su cantidad real sea mayor que la referenciada, si las bebidas contienen productos a base de plantas, por ejemplo, café, guaraná o chocolate; c) otros productos diferentes a las bebidas energizantes contienen cafeína, entre ellos gomas de mascar y dulces, que no necesariamente la tienen en la etiqueta, lo que lleva a que la ingesta diaria de cafeína sea mayor que lo calculado; d) la población infantil y adolescente puede ser sujeto de su consumo, y en la actualidad se debaten los riesgos para la salud en estos grupos etarios, relacionados en gran medida con los efectos sobre el sistema nervioso8; e) hay variación individual en la sensibilidad a la cafeína, aun en consumidores sanos9. Estas situaciones nos motivaron a revisar los beneficios y riesgos del consumo de estas bebidas.
MARCO LEGAL
Dado que la cafeína hace parte fundamental de las bebidas energizantes, sus fabricantes tienden a clasificarlas como alimentos convencionales, o mejor, como bebidas convencionales8. Desde 1958, la cafeína es una sustancia regulada por la FDA (Food and Drug Administration) de los Estados Unidos como una sustancia generalmente reconocida como segura (GRAS, por la sigla en inglés de Generally Recognized As Safe) para su uso en las bebidas tipo cola en concentraciones que no excedan el 0,02 %8. En 1982, la FDA a través de un comité independiente (SCOGS, por la sigla en inglés de Committee on GRAS Substances) consideró que no había evidencia demostrativa de que la cafeína fuese un peligro para la población cuando se usa en las bebidas tipo cola, pero planteó que existen incertidumbres que requieren estudios adicionales con respecto a su seguridad; a pesar de esto, la cafeína sigue siendo considerada sustancia GRAS10. En Colombia, la Resolución 4150 de 2009 de Ministerio de la Protección Social11 establece el reglamento técnico sobre los requisitos que deben cumplir las bebidas energizantes para consumo humano; según dicho reglamento, el contenido máximo por 100 mL de las siguientes sustancias debe ser 32 mg de cafeína, 400 mg de taurina, 250 mg de glucoronolactona y 12 gramos de carbohidratos. También se permite la adición de las siguientes vitaminas: C, tiamina (B1), riboflavina (B2), niacina (B3), ácido pantoténico (B5), piridoxina (B6), hasta 20 mg de inositol (B8) y cianocobalamina (B12).
COMPONENTES DE LAS BEBIDAS ENERGIZANTES
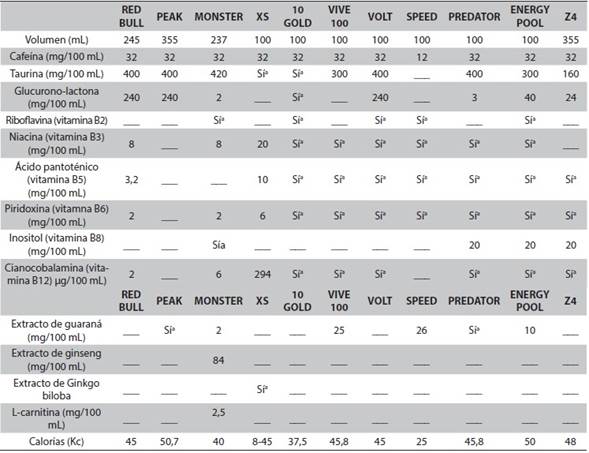
Las bebidas energizantes en Colombia vienen en diferentes presentaciones comerciales, por ejemplo, en Medellín se comercializan más de 10 marcas, como se observa en la Tabla 1. Contienen cafeína, glucoronolactona, carbohidratos, taurina, complejo B y, algunas de ellas, sustancias como ginseng, guaraná, carnitina y ginkgo biloba, entre otras. Dos componentes resaltan sobre los otros: la cafeína y la taurina; por tanto, esta revisión se centra en ellas.
CAFEÍNA
La cafeína es un alcaloide producido por plantas, entre las que se destacan principalmente la Coffea arabica y la Coffea canephora, guaraná, yerba mate, cacao y té como la Camellia sinensis. La mayoría de sus acciones farmacológicas se deben a la capacidad de antagonizar de forma competitiva los receptores de adenosina A1, A2A, A2B y A3 (concentraciones de 10- 100 μM)12. En el corazón se encuentran en mayor densidad los A1, en el músculo liso, los A2B y en el endotelio, los A2A. A concentraciones más altas, la cafeína actúa como inhibidor directo y no específico de las diferentes isoformas de la fosfodiesterasa (IC50: 100-1000 mM)13. En el sistema nervioso, los receptores A1 se expresan altamente en la corteza cerebral, el hipocampo, el cerebelo y la médula espinal; los receptores A2A se expresan principalmente en el tubérculo olfatorio, los estriados dorsal y ventral y el plexo coroideo; los receptores A2B y A3 se expresan en concentraciones relativamente bajas en el cerebro14. Los receptores de adenosina inhiben la liberación de numerosos neurotransmisores tales como GABA15, acetilcolina16, dopamina17, glutamato18, noradrenalina19 y serotonina20, entonces la cafeína, por el contrario, favorece su liberación. La cafeína también bloquea la liberación de calcio al inhibir la producción de IP3 mediada por la fosfolipasa C o por ser antagonista directo del receptor de IP3 , pero, por otro lado, puede activar la liberación de calcio de los receptores de rianodina al incrementar la sensibilidad de estos al Ca2+21.
Efectos clínicos cardiovasculares de la cafeína
Investigaciones a corto plazo han mostrado que la ingestión de la cafeína incrementa agudamente la renina plasmática22, las concentraciones de catecolaminas22, de colesterol total, de colesterol LDL (por la sigla en inglés de low-density lipoprotein) y de triglicéridos23. Los resultados de los estudios clínicos que han evaluado los efectos de la cafeína sobre la presión arterial han sido contradictorios. A corto plazo, dos metanálisis de ensayos clínicos con asignación al azar (ECAA) mostraron que su ingesta se asoció con elevaciones leves de la presión arterial24,25; no obstante, a largo plazo, un metanálisis de estudios de cohortes prospectivas (con mediana de seguimiento entre 6,4 y 33 años), no pudo encontrar una asociación (dosis-efecto) entre el consumo de cafeína y el desarrollo de hipertensión26; incluso, otro estudio encontró una relación inversa entre la presión arterial y la excreción urinaria de cafeína, es decir, a mayores concentraciones urinarias de cafeína, se encontraron presiones arteriales más bajas27.
Con respecto a la capacidad de la cafeína para alterar el trazado electrocardiográfico (EKG) y producir arritmias, ha habido varios hallazgos. Estudios en voluntarios sanos no mostraron diferencias clínicamente significativas en las ondas o intervalos en el EKG28,29,30,31. Otro estudio hecho en 1388 adultos mayores evaluó la relación entre la ingesta de productos que contienen cafeína y la ocurrencia de arritmias (evaluadas por un monitoreo Holter de 24 horas) y no se encontró relación de las ectopias cardíacas y la taquicardia supraventricular o ventricular con los niveles de consumo de estos productos32. Tampoco se encontró aumento en la frecuencia o gravedad de las arritmias ventriculares en pacientes de alto riesgo cardiovascular33,34,35,36. Sin embargo, en pacientes que tienen antecedentes de presentar complejos ventriculares prematuros frecuentes un estudio mostró que consumir cafeína aumentaba la tasa de eventos comparados con un grupo control37.
Con respecto a la enfermedad cardiovascular ateroesclerótica (enfermedad coronaria, accidente cerebrovascular, falla cardíaca o muerte de origen cardiovascular), varios metanálisis38,39,40,41,42 no lograron establecer una relación entre el consumo de cafeína y esta enfermedad. Más aún, otro metanálisis de estudios observacionales mostró que el consumo moderado de café (1,5 a 3,5 tazas al día) tuvo menor riesgo de enfermedad cardiovascular comparado con menor o ninguna ingesta de café (menos de 1,5 tazas al día) y que, cuando el consumo de cafeína fue mayor de 5 tazas al día no hubo diferencia con respecto al riesgo de enfermedad cardiovascular comparado con la ingesta menor de 1,5 tazas al día. Los autores encontraron que los riesgos de enfermedad coronaria y accidente cerebrovascular fueron más bajos con 3-5 tazas de café al día y que el consumo pesado de café no se asoció con un aumento en el riesgo de enfermedad cardiovascular43.
Efectos clínicos neurológicos de la cafeína
La cafeína aumenta la percepción del estado de alerta/vigilia44, así como la del humor y el bienestar. Parece que de estas funciones la más afectada es la del sueño; algunos reportes señalan que concentraciones bajas, 40-60 mg, mejoran el desempeño general45,46,47, y otros muestran que cantidades superiores a los 200 mg de cafeína prolongan el inicio del sueño, empeoran la calidad percibida del sueño y acortan su duración, pero preservan sus fases48. Aunque algunos han sugerido que la cafeína previene o restaura las pérdidas de la memoria y mejora el rendimiento cognitivo49,50, otros sugieren que estos beneficios se relacionan más con el alivio de los síntomas de abstinencia que puede producir esta sustancia51,52. A pesar del debate existente al respecto, estudios epidemiológicos han mostrado que el consumo de cafeína se ha asociado con un riesgo significativamente más bajo de desarrollar enfermedades neurodegenerativas tales como las demencias y la enfermedad de Alzheimer44,53. También se ha sugerido que la cafeína pudiera tener un efecto aditivo en la analgesia, ya que cuando se acompaña de acetaminofén reduce las dosis necesarias de este fármaco para controlar el dolor54. Para el caso de las cefaleas, algunos sugieren que la cafeína mejora los síntomas de la migraña por sus propiedades vasoconstrictoras en el sistema nervioso central55; en cuanto a las cefaleas tensionales, en las que no hay cambios vasculares, se sugiere que la mejoría producida por la cafeína debe ser por un mecanismo diferente55. Esta evidencia es contradictoria puesto que otras referencias citan a la cafeína como un posible desencadenante de migrañas56,57.
Además, algunos estudios en humanos apuntan a que la cafeína pueda tener un papel neuroprotector en la enfermedad de Parkinson58,59; se ha encontrado que personas que no ingieren café habitualmente tienen un riesgo más elevado de presentar esta enfermedad, y que este riesgo es inversamente proporcional a la dosis60,61; a pesar de esto, falta más evidencia científica al respecto.
En contraste, el consumo de cafeína se ha asociado con eventos psiquiátricos indeseados, principalmente ansiedad, la cual se relaciona con el consumo de cantidades elevadas de esta sustancia, o inclusive de cantidades bajas en individuos que reportan sensibilidad a sus efectos44,62,63; en estos últimos la sola ingestión de una taza de café (80-110 mg de cafeína) puede inducir ataques de pánico45,62,64, e incluso, se ha descrito como disparador de crisis en pacientes que sufren de este trastorno de base. Los consumidores infrecuentes parecen ser más sensibles a sus efectos ansiogénicos que quienes la consumen habitualmente48. Estos individuos muestran una tendencia a reducir o dejar de consumirla por sus efectos no placenteros62.
TAURINA
La taurina es un compuesto azufrado derivado de la cisteína. En los seres humanos, la dieta es su principal fuente (crustáceos, mejillones, almejas, la parte oscura de la carne de pavo y de pollo), aunque pequeñas cantidades se sintetizan endógenamente en el hígado. La taurina entra a las células del músculo esquelético, el corazón, el cerebro y la retina por un transportador específico, que se expresa más o menos según las concentraciones de taurina intracelular, de tal forma que cuando hay concentraciones altas de taurina en la sangre el transportador se satura y el remanente se excreta en la orina65. Se la ha involucrado en distintos procesos fisiológicos como estabilizador de membranas celulares, osmorregulador, antioxidante, participante en la síntesis de ácidos biliares, modulador del flujo de calcio celular y de la excitabilidad neuronal66,67. Se comporta como un neurotransmisor al disminuir el calcio intracelular inducido por glutamato68, lo que también puede indirectamente inhibir la liberación de citocromo C y la cascada de la apoptosis67.
También se comporta como un agonista de los receptores GABA-A y en menor medida de la glicina66,68.
Efectos clínicos cardiovasculares de la taurina
La taurina reduce la liberación de angiotensina II65 y los niveles de adrenalina y noradrenalina; se ha encontrado una relación inversa entre los niveles de excreción de taurina y las presiones sistólica y diastólica69. Un ECAA mostró también su efecto benéfico en el metabolismo lipídico, al producir disminución de los triglicéridos y del índice aterogénico calculado a dosis de 3 gramos/diarios durante 6 semanas en pacientes con sobrepeso u obesidad comparada con placebo70. Se cree que, por sus efectos antioxidantes, la taurina puede mejorar la disfunción endotelial vascular causada por estrés oxidativo71, y una publicación con alto riesgo de sesgos mostró una correlación inversa entre la mediana del valor urinario de taurina y la tasa de mortalidad por enfermedad cardíaca isquémica72; sin embargo, no se encontraron estudios de buena calidad que evaluaran la relación entre su consumo y la presencia de enfermedad cardiovascular ateroesclerótica, ni con otras enfermedades relacionadas.
Efectos clínicos neurológicos de la taurina
Aunque se ha implicado a la taurina como neuroprotectora frente a una variedad de enfermedades que incluyen hipoxia, trauma cerebral, neurotoxicidad inducida por glutamato, epilepsia e inflamación, entre otras73, no se encontraron estudios clínicos en humanos que muestren su eficacia o toxicidad significativas en estas situaciones. Por otro lado, algunos consideran que la taurina puede mejorar el rendimiento cognitivo74, pero realmente, no se sabe si su suplementación produce algún efecto significativo al respecto.
TOXICIDAD RELACIONADA CON LAS BEBIDAS ENERGIZANTES
Efectos clínicos cardiovasculares de las bebidas energizantes cafeínadas
Aunque se requiere mayor evidencia, parece que gran parte de los efectos cardiovasculares de estas bebidas energizantes (como el aumento de la frecuencia cardíaca, los cambios en la presión arterial y las alteraciones en el QTc) se explican mejor por su contenido de cafeína que por sus otros componentes75, aunque se requiere mayor evidencia para sacar esta conclusión.
Algunas publicaciones han reportado eventos durante el consumo de bebidas energizantes cafeínadas, tales como taquicardia, arritmias, elevación del segmento ST e infarto de miocardio76,77,78,79, vasodilatación arterial, formación de aneurismas, disección y ruptura de vasos grandes80, prolongación de QTc, cardiomiopatías agudas e hipertensión acelerada81,82. Más de una tercera parte de estos problemas cardiovasculares han sido arritmias81,83,84,85,86,87,88, y la coingestión de etanol y otras drogas parece ser un factor importante en la consulta a los servicios de urgencias81.
Efectos clínicos neurológicos de las bebidas energizantes cafeínadas
Según reportes y series de casos, las causas más comunes de ingreso a urgencias por causa neurológica en individuos que consumieron este tipo de bebidas fueron las siguientes: convulsiones, seguidas por agitación, comportamiento agresivo e ideación suicida89. Estos eventos también se encontraron con mayor frecuencia cuando hubo consumo concomitante de etanol90. También se han informado otros eventos adversos en quienes consumen estas bebidas y no necesariamente requieren consultar a urgencias. Un trabajo en estudiantes de bachillerato encontró que los consumidores de bebidas energizantes tenían un riesgo mayor de presentar quejas de salud que los no consumidores. Cuando se ajustó por covariables, las manifestaciones más frecuentes fueron cefalea (OR: 4,6; IC95 %: 2,8-7,7); problemas de sueño (OR: 3,6; IC95 %: 2,2-5,8); irritación (OR: 4,1; IC95 %: 2,7-6,1) y cansancio (OR: 3,7; IC95 %: 2,4-5,7)91.
CONCLUSIONES
Las bebidas energizantes cafeínadas se utilizan ampliamente por sus efectos estimulantes; los fabricantes defienden que son seguras y muchos consumidores lo perciben así; sus componentes y concentraciones están debidamente aprobados por la legislación. A pesar de esto, hoy en día hay preocupación por su uso indiscriminado, por reportes de la literatura sobre su toxicidad, por los hábitos de consumo y por la variabilidad de sus efectos, especialmente en la población infantil y en personas hipersensibles.
No se conocen con exactitud los límites seguros del consumo de cafeína, aunque la información disponible sugiere que en un adulto sano podrían ser hasta de 400 mg por día. Los estudios que han evaluado su seguridad son de muy baja calidad, con alto potencial de sesgos debido al tipo de publicación (reportes de casos en la mayoría), porque puede haber variabilidad en la sensibilidad del consumidor, por diferencias en la dosis y frecuencia de consumo y por el uso concomitante de otras sustancias, entre otras razones. A pesar de esto, luego de la ingestión de bebidas cafeínadas energizantes, algunos individuos han consultado a los servicios de urgencias por arritmias, convulsiones, agitación, agresividad e ideación suicida, especialmente cuando hay uso concomitante de etanol. Es frecuente el consumo concomitante de bebidas energizantes cafeínadas con etanol para “disminuir la percepción subjetiva de los efectos tóxicos del alcohol”92,93, aunque en realidad, en términos objetivos, esto no es cierto94 ya que la incapacidad de juicio y reacción asociada a la embriaguez no cambia y, por el contrario, podría aumentar su toxicidad, ya que terminan consumiendo mayores cantidades de etanol. Es más, la creencia popular de que el combinar cafeína con etanol disminuye o revierte los efectos de este último, puede llevar a otros riesgos, ya que las personas, al “no sentirse ebrias”, pueden involucrarse en actividades peligrosas, tales como conducir un auto. Además, preocupa su uso indiscriminado, principalmente en menores de edad, población en la que se debate con respecto a los riesgos en la salud, principalmente por los efectos en el sistema nervioso central. Todas estas situaciones llevan a la necesidad de buscar estrategias educativas ante la población consumidora, para que modere el uso de estas bebidas y evite combinarlas con etanol.