INTRODUCCIÓN
El hipoparatiroidismo es una enfermedad infrecuente que deteriora la calidad de vida de los pacientes(1- 5). Las personas con este diagnóstico requieren suplencia de calcio y análogos de vitamina D, como el calcitriol, de por vida. Un control inadecuado puede producir convulsiones, parestesias, deterioro cognitivo y crisis de hipocalcemia que requieren atención urgente(5). La falta de familiaridad con esta entidad por parte del médico de cuidado primario puede generar diagnósticos errados, retrasos en el diagnóstico e instauración tardía del tratamiento.
Era la única enfermedad endocrina caracterizada por hipofunción para la que no existía un remplazo hormonal, hasta que fue aprobado el uso de hormona paratiroidea (PTH) recombinante 1-84 (NATPARA®) en el año 2015(6- 8). Esta revisión pretende evaluar el estado de arte actual de la enfermedad y presentar bases futuras para la investigación de esta condición poco conocida en nuestro medio.
GENERALIDADES
El hipoparatiroidismo es una deficiencia endocrina poco frecuente, caracterizada por concentración inadecuada de PTH en sangre, que genera hipocalcemia e hiperfosfatemia(1, 2). Se debe diferenciar del pseudohipoparatiroidismo(9, 10), que es bioquímicamente similar pero con PTH elevada, dado que existe resistencia a su acción en los órganos periféricos pero no disminución de su síntesis. Actualmente se considera una enfermedad huérfana(4), según lo estableció la comisión europea en enero del 2014(3, 11, 12).
EPIDEMIOLOGÍA
En Estados Unidos se habían diagnosticado 58.763 pacientes con hipoparatiroidismo crónico(13). La prevalencia aproximada fue de 37 casos por cada 100.000 habitantes, de los cuales 8 casos por cada 100.000 habitantes fueron de etiología no quirúrgica y 29 por cada 100.000 fueron posquirúrgicos(3, 4, 13). Otros estudios realizados en Dinamarca, encontraron una prevalencia de 22 casos por cada 100.000 habitantes para el hipoparatiroidismo posquirúrgico y 2,3 casos por cada 100.000 habitantes fueron de etiología no quirúrgica, además, una incidencia anual de hipoparatiroidismo de 0,8 casos por cada 100.000 habitantes(14, 15).
ETIOLOGÍA
La principal causa de hipoparatiroidismo es el adquirido, que representa el 75 % de todo los casos(3). Suele ser consecuencia de la resección quirúrgica de grandes tumores cervicales, ya sea de manera intencional o inadvertida; esta última, generalmente ocurre en casos de extirpación de la glándula tiroides(3, 13). En los casos de hipoparatiroidismo posquirúrgico se ha descrito que hasta un 33 % de las intervenciones quirúrgicas estuvieron indicadas por neoplasia maligna, principalmente tiroidea, 33 % por bocio no tóxico, 25 % por bocio tóxico y 10 % debido a hiperparatiroidismo primario recidivante o hiperplasia(3).
En frecuencia, le siguen las enfermedades autoinmunes que pueden afectar únicamente la glándula paratiroides o también otras glándulas endocrinas. El resto de causas secundarias están dadas por trastornos infiltrativos, lesiones metastásicas, exposición a radiación ionizante o sobrecarga de hierro o cobre(3- 5). Los trastornos genéticos son los menos frecuentes (Tabla 1).
Hipoparatiroidismo posquirúrgico
El hipoparatiroidismo posquirúrgico(16) suele producirse por la resección completa de las glándulas o por isquemia glandular por daño de la vasculatura(17). El hipoparatiroidismo causado por procedimientos quirúrgicos puede ser transitorio (duración menor a 6 meses) o definitivo (duración mayor a 6 meses)(3). Se ha descrito que entre 7-35 % de las tiroidectomías pueden producir hipoparatiroidismo, de los cuales 75 % serán transitorios y 25 % terminará siendo definitivo(3). Bioquímicamente, el hipoparatiroidismo posquirúrgico cursa con hipocalcemia (calcio sérico < 8 mg/dL) y PTH baja (< 20 pg/mL)(2)(8). Esto podría evitarse si se identifican todas las glándulas paratiroides del paciente durante el procedimiento y si este es ejecutado por un cirujano con experiencia que preserve la vasculatura, dado que el número de intervenciones realizadas parecer ser uno de los factores protectores más importantes junto con la ligadura selectiva de las ramas más distales de las arterias tiroideas(17).
Manifestaciones clínicas del hipoparatiroidismo
En términos generales, las manifestaciones clínicas del hipoparatiroidismo tienen relación con la concentración de calcio sérico(18) y con la velocidad de instauración de la hipocalcemia. La gravedad de los síntomas se correlaciona usualmente con la concentración sérica de este ion, aunque pueden existir situaciones de hipocalcemia asintomática que se instaurarán lentamente en el tiempo.
Síntomas agudos
Es relativamente frecuente que luego de una intervención quirúrgica en vecindad de las paratiroides, se produzcan síntomas de hipocalcemia. Estos generalmente son transitorios y autolimitados. Lo más frecuente es que la hipocalcemia se manifieste con alteraciones neuromusculares(19- 21), neuropsiquiátricas(22- 24) y cardiovasculares. Los síntomas agudos pueden llegar a ser tan graves, que obliguen al paciente a requerir manejo intrahospitalario incluso en unidad de cuidados intensivos (convulsiones, espasmo laríngeo, irritabilidad neuromuscular o prolongación del QT)(8), aunque esto ocurre en menos del 3 % de los casos de hipocalcemia posoperatoria. Los pacientes se quejan de parestesias, entumecimiento perioral, mialgias y debilidad muscular. En casos graves puede haber tetania y/o convulsiones(15, 21, 23, 25, 26). Puede presentarse dolor abdominal, disfagia, broncoespasmo, estridor y dificultad para la micción por espasmos en el músculo liso. Debido a la poca especificidad de los síntomas, muchos de estos pasan desapercibidos o son ignorados, de manera que hay un intervalo prolongado de tiempo desde el inicio de los síntomas hasta el diagnóstico, que puede ser tan largo como 5,9 años(3- 5, 25, 27, 28). Hasta un 25 % de los pacientes sanos presenta el signo de Chvostek (espasmo muscular al estimular el tronco del facial) y un 29 % de pacientes con hipocalcemia tienen este signo negativo, haciéndolo poco sensible y específico para el diagnóstico de hipocalcemia. Por otro lado, el signo de Trousseau (espasmo carpopedal al producir isquemia mayor de 1 minuto) es positivo hasta el 94 % de pacientes con hipocalcemia y solo en 1 a 4 % de los pacientes sanos(29).
Síntomas crónicos
Los pacientes con hipocalcemia crónica pueden tener ausencia de síntomas de irritación neuromuscular, incluso con niveles muy bajos de calcio sérico. En muchas oportunidades se detectan incidentalmente en exámenes de rutina, embarazo o con el uso de medicamentos hipocalcemiantes como los bisfosfonatos. Es común encontrar alteraciones del ectodermo como piel seca y alopecia. El producto calcio fósforo alto puede producir calcificaciones en el cerebro, riñón, articulaciones, ojos, vasos sanguíneos y otros órganos(2,4,11,12). Las anormalidades dentales sugieren un tiempo muy largo desde el inicio de la hipocalcemia. Se han descrito también otras alteraciones como hiperplasia cementaria y alteración en el patrón alveolar óseo(30).
Los síntomas neurológicos crónicos son secundarios a la calcificación de los ganglios basales, hallazgo presente hasta en el 73,8 % de los pacientes con hipoparatiroidismo idiopático(31, 32), seguido de calcificaciones de la corteza cerebral y el cerebelo (Figura 1)(19, 27, 33). Hasta el 20-30 % de pacientes con calcificaciones de los ganglios basales presentan parkinsonismo, corea y otras alteraciones del movimiento(34). La hipocalcemia crónica causa cataratas subcapsulares y queratoconjuntivitis(35, 36).
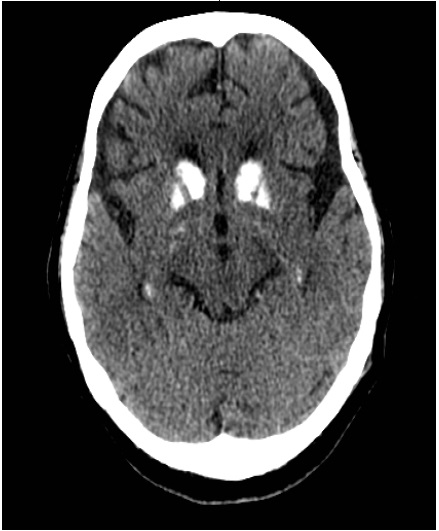
Figura 1 Calificaciones en ganglios basales. Mujer de 74 años con hipoparatiroidismo definitivo desde hace 35 años, con múltiples episodios de hipocalce mia. Se aprecian calcificaciones en los ganglios basales. (Fuente propia)
Con respecto al compromiso óseo, los pacientes con hipoparatiroidismo presentan aumento de la densidad mineral ósea, comparados con sujetos sanos, debido al pobre metabolismo del calcio y a la desregulación propia de la enfermedad. A pesar de tener una buena densidad mineral ósea, es un hueso inactivo por bajo recambio óseo(37). Se ha encontrado además una micro arquitectura alterada con un aumento en el volumen óseo trabecular y en su grosor, hallazgo que mejora con el uso de PTH recombinante humana 1-84(5)(38)(39)(40)(41). A pesar de que hay más hueso, este está deteriorado con una alteración en la fuerza ósea dada por el pobre recambio y una disminución en el remodelamiento, debido a la ausencia de PTH(38). Se desconoce si existe un riesgo mayor o no de fracturas dadas las limitaciones para tener cohortes con el poder suficiente.
La baja concentración de calcio con PTH suprimida lleva a una disminución del calcio filtrado, aunque con una relativa hipercalciuria si tenemos en cuenta las concentraciones séricas de calcio. Adicionalmente, la hiperfosfatemia junto con los niveles bajos de PTH, producen una regulación negativa de la concentración de calcitriol. Esta disminución de la forma activa de la vitamina D produce una disminución en la absorción intestinal de calcio. La elevación del calcio sérico, lograda con la terapia de remplazo con calcio y calcitriol, lleva a una mayor filtración de dicho ion en el riñón, pero debido a las concentraciones bajas de PTH no hay una adecuada reabsorción en los túbulos, produciéndose así hipercalciuria y riesgo aumentado de cálculos urinarios y nefrocalcinosis(2). Por otro lado, el aumento en el producto calcio fosforo aumenta el riesgo de mineralización ectópica en los riñones, potencialmente produciendo enfermedad renal crónica por disminución en la capacidad de filtrado del paciente. Los hallazgos de calcificación renal deben evaluarse periódicamente con ecografía(17).
Diagnóstico y estudios paraclínicos
Para hacer el diagnóstico es suficiente la hipocalcemia confirmada en dos ocasiones y PTH baja o indetectable (< 20 pg/mL)(42). Esta combinación de elementos descarta cualquier otra causa de hipocalcemia (deficiencia de vitamina D, malabsorción, enfermedad renal), ya que en estas se esperaría una respuesta adecuada de la PTH (valor en rango normal alto o elevado)(2, 11, 12, 42, 43). Generalmente, la hipocalcemia es transitoria luego de la cirugía y aparece en las primeras 24-48 horas del procedimiento. La hipocalcemia persistente luego de una intervención quirúrgica para manejo de hiperparatiroidismo se debe a una de dos etiologías: síndrome de hueso hambriento o hipoparatiroidismo transitorio. La única manera de diferenciar entre estas dos etiologías es el fósforo, ya que se encontrará aumentado en hipoparatiroidismo y disminuido en el síndrome del hueso hambriento(9). Es importante tener en cuenta que para tener una adecuada evaluación del calcio sérico debe medirse albúmina y corregir el calcio con respecto a los valores de ésta (Calcio corregido = Calcio medido + 0,8 (4,0 - albúmina)).
El magnesio se relaciona con las concentraciones sé- ricas de calcio, ya que produce tanto aumento como disminución en la producción de PTH(2, 44). La hipomagnesemia grave disminuye la secreción de PTH. Se cree que la disminución de la síntesis y secreción de dicha hormona es debida a un efecto directo en la subunidad alfa del receptor CaSR, asociado a proteína G que produce la depleción intracelular de magnesio. Puede ser difícil descartar hipomagnesemia como causa de la hipocalcemia, debido a que puede encontrarse magnesio sérico normal, con reservas intracelulares disminuidas(26, 45, 46).
La medición de 25(OH) vitamina D no es necesaria en la evaluación inicial de los pacientes con hipoparatiroidismo, pero es importante en aquellos pacientes en los cuales se sospecha que la hipocalcemia sea por deficiencia de vitamina D(47- 49). En estos pacientes la PTH suele encontrarse elevada y el fósforo disminuido (o en límite inferior de la normalidad), a menos que exista otra alteración asociada. La medición de calcio en orina de 24 horas puede ser útil en el diagnóstico diferencial del paciente con hiperparatiroidismo normocalcémico(18). Adicionalmente, se recomienda estudio genético en pacientes con hipoparatiroidismo idiopático ya que esto implica decisiones importantes para el tratamiento(11, 50).
Tratamiento
La finalidad del tratamiento es mejorar los síntomas de hipocalcemia y mejorar la calidad de vida de estos pacientes(11). Las metas del tratamiento incluyen mantener el calcio (corregido para nivel de albúmina sérica) en el límite inferior de la normalidad o un poco por debajo de este. Se busca que los pacientes tengan fósforo y magnesio dentro de límites normales. La meta del producto calcio-fosfato es menor de 55 mg2 /L2 ; adicionalmente, se busca evitar la hipercalciuria. Se ha propuesto que la meta para el calcio en orina de 24 horas sea < 300 mg en hombres y < 250 mg en mujeres, o para ambos sexos hasta 4 mg/kg/24h(11).
El tratamiento se basa en la reposición de calcio y análogos de vitamina D(5). Para el manejo de los casos agudos de hipocalcemia, se debe diferenciar entre hipoparatiroidismo sintomático o asintomático. En los posoperatorios con calcio bajo con PTH baja y asintomáticos, el aporte oral y rutinario de calcio y análogos de vitamina D es suficiente, mientras las glándulas recuperan su función(6- 8, 11). Un metaanálisis demostró que la administración profiláctica de 3600 mg de carbonato de calcio y 0,5 mcg de calcitriol durante los 10-15 días posoperatorios, disminuye la frecuencia de síntomas de hipocalcemia de 35 % a 3 %(51). En casos sintomáticos y con niveles de calcio superiores a 7 mg/dL, se debe intentar en principio un aumento de la dosis oral a 4800 mg de carbonato de calcio diarios y 1 mcg de calcitriol. Si los síntomas desaparecen, es confiable mantener este esquema por 15-30 días e iniciar una suspensión progresiva basada en la medición de calcio y PTH(51). En caso de síntomas, calcio sérico menor de 7 mg/dL y/o hallazgos paraclínicos sugestivos de compromiso vital (alteración electrocardiográfica, respiratoria o neurológica grave), es necesaria la administración de calcio intravenoso (Tabla 2) acompañado desde el inicio de suplemento oral de calcio y calcitriol, además de la corrección de factores agravantes como hiperfosfatemia, alcalosis, e hipomagnesemia(4, 7, 10- 13). Una vez superado el periodo agudo (30 días a 6 meses) se debe determinar si la hipofunción glandular es definitiva(11).
En los casos de hipoparatiroidismo definitivo y con miras a mantener el calcio estables y en metas, se recomienda que este sea administrado siempre con análogos activos de vitamina D, ya que en aquellos casos en los que se dan solo suplementos de calcio o se incrementa este en la dieta, solo se logra producir un incremento leve y transitorio del calcio sérico(5). Por esto, se debe garantizar primero un aporte de vitamina D, mediante su forma activa, el calcitriol, que no depende de la participación de la PTH para su activación(52). Se debe suministrar entre 0,5 a 2 µg/ día. Adicionalmente, se deben dar aportes de sales de calcio oral, ya sea mediante carbonato de calcio (40 % de la tableta corresponde a calcio elemental) o citrato de calcio (21 % de la tableta equivale a calcio elemental), entre 1 a 2 gramos de calcio elemental al día, como dosis total, que debe ser repartida durante el día. Se necesita dar el carbonato de calcio con el estómago lleno para mejorar su absorción con el pH ácido. Por último, es muy importante disminuir los fosfatos en la dieta o usar quelantes con el fin de tener un producto calcio - fósforo bajo y evitar calcifilaxis(4,10,11,12,13).
Uno de los problemas que puede traer la suplementación de calcio es la hipercalciuria. En estos pacientes se recomienda titular la dosis de calcio oral, disminuir el consumo de sodio en la dieta y/o la adición de un diurético tipo tiazídico en dosis de 25 a 37,5 mg/día, ya que permite la reabsorción de calcio urinario a nivel del túbulo contorneado distal(53). Es de anotar que el efecto que tienen los diuréticos tiazídicos en la excreción de calcio es dosis-dependiente, de manera que se requiere de dosis altas de diurético para lograr la disminución esperada en el calcio urinario. La limitación para dosis elevadas de tiazida es el posible desarrollo efectos adversos.
Perspectivas terapéuticas futuras
Hasta el momento, el hipoparatiroidismo no se trata rutinariamente con reposición de PTH(6, 7, 38, 54). Existen dos moléculas disponibles como análogos de esta hormona: PTH 1-34 (teriparatide)(55) y la PTH 1-84 (NATPARA®)(5). Estos dos medicamentos difieren en su vida media, por ende, con teriparatide se requiere una dosis de 20 microgramos dos veces al día para evitar fluctuaciones en el calcio(28) y mantener una concentración estable, mientras que PTH 1-84 requiere una administración al día. Con el uso de análogos recombinantes de PTH se ha demostrado una mejoría significativa en la calidad de vida con respecto a la terapia estándar(28, 56, 57) y una disminución en la dosis requerida de calcio y calcitriol, sin eventos adversos graves(8, 58). Un meta-análisis encontró 11 estudios con PTH recombinante en el tratamiento del hipoparatiroidismo con una utilidad de este medicamento para normalizar el calcio(59). Sin embargo, la hipercalciuria mejoró solo con teriparatide y no con PTH 1-84, contrario a lo reportado en el estudio a más largo plazo con PTH 1-84, donde se demostró una mejoría en la hipercalciuria(60).
Para la Food and Drug Adminstration (FDA), el uso de PTH 1-84, se encuentra restringido para casos seleccionados en los cuales no hay corrección de la hipocalcemia a pesar de encontrarse recibiendo calcio y formas activas de vitamina D. En Colombia, el teriparatide (FORTEO® y OSTEOTIDE®) tiene registro del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) para uso como coadyuvante en el tratamiento de mujeres con osteoporosis y riesgo incrementado de fracturas(61,62), pero no está aprobado para el hipoparatiroidismo. A futuro se espera que se presente al INVIMA el medicamento NATPARA® que ya está aprobado por la FDA y la Agencia Europa de Medicamentos para el uso en hipoparatiroidismo.
Las indicaciones para iniciar PTH sugeridas en la primera reunión de trabajo de hipoparatiroidismo se pueden ver en la Tabla 3(4, 5).
CONCLUSIONES
El hipoparatiroidismo es un trastorno que no es usual en la práctica clínica, por ende, muchos pacientes tienen un diagnóstico tardío. Este artículo presenta una revisión del tema, esperando educar la población médica y generar conciencia de este desorden. Dado que la etiología en la mayoría de los casos es posquirúrgica, siempre debe sospecharse en un paciente con síntomas compatibles neuromusculares en un posoperatorio de cirugía en cuello. La medición de calcio, PTH, fosforo y magnesio son esenciales en el enfoque inicial. La presencia de calcio bajo con PTH baja confirman el diagnóstico. El pilar de tratamiento es el remplazo de calcio asociado a análogos de vitamina D como el calcitriol. El ajuste de la dosis depende de muchos factores y debe individualizarse. Idealmente y por ser una enfermedad rara deberían ser manejados por especialistas del área. En algunos casos de difícil manejo, con hipocalcemia persistente a pesar de dosis altas de calcio y calcitriol o con complicaciones, se puede usar PTH recombinante. A futuro, se debe establecer con claridad cuáles son los pacientes que más se benefician de estas nuevas terapias y son necesarios estudios en nuestro medio para conocer las necesidades actuales de estos pacientes en nuestro país.

















