INTRODUCCIÓN
En la actualidad, la anafilaxia constituye una causa frecuente de consulta en los servicios de urgencias que tiene consecuencias potencialmente fatales, por lo que es importante que el médico que realice la atención tenga conocimientos claros y suficientes sobre el manejo de esta condición. Existen guías de práctica clínica elaboradas con tal propósito(1, 2), sin embargo, en múltiples reportes internacionales se evidencia pobre conocimiento y adherencia a las mismas, encontrándose falencias en los conocimientos del personal de salud que trata esta condición.
Es objetivo de esta revisión hacer un recuento de algunos puntos relevantes del diagnóstico y manejo de esta condición, reforzar conceptos en los cuales se ha evidenciado falencias en la práctica clínica que dificultan la aplicación de las guías y realizar una actualización de la revisión publicada en el año 2000 por Cardona, et al(3).
DEFINICIONES
La anafilaxia se define como una reacción de hipersensibilidad, principalmente mediada por inmunoglobulina E (tipo I según clasificación de Gell & Coombs), sistémica, de instauración rápida y potencialmente fatal(4- 7), con mecanismos, manifestaciones clínicas y severidad variable que resulta de la liberación súbita de mediadores de mastocitos y basófilos(8).
El término “anafilaxia”, se acuñó como un opuesto al término “profilaxis”, por Charles Richet y Paul Portier en 1901, quienes pretendían inmunizar perros contra el veneno de la anémona de mar y lograron, por el contrario, aumentar la sensibilidad a este veneno, posterior a la reinyección del extracto del mismo(9). En la definición no se incluye la palabra choque, debido a que ésta no necesariamente está presente en todos los casos de anafilaxia.
El término “reacción anafilactoide” se refiere a un evento clínico similar, pero que no es mediado por inmunoglobulina E. En el 2003 la Organización Mundial de Alergia (WAO por sus siglas en inglés), sugiere que este último término sea abandonado y todos los eventos, independiente del mecanismo fisiopatológico, sean denominados episodios de anafilaxia, existiendo así otros mecanismos inmunológicos no IgE mediados como por ejemplo por IgG y mecanismos no inmunológicos, que podrían explicar también el cuadro(4).
EPIDEMIOLOGÍA
La incidencia exacta de esta condición es desconocida, pero se estima que aproximadamente está entre 50 a 2000 episodios por cada 100.000 personas por año, según la población estudiada(10- 13). La prevalencia de esta condición varía ampliamente, estimándose en 0,05 % a 5,1 %(14, 15) a lo largo de la vida y varios estudios sugieren que se ha incrementado, particularmente en países desarrollados(14, 16- 18). La mortalidad de esta condición es rara y se estima entre 0,33 y 3 muertes por 1.000.000 de personas al año(19- 24), sin embargo, puede ser mayor en pacientes asmáticos, adolescentes y ancianos con comorbilidades(25, 26).
Los medicamentos, alimentos y las picaduras de insectos ocasionan la mayoría de los episodios, pero virtualmente cualquier sustancia capaz de inducir la degranulación sistémica de los mastocitos y basófilos puede producirla(27). Los factores desencadenantes varían con la edad: en niños, adolescentes y adultos jóvenes; la principal causa de anafilaxia son los alimentos, mientras que en pacientes de edad mediana y avanzada, las causas más comunes son los medicamentos y las picaduras de insectos(6, 27- 30).
En muchos países, incluyendo a Colombia, no se conoce la epidemiología general de la anafilaxia, así como tampoco el panorama del manejo que se tiene de esta patología. Sin embargo, algunos acercamientos permiten identificar las causas más frecuentes de alergia en la región del trópico, entre las cuales se describe reacciones a vegetales, frutas, mariscos y medicamentos(31- 37), lo que resulta ser similar a las descripciones en Latinoamérica, donde las causas más frecuentes de anafilaxia son los alimentos (36,1 %), medicamentos (27,7 %) y picaduras de insectos (26,2 %)(38).
CARACTERÍSTICAS CLÍNICAS
El diagnóstico de esta entidad es fundamentalmente clínico(27, 39). Las manifestaciones clínicas de la anafilaxia, varían ampliamente según los órganos implicados, estas pueden ocurrir hasta dos horas posteriores a la exposición al alérgeno detonante, pero por lo general, ocurre alrededor de 30 minutos después para la exposición por vía oral o incluso más temprano en el caso de aplicación parenteral de medicamentos o picadura por insectos(40). La urticaria, angioedema y el enrojecimiento de la piel, son las manifestaciones más comunes de la anafilaxia(12, 41), estas pueden estar ausentes en una anafilaxia rápidamente progresiva o en el contexto perioperatorio(27). En un estudio reciente que describe una cohorte de 2012 pacientes pediátricos y adultos con anafilaxia, la piel es el órgano más frecuentemente comprometido (84 %), seguido de síntomas cardiovasculares (72 %) y síntomas respiratorios (68 %)(42, 43).
Los síntomas respiratorios suelen ser más frecuentes en los niños(39) e incluyen rinorrea, obstrucción nasal, disnea, tos y sibilancias. Las manifestaciones cardiovasculares son predominantes en los adultos(39) y son las principales responsables de las fatalidades durante las reacciones anafilácticas. El corazón representa tanto una fuente, como un blanco de los mediadores inmunológicos liberados durante reacciones alérgicas graves(41). Los mastocitos, que se encuentran presentes de manera abundante en este órgano, al activarse liberan mediadores que influyen en la función ventricular, el ritmo cardiaco y el tono de las arterias coronarias, ocasionando manifestaciones que incluyen hipotensión y shock, arritmias cardiacas, disfunción ventricular e infarto, este último conocido como síndrome de Kounis, el cual se define como la concurrencia de síndrome coronario agudo y anafilaxia(44- 47).
En cuanto a los síntomas gastrointestinales, tales como dolor abdominal, vómito o diarrea, se ha reportado que están presentes hasta en 45 % de los episodios de anafilaxia. Menos frecuente se mencionan manifestaciones neurológicas como cefalea, acúfenos, vértigo, relajación de esfínteres, convulsiones y pérdida del estado de conciencia(48).
La anafilaxia es definida como una reacción de instauración rápida, potencialmente fatal, posterior a la exposición a un agente probable y su curso clínico es impredecible en el tiempo, puede ir desde una reacción autolimitada, debido a mediadores endógenos compensatorios o bien progresar rápidamente a colapso cardiorrespiratorio y conducir a la muerte(24, 48). No hay factores que permitan predecir el curso de una reacción en cuanto a duración, gravedad o recurrencia (reacción bifásica).
La anafilaxia bifásica ocurre en 1 % a 20 % de casos de anafilaxia(49), la mayoría se presenta 8 horas posteriores a la remisión del primer episodio y sus manifestaciones clínicas pueden ser equivalentes o de mayor severidad que al inicio(50, 51). Se ha reportado que las reacciones anafilácticas prolongadas pueden durar desde 5 hasta 32 horas a partir de su inicio(50). La severidad de la fase inicial de una reacción anafiláctica no es predictiva para una reacción bifásica o prolongada, es por ello que los pacientes requieren monitorización durante varias horas después de la recuperación de la fase inicial; sin embargo, aún no hay un acuerdo generalizado en cuanto al tiempo de espera, siendo recomendado por algunas guías como la de la WAO un tiempo de 6 horas(1), mientras que otras sugieren al menos 24 horas.
De manera infrecuente, el inicio de las manifestaciones clínicas se retrasa hasta después de dos horas de la exposición al agente causal, conocida como anafilaxia retardada(52).
CAUSAS
Los alérgenos responsables de la anafilaxia varían con la edad, ocupación y pasatiempos(53). Los principales desencadenantes a nivel mundial son los alimentos, veneno de insectos y medicamentos(54).
En un estudio realizado en Alemania entre el 2008 y el 2010, mediante encuestas a médicos de varios servicios de emergencias, se reportaron en total 333 casos de anafilaxia, siendo los alimentos los alérgenos más comunes en niños y adultos jóvenes en un 46,2 %; de ellos, los frutos secos y productos animales fueron los más frecuentemente implicados, mientras que en los adultos mayores se encontró que los medicamentos son la principal causa de anafilaxia, con una frecuencia de un 31,2 %, los más comunes fueron los antiinflamatorios no esteroideos (AINEs), el metamizol y los antibióticos. Se encontró también que el veneno de insectos fue un desencadenante más común en adultos que en niños 20,4 % Vs. 7,7 %(43). Entre las poblaciones de riesgo, las picaduras de himenópteros son la causa de anafilaxia más frecuente en pacientes con mastocitosis, un trastorno proliferativo de progenitores hematopoyéticos de mastocitos, que conduce a una expansión y acumulación de un número excesivo de mastocitos en uno o más órganos. La prevalencia de anafilaxia ha sido reportada considerablemente mayor en estos pacientes, con respecto a la población general; la mayoría de los pacientes con mastocitosis sistémica se diagnostican durante el estudio de anafilaxia por picadura de himenópteros y a su vez, la mastocitosis sistémica se asocia con mayor riesgo de reacciones graves(55).
El registro europeo de anafilaxia en niños y adolescentes realizado entre 2007 y 2015, donde se identificaron 1970 pacientes menores de 18 años con anafilaxia, confirma que los alimentos son la principal causa de esta reacción alérgica severa en este grupo etario con una participación de 66 %, siendo los alimentos más importantes el huevo de gallina, la leche de vaca y las nueces(56). En los adultos, los alérgenos alimentarios más comunes son el trigo, el pescado y los mariscos(53). La inmunoterapia específica se ha reportado como un inductor de reacciones anafilácticas, sin embargo, se puede prevenir con la selección adecuada de pacientes y es el tratamiento de elección en los procesos alérgicos, incluso entre los pacientes con anafilaxia por insectos(43). Los informes de anafilaxia a animales peludos son extremadamente raros, con pocos casos reportados en la literatura, especialmente a caballo y gato(57). El látex es más comúnmente conocido como un alérgeno de contacto en el ámbito ocupacional, sin embargo se han documentado casos de anafilaxia por exposición al látex, ya sea en el contexto peri-anestésico(58) o incluso por alimentos preparados con guantes de látex(59).
Algunas condiciones actúan como cofactores, disminuyendo el umbral de exposición al alérgeno necesaria para desencadenar anafilaxia estos son el ejercicio, etanol, los AINEs, infecciones agudas, estrés y estado peri-menstrual(54).
La anafilaxia idiopática se refiere a aquella sin una causa discernible después de realizar una evaluación diagnóstica apropiada. Una proporción significativa de casos de anafilaxia se clasifica como idiopática, entre 24 % hasta 59 % según la serie(60).
DIAGNÓSTICOS DIFERENCIALES
El diagnóstico de anafilaxia puede ser evidente en el contexto de un paciente con historia clara de exposición a un alérgeno, previo al inicio de los síntomas; de lo contrario, sus manifestaciones clínicas pueden superponerse con otras enfermedades sistémicas.
La reacción vaso-vagal representa el diagnóstico diferencial más común, en ella las manifestaciones cutáneas son palidez y frialdad, las manifestaciones del tracto respiratorio están ausentes, la presión arterial se encuentra normal o elevada y la frecuencia cardiaca disminuida, mientras que en la anafilaxia es infrecuente la bradicardia y parece estar relacionada con la picadura de himenópteros(50).
La urticaria aguda generalizada y el angioedema, pueden presentarse como manifestaciones de anafilaxia, o bien, presentarse como entidades aisladas. Estos hallazgos cutáneos son limitados a la piel y el tejido celular subcutáneo, sin compromiso de otros órganos o sistemas, pueden presentarse en el contexto de una reacción alérgica, infecciones o estímulos físicos(5, 6). Los pacientes con angioedema hereditario o adquirido, mediado por bradicinina, pueden tener compromiso de la lengua o laringe y pueden tener compromiso del tracto gastrointestinal, manifestándose como dolor abdominal(61), por lo anterior, debe incluirse dentro del diagnóstico diferencial de la anafilaxia.
En el diagnóstico diferencial hay que considerar 40 o más alternativas, algunas de ellas comunes en la práctica clínica, como una exacerbación de asma; otras son infrecuentes, síndromes con excesos de histamina como mastocitosis sistémica, urticaria pigmentosa y quiste hidatídico; los denominados síndromes de restaurante, como sensibilidad al glutamato monosódico o a sulfitos y escombroidosis. Algunos síndromes que se manifiestan con rubor, incluyendo tumores carcinoides y menos frecuente el feocromocitoma(62).
Es importante tener en cuenta que en gran medida el diagnóstico diferencial está relacionado con la edad del paciente. En los lactantes se debe considerar la aspiración de cuerpo extraño, las malformaciones del tracto respiratorio o gastrointestinal y el síndrome de muerte súbita. En los adultos el infarto del miocardio, embolismo pulmonar y accidente cerebrovascular, son consideraciones a tener en cuenta(48, 62, 63).
CRITERIOS DIAGNÓSTICOS
Existen criterios diagnósticos ampliamente aceptados para ayudar a identificar casos probables de anafilaxia (Tabla 1)(5). En un estudio retrospectivo donde se incluyeron 214 pacientes con diagnóstico de reacciones alérgicas o relacionados, estos criterios muestran una sensibilidad del 96,7 % y especificidad 82,4 % para el diagnóstico de esta entidad(64) por lo que se consideran útiles en el servicio de urgencias(9, 65, 66).
AYUDAS DIAGNÓSTICAS
El diagnóstico de anafilaxia es eminentemente clínico. Sin embargo, en algunos pacientes el diagnóstico clínico se puede orientar, al igual que su causalidad, mediante diferentes pruebas, con el objetivo de que el/los desencadenante/s específicos puedan ser identificados y evitados y las recurrencias de anafilaxia prevenidas.
Triptasa sérica
La triptasa, localizada principalmente en los mastocitos y basófilos, se libera durante la activación de estos, alcanzando un pico sérico a los 60 a 90 minutos después de ocurrida la degranulación, aunque sigue siendo detectable durante aproximadamente 5 horas(67). La medición sérica de la triptasa es la ayuda diagnóstica de anafilaxia más difundida en el mundo. Se considera que cuando está por encima del valor de referencia de laboratorio (por lo general >14mg/ ml) orienta el diagnóstico(29, 68). Recientemente se ha estipulado que un aumento de 1,2 veces el valor basal más la suma de 2mg/L, tiene una sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo de 78 %, 91 %, 98 % y 44 % respectivamente, para el diagnóstico de anafilaxia en el contexto perioperatorio(69). Debe tenerse en cuenta que la triptasa sérica puede tener un aumento basal en las personas que padecen síndrome de activación mastocitaria, mastocitosis sistémica, enfermedad de Gaucher, leucemia mieloide aguda y síndrome mielodisplásico(70- 73).
Otras pruebas como la medición de la prostaglandina D2 en orina(74), los niveles de histamina plasmática, el factor activador de plaquetas (PAF por sus siglas en inglés), parecen tener una buena sensibilidad y especificidad(75) pero su disponibilidad en los laboratorios clínicos locales es menos difundida.
IgE específica de alérgeno
Los niveles séricos de inmunoglobulina E específica de alérgeno (sIgE) o las pruebas cutáneas (SPT), se solicitan según el agente etiológico sospechado. Cuando al menos una de estas pruebas es positiva y la historia es compatible, el agente se define como susceptible de ser el causante de la reacción anafiláctica(65). Las pruebas cutáneas deben ser realizadas con instrumentos y técnicas validadas, preferiblemente 3 a 4 semanas después del episodio anafiláctico, para permitir que los mastocitos recuperen la capacidad de liberar mediadores. Las pruebas in vitro pueden resultar falsamente negativas si la toma se realiza durante el período de resucitación con líquidos debido a dilución de la IgE, por lo que se recomienda repetirla algunas semanas después del evento en caso de ser negativa(76, 77).
Pruebas de reto
Consisten en la administración de dosis incrementales del producto sospechoso, generalmente por vía oral, en donde se puede observar si se provoca una reacción alérgica similar a la referida por el paciente en el episodio de anafilaxia. Aunque no determina el mecanismo subyacente, se considera que es el procedimiento diagnóstico definitivo ya que demuestra la relación entre manifestación clínica y el producto ingerido(78)(79).
FISIOPATOLOGÍA
Se han propuesto varios mecanismos fisiopatológicos de anafilaxia. Uno de ellos y el más importante es una reacción dependiente de IgE en la cual ésta se une a su receptor de alta afinidad (FcεRI) presente en los mastocitos y basófilos, los que posteriormente liberan mediadores inflamatorios y citoquinas que permiten el aumento de la permeabilidad vascular y la contracción del músculo liso asociado a las manifestaciones clínicas de la anafilaxia. Otro mecanismo, independiente de IgE, involucra la unión de IgG y requiere proporcionalmente más cantidad de antígeno y anticuerpo que la vía dependiente de IgE. Se ha visto que estos dos mecanismos liberan factor activador de plaquetas (PAF), pero solo el mecanismo dependiente de IgE libera histamina(80). Aunque la anafilaxia IgG-dependiente no ha sido demostrada en humanos, los receptores IgG son capaces de activar los macrófagos para liberar PAF(81), el cual puede activar mastocitos in vitro(82).
La activación del mastocito humano vía el receptor Fc gamma I de alta afinidad de la IgG (FcγRI-IgG), constituye un nuevo paradigma. Este receptor normalmente es ocupado por IgG monomérica, por lo que no previene su activación por complejos inmunes de IgG, los que al tener mayor afinidad por el receptor, pueden desplazar la IgG monomérica y activar respuestas de hipersensibilidad(83, 84). Por otra parte, los complejos inmunes también activan el sistema de complemento, generando anafilotoxinas como C3a, la cual tiene un efecto directo en la activación del mastocito en ratas y líneas mastocitarias humanas tipo 1 (HMC-1)(85). El C3a ha demostrado un efecto sinergístico con la activación del FcγRI-IgG duplicando la liberación de β-hexosaminidasa(86). El efecto combinado de IgG y C3a resulta en una mayor activación mastocitaria, donde el estímulo de cada uno por separado no alcanzaría la liberación máxima de mediadores. Por ejemplo, se demostró en un modelo murino que el maní induce reacciones alérgicas severas por activación del complemento independiente de inmunoglobulinas, conllevando a la producción de grandes cantidades de C3a, lo que potencia la respuesta IgE inducida por el mismo alérgeno, contribuyendo al desarrollo de las reacciones características de estos pacientes(87). En contraste, otros alérgenos como la leche o el huevo, tienen pobre capacidad de activar el complemento(87), lo que soporta la idea de que la gravedad de las reacciones no depende solo de la susceptibilidad de la persona(88) o de la presencia de un cofactor, sino también en las características intrínsecas del alérgeno(88, 89).
La activación del complemento en ausencia de formación de complejos inmunes se ha propuesto como mecanismo de reacciones de hipersensibilidad en algunos medicamentos que contienen el excipiente cremophor®, como el propofol y el paclitaxel. El cremophor® forma micelas con lípidos séricos y colesterol que podrían estimular la activación del complemento bajo condiciones fisiológicas(90). La activación del complemento conduce a la liberación de C3a, C5a y C5b-9, las cuales desencadenan la activación de mastocitos, basófilos y otras células mediante sus receptores específicos. Desde el punto de vista clínico, estas reacciones no pueden ser diferenciadas de las reacciones mediadas por IgE, pero tienen características específicas. La mayoría se presentan con la administración del primer tratamiento en pacientes que nunca habían sido expuestos a estos medicamentos y las reexposiciones están relacionadas a manifestaciones más leves o a no presentar reacciones. Este tipo de reacciones responden a la manipulación de la tasa de infusión y a la premedicación con corticosteroides y antihistamínicos(91).
Por otra parte, está la anafilaxia no inmunológica, en la cual los mastocitos y basófilos se pueden degranular sin la ayuda de las inmunoglobulinas. Ejemplos de este tipo de anafilaxia incluyen factores físicos como el calor o el frío, los opioides y la vancomicina, los que degranulan directamente los mastocitos(92).
Hay cofactores o factores potenciadores que explicarían porque en algunos casos los alérgenos no son capaces de inducir una reacción alérgica o inducen una reacción leve, mientras que en otros casos desencadenan reacciones graves. El 30 % de los casos de anafilaxia tienen implicados cofactores que modulan su presentación clínica. En presencia de estos, las reacciones alérgicas pueden desarrollarse con concentraciones inferiores de alérgeno o ser más grave que en ausencia de ellos. El ejercicio físico y los AINEs son cofactores reconocidos al igual que los estrógenos, los inhibidores de la enzima convertidora de angiotensina, los β-bloqueantes, los hipolipemiantes o el alcohol(93).
De este modo, los mecanismos que explican la anafilaxia son variados y complejos. Algunos de ellos pueden ser claves en el desarrollo de la anafilaxia, mientras que otros estarían únicamente modulando la gravedad de la reacción.
MANEJO
La epinefrina es el medicamento de elección para el manejo de esta entidad; la WAO ha propuesto el uso inmediato de este medicamento(26) en la cara lateral del muslo por vía intramuscular, una vez se presente cualquier manifestación cutánea asociada a algún otro síntoma sistémico, en presencia de una exposición conocida a un posible alérgeno, incluso en ausencia de compromiso de órganos vitales, con el fin de prevenir la progresión a una reacción más grave; la dosis de adrenalina debe repetirse en caso de ser necesario (Figura 1)(94).
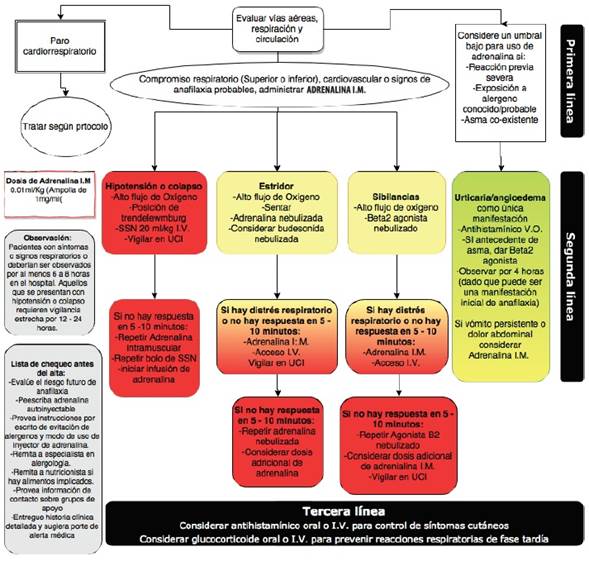
Figura 1 Ilustración esquemática del manejo inicial de la anafilaxia. Adaptado con permiso de Muraro A, Roberts G, Worm M, et al; EAACI Food Allergy and Anaphylaxis Guidelines Group. Anaphylaxis: guidelines fromthe European Academy of Allergy and Clinical Immunology. Allergy. 2014 Aug;69(8):1026-45(40)
La Academia Americana de Alergia, Asma e Inmunología (AAAAI) y el Colegio Americano de Alergia, Asma e Inmunología (ACAAI), han establecido unos parámetros prácticos para el diagnóstico y manejo de anafilaxia en el servicio de urgencias, adicional al uso de adrenalina como medida de primera línea, en donde se recomienda posicionar al paciente en decúbito supino para prevenir o contrarrestar colapso circulatorio, administrar oxígeno a todos los pacientes independiente de su estado respiratorio, obtener niveles de triptasa sérica y suministrar líquidos endovenosos de manera agresiva en pacientes en estado de choque. A su vez recomiendan el empleo de glucagón en caso de no restaurar el estado hemodinámico con la adrenalina, especialmente en pacientes que usen betabloqueadores y el uso de beta-2 agonistas si existe broncoespasmo asociado.
Se establece el uso de antihistamínicos y esteroides únicamente como terapia adyuvante, pero no como sustituto de la adrenalina; se recomienda también vigilancia durante 4 a 8 horas, especialmente en pacientes con antecedente de reacciones bifásicas o antecedente de asma y por último recomiendan el suministro de adrenalina autoinyectable para administración en el contexto ambulatorio en caso de ser necesario(39).
Vale anotar que actualmente el uso de antihistamínicos, esteroides u otros medicamentos no hacen parte del protocolo de manejo y su aplicación no debe retrasar o reemplazar el uso de adrenalina(9, 95), dado que puede aumentarse la mortalidad. En caso de anafilaxia secundaria a picadura de himenópteros, el tratamiento con inmunoterapia específica a largo plazo constituye una medida efectiva y esencial para evitar nuevos episodios de anafilaxia. Igualmente, existe la posibilidad de realizar desensibilizaciones en caso de reacciones anafilácticas a medicamentos de primera línea, en los cuales no existen otras opciones de manejo(96).
DISCUSIÓN
El conocimiento adecuado de los signos y síntomas clínicos de la anafilaxia, así como el tratamiento apropiado de esta condición permite evitar errores en el diagnóstico y manejo que podrían acarrear desenlaces adversos en el paciente. Algunos estudios que evalúan el cuidado de los pacientes con anafilaxia, han demostrado deficiencias en el manejo de esta condición en los servicios de urgencias y se ha observado que los medicamentos con mayor frecuencia empleados son los corticoides y antihistamínicos, más no la adrenalina que es el medicamento de primera elección(43, 97- 99). Además, pueden existir algunas discrepancias entre el modo de clasificar la severidad de las reacciones, lo que podría llevar a tratamientos disímiles(100, 101).
Un estudio latinoamericano reciente reveló que en más del 50 % de los países de esta región no poseen guías de práctica clínica y que el uso de adrenalina es utilizado en menos del 50 % de los casos, y que los antihistamínicos y esteroides casi siempre son utilizados(102). En Colombia, a pesar de que existe una Guía de práctica Clínica avalada por el Ministerio de Protección Social(103), el uso de adrenalina, en casos de anafilaxia, se encuentra en alrededor del 60 % de los casos(102).
En un estudio de corte transversal, que pretendía evaluar los medicamentos más frecuentemente implicados en anafilaxia en 11 países de Latinoamérica y su manejo, se encontró que la epinefrina fue usada solamente en el 27 % de los casos de anafilaxia y es empleada con más frecuencia en caso de shock anafiláctico(31). En otro estudio americano de corte transversal, que se realizó por medio de una encuesta vía web a 1114 médicos pediatras del servicio de urgencias, 620 (56 %) completaron el estudio, la mayoría (93,5 %) identifican la epinefrina como el manejo de elección para anafilaxia, sin embargo, sólo el 66,9 % utiliza la vía intramuscular para su administración(104).
En Colombia, de 989 pacientes remitidos a un servicio de alergología con diagnóstico presuntivo de anafilaxia, solo el 12,1 % (120 pacientes) cumplían criterios de anafilaxia con indicación y formulación de epinefrina. De los pacientes formulados, sólo 10 (8,3 %) llevaba consigo la epinefrina, encontrándose que el resto de los pacientes no sabían cómo usarlo (49 %), presentaban dificultades para el acceso al medicamento (23 %) o temían su uso (12 %), entre otras causas(105).
Estos datos indican que a pesar de que existen guías de práctica clínica basadas en la evidencia vigente en el mundo, su implementación dista de ser la ideal y por lo que se requieren medidas educativas para el personal de la salud que permitan el abordaje adecuado de esta condición.
CONCLUSIONES
Un diagnóstico acertado de la anafilaxia permitirá un manejo rápido y oportuno. Se considera necesaria la valoración por el especialista en alergología para aclarar mediante diversas pruebas, los agentes causales y diversas patologías subyacentes asociadas. La educación médica continuada, constituye una estrategia fundamental para consolidar y mantener los conocimientos necesarios para manejar la Anafilaxia.















