INTRODUCCIÓN
La metformina, uno de los medicamentos de mayor uso mundial, se prescribe aproximadamente a 120 millones de personas(1); es el fármaco de primera línea en el tratamiento de los pacientes con diabetes mellitus tipo 2(2), por su efecto benéfico al disminuir la mortalidad por causa cardiovascular(3) y su buen perfil de seguridad con muy bajo riesgo de producir hipoglucemia. Ejerce su efecto hipoglucemiante al suprimir la producción hepática de glucosa y mejorar la sensibilidad periférica a la insulina(4). La gran mayoría de sus efectos adversos son de origen gastrointestinal: diarrea, náuseas y vómito(5); sin embargo, puede llevar a acidosis láctica, efecto raro pero potencialmente fatal que obligó a regular su uso bajo ciertas condiciones, entre ellas disfunción renal o hepática; esta complicación usualmente requiere tratamiento con terapias de reemplazo renal para el control de la acidosis metabólica. A continuación presentamos dos casos de acidosis láctica por metformina que requirieron terapias de reemplazo renal y tuvieron diferentes desenlaces.
CASO 1
Mujer de 69 años, con antecedentes de diabetes mellitus, hipertensión arterial y enfermedad renal crónica estadio 5 en hemodiálisis; con cuadro clínico de una semana de evolución de astenia, adinamia, náuseas, vómito, deterioro de su clase funcional y somnolencia. Por tal motivo consultó al servicio de urgencias en donde la encontraron en mal estado general, encefalopática, deshidratada, taquicárdica, taquipneica, normotensa; los gases arteriales mostraron una acidosis metabólica grave con anión gap elevado debido a hiperlactatemia. Por el interrogatorio, se documentó que hacía dos meses estaba tomando 850 mg de metformina cada 8 horas; se descartaron otras causas de hiperlactatemia asociadas a hipoperfusión, isquemia intestinal, deficiencia de vitamina B1 y otros tóxicos (Tabla 1). Con el diagnóstico de acidosis láctica grave asociada a metformina, se trasladó a la Unidad de Cuidados Intensivos (UCI), donde se le hizo reanimación hídrica y se inició inmediatamente la terapia de reemplazo renal con hemodiálisis, que fue mal tolerada, con desarrollo de hipotensión lo que obligó a cambiar a hemodiafiltración veno-venosa continua. Se logró controlar la acidosis láctica, pero presentó un evento cerebrovascular hemorrágico e infección pulmonar, con deterioro progresivo de su estado general y falla multiorgánica. La paciente falleció, una semana después del ingreso.
Tabla 1 Exámenes de laboratorio
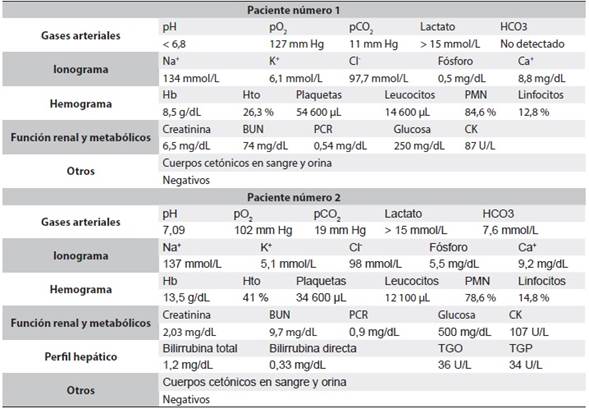
pO2: presión parcial de oxígeno; pCO2: presión parcial de dióxido de carbono, HCO3: bicarbonato; Na+: sodio sérico; K+: potasio sérico; Cl-: cloro sérico; Ca+: calcio sérico; Hb: hemoglobina; Hto: hematocrito; PMN: neutrófilos; BUN: nitrógeno ureico; PCR: proteína C reactiva; CK: creatinina kinasa; TGO: aspartato aminotransferasa; TGP: alanino aminotransferasa.
CASO 2
Hombre de 41 años, con antecedente de diabetes mellitus tipo 2, quien consultó al servicio de urgencias por presentar náuseas, vómito y diarrea después de la ingestión voluntaria 6 horas antes, de 100 tabletas de metformina y 100 de gemfibrozilo. Al ingreso estaba deshidratado, consciente y estable hemodinámicamente; los gases arteriales documentaron una acidosis metabólica hiperlactatémica con anión gap elevado, lo que se consideró secundario a intoxicación por metformina. En los exámenes complementarios se encontró además lesión renal aguda KDIGO 2 (Tabla 1). Se inició rápidamente reanimación hídrica y fue trasladado a la UCI para hemodiálisis bajo monitoreo estricto. Evolucionó hacia la mejoría, con control de la acidosis láctica y recuperación completa de la función renal basal sin presentar secuelas.
DISCUSIÓN
Presentamos dos casos muy graves de acidosis láctica por metformina en pacientes con distintos perfiles de comorbilidad; el primero, asociado a la administración iatrogénica de metformina durante varias semanas en una paciente con enfermedad renal crónica terminal y múltiples comorbilidades, cuyo desenlace fue fatal a pesar del tratamiento multidisciplinario.
El segundo fue secundario al consumo voluntario de una dosis extremadamente tóxica de metformina en un paciente con poca comorbilidad y con función renal de base normal, quien recibió terapia intensiva y tuvo un desenlace favorable.
La acidosis láctica por metformina se define como la presencia de acidosis hiperlactatémica, con pH menor de 7,35 y lactato mayor de 5 mmol/L, en presencia de exposición a metformina y que no se explica por otras causas(6). Su incidencia en pacientes que reciben metformina es de 7,4 por 100 000 por año y en no usuarios (sea por exposición accidental o por intentos de suicidio) se estima en 2,2 por 100 000 por año(7). En diferentes series, su tasa de mortalidad ha estado entre 10,8 % y 45 %(8- 11). Se produce por alteraciones metabólicas inducidas por la acumulación de metformina y su efecto al bloquear la cadena respiratoria en las mitocondrias, lo que ocasiona conversión de glucosa a lactato en el intestino, bloqueo del metabolismo oxidativo que impide la gluconeogénesis y finalmente, producción de glicolisis por vía anaerobia que se traduce en acumulación de lactato. Usualmente el medicamento se absorbe por el intestino, principalmente en el duodeno y el yeyuno, circula en el plasma sin unirse a proteínas y se excreta sin cambios principalmente por el riñón(5); puede acumularse en casos de disfunción renal; la acidosis láctica aparece usualmente con niveles de metformina mayores de 5 µg/mL.
Debido a los informes de casos sobre el desarrollo de acidosis láctica por metformina y al hecho de su depuración renal exclusiva, inicialmente se proscribió usarla en pacientes hombres con creatinina por encima de 1,5 mg/dL y en mujeres con creatinina por encima de 1,4 mg/dL, pero las recomendaciones se fueron modificando paulatinamente. Actualmente, algunas guías avalan su uso por debajo de una tasa de filtración glomerular (TFG) de 60 mL/min con ajuste de la dosis, disminuyendo 50 % entre 45 y 30 mL/min(12, 13). La discusión radica en definir si realmente las contraindicaciones clásicas de la metformina aumentan el riesgo de desarrollar acidosis láctica; un estudio observacional mostró que aproximadamente 26,5 % de los pacientes que tomaban metformina tenían una o más contraindicaciones para consumirla, más frecuentemente la lesión renal(8).
Algunos estudios han hallado que la disfunción renal favorece el aumento del nivel de metformina en el suero, pero no logra producir niveles que superen el umbral de toxicidad(14). Incluso, en algunas publicaciones se evidencia que una TFG por debajo de 60 mL/min no se relaciona con un aumento estadísticamente significativo de los niveles de ácido láctico o del riesgo de producir acidosis láctica importante(15, 16); esto contrasta con una cohorte de 34.571 pacientes diabéticos en la que hallaron aumento del riesgo de acidosis láctica cuando la TFG era menor de 60 mL/min; asimismo, este riesgo era mayor en usuarios de más de 2 gramos al día o más de 730 gramos en el último año(7). Estos hallazgos dispares han alimentado la controversia sobre la seguridad de la metformina en pacientes con enfermedad renal avanzada; sin embargo, no hay que subestimar otros factores que contribuyen al desarrollo de la acidosis láctica, tales como: falla cardíaca congestiva, enfermedad hepática, lesión renal aguda y uso concomitante de medicamentos que se asocian a acidosis láctica tipo B (isoniazida, linezolide, teofilina, valproato, espironolactona, agonistas beta 2 y algunos antirretrovirales)(5). En una cohorte histórica de 152 pacientes, se halló que 75 % tenían al menos una condición clínica que pudo ocasionar la acidosis láctica, además del compromiso renal; en otra serie este valor llegó hasta el 89 % (8,10). Sin embargo, hay expertos que abogan por flexibilizar las contraindicaciones de la metformina y extender su uso aun con TFG por debajo de 30 mL/min(14), lo cual está hoy en día totalmente contraindicado.
A pesar de ello, la acidosis láctica por metformina se sigue presentando en diversos espectros, por lo que, más allá de la seguridad renal o no, no se puede despreciar el potencial intrínseco del medicamento para originar el trastorno ácido base y siempre debe ser tenido en cuenta en el enfoque de la acidosis metabólica tanto en consumidores crónicos como accidentales. Sobre todo en pacientes que tienen factores de riesgo como deterioro agudo de la función renal, intoxicaciones o condiciones de base que puedan precipitar el trastorno.
Los pacientes con acidosis metabólica por metformina suelen presentar complicaciones que llevan a hospitalización o estancia en UCI, y en una serie retrospectiva de 10 años 28 % presentaron algún tipo de secuela(10). En un estudio retrospectivo de pacientes admitidos a UCI por esta causa(17), se definieron factores pronósticos que confieren mayor riesgo de mortalidad como mayor edad, requerimiento de soporte vasopresor, necesidad de ventilación mecánica, puntaje LODS elevado, pH y HCO3 más bajos. El principal predictor de muerte es la coagulopatía y parece ser que quienes presentan intoxicaciones autoinfligidas (100 % de supervivencia sin secuelas) tienen mejor pronóstico que quienes presentan intoxicación accidental (48,3 % de mortalidad). En este estudio el lactato sérico y la concentración de metformina en plasma no se correlacionaron con el riesgo de mortalidad, y al parecer el estado basal de los pacientes fue un factor determinante en los desenlaces(17). La mitad de las muertes ocurren días después del ingreso y de iniciar la diálisis, lo que sugiere que no son producidas directamente por la acidosis metabólica y sí por complicaciones posteriores, como sucedió en el primer caso, en el que se controló rápidamente el trastorno ácido base, pero falleció por las diversas complicaciones(6). Por el contrario, el segundo caso era un paciente joven con pocas comorbilidades, quien respondió adecuadamente a un tratamiento oportuno.
Se han propuesto diferentes estrategias para afrontar esta complicación: los fundamentos del tratamiento son el manejo de soporte y la adecuada reanimación, pues no existen antídotos para controlar los efectos tóxicos del medicamento; el lavado gástrico solo es útil en las primeras horas de una intoxicación aguda y el uso de bicarbonato es discutible por el riesgo de ocasionar acidosis intracelular; en la mayoría de los casos se opta por las terapias de reemplazo renal, estrategia cuyo uso ha aumentado en los últimos años. Según una recopilación mundial de informes de casos de intoxicaciones que requirieron terapia extracorpórea desde 1913 hasta 2014, la metformina fue el segundo tóxico que más llevó a utilizar estas terapias en el período de 2000 a 2009 (85 casos) y fue el primero entre 2010 y 2014 (75 casos)(18); sin embargo, se discute la indicación actual de diálisis para estos pacientes.
La metformina es una molécula parcialmente dializable con peso de 165 daltones, que circula sin unirse a proteínas y con un volumen de distribución de 1-5 L/kg; la concentración letal en plasma es de 50 mg/L y la dosis tóxica es mayor de 5 gramos en adultos(6); la partícula se difunde libremente a través de los hemodializadores y hemofiltros, el principal limitante es el amplio volumen de distribución. La depuración biológica de la sustancia por los riñones es de 500 mL/min en riñones sanos, con hemodiálisis intermitente se depuran 200 mL/min y con terapias continuas hasta 50 mL/min, por lo que las terapias intermitentes son más eficaces que las continuas, pero se ven limitadas en pacientes con inestabilidad hemodinámica(6).
Luego de una revisión sistemática de la literatura, el grupo de tratamiento extracorpóreo en envenenamientos recomienda usar terapias dialíticas en los siguientes casos de pacientes con acidosis láctica por metformina(6): envenenamiento grave por metformina (1D): lactato por encima de 20 mmol/L, pH de 7 o menos, falla de la terapia estándar con medidas de soporte y bicarbonato. Se recomienda además la terapia dialítica en caso de (2D): lactato entre 15 y 20 mmol/L, pH entre 7 y 7,1. La decisión de hacer terapia extracorpórea se puede acelerar en caso de choque, función renal alterada (1D), falla hepática y alteración de la conciencia (2D). La terapia extracorpórea se suspende cuando los niveles de lactato son menores de 3 mmol/L, con un pH mayor de 7,35. Se prefiere la hemodiálisis intermitente con buffer de bicarbonato, pero las terapias de reemplazo renal continuo, son opciones aceptables cuando la estabilidad hemodinámica del paciente no permite las intermitentes. En el primero de los pacientes aquí presentados se optó por una terapia continua, debido a la inestabilidad hemodinámica producto del choque vasopléjico posterior; hubo rápida respuesta con resolución de la acidosis, pero el estado basal y las diferentes complicaciones como infecciones y coagulopatía llevaron a una evolución tórpida que culminó con la muerte; el segundo paciente, a pesar de tener altas dosis del medicamento, presentó evolución rápida y satisfactoria con la terapia dialítica intermitente, sin secuelas o deterioro posterior; estos dos casos refuerzan la hipótesis de que los niveles de metformina no son factores pronósticos, como sí pueden serlo las condiciones basales, el lactato y la disfunción renal de base.
CONCLUSIÓN
La acidosis láctica por metformina es una condición rara pero potencialmente fatal, por lo que es fundamental tenerla presente en el diagnóstico diferencial de pacientes con acidosis metabólica hiperlactatémica; la tasa de mortalidad puede llegar hasta el 50 % y depende de las condiciones basales del paciente y del compromiso multiorgánico que presente; son determinantes el nivel de lactato, el pH inicial y el desarrollo de coagulopatía. La diálisis es una alternativa salvadora en pacientes con enfermedad grave, por lo que estar familiarizado con sus indicaciones, puede suponer la diferencia entre una evolución favorable y mayor riesgo de complicaciones.














