INTRODUCCIÓN
El término conservación se describe como todo aquel procedimiento que permite mantener un objeto en su estado inocuo sin que este pierda sus características o propiedades originales. A razón de esto, la conservación de cadáveres corresponde a preservar todas las características con distintos fines. No fue sino hasta 1838 que el científico alemán William Hoffman inicio el uso de formaldehído en sus procedimientos de conservación; éste es un gas soluble en agua, gaseoso a temperatura ambiente. Lamentablemente fue catalogado como sustancia cancerígena por La Administración para la Salud y Seguridad Ocupacional de los Estados Unidos (OSHA según sus siglas en inglés), quienes condicionaron su uso, dilución y tiempos de exposición1.
En 1977, el científico alemán Dr. Gunther Von Hagens revolucionó la conservación de material biológico al introducir la plastinación2. Esta consiste en el reemplazo del agua y parte de los lípidos de los tejidos por polímeros curables, produciendo piezas secas e inodoras, de aspecto natural y duradero3, que la hace idónea para el uso en exposición museal y docencia4,5. A la fecha se han descrito diferentes tipos de polímeros y procedimientos, cada una con características propias3-8. En algunos de estos, por ejemplo, se usa resina epóxica con la que se logran cortes delgados 2-5 mm) y ultra delgados (0,5-1,5 mm) de piezas anatómicas, embebidas en láminas3,5,9,10. De forma similar sucede con las resinas de poliéster, de las que resultan cortes delgados (2-3 mm, 4-8 mm), con la característica de resaltar la sustancia gris respecto a la blanca en el tejido nervioso3,11-13. El procedimiento con silicona, por su parte, consigue piezas macroscópicas flexibles3,6,7,14,15,16,17.
Al comparar los tres métodos antes mencionados, el que usa silicona se considera un procedimiento básico debido a que presenta menos requerimientos infraestructurales y de equipos, a su fácil realización y sus excelentes resultados3,6,7. Debido a lo anterior, el laboratorio de plastinación de la Facultad de Medicina (FM) de la Universidad de Antioquia decidió adoptar inicialmente la plastinación en silicona particularmente el método Biodur® S10, conocida como el método estándar alemán. Esta, además, ha sido de amplia divulgación científica en múltiples laboratorios e instituciones en todo el mundo2; a razón de ello debió ser adaptada a las condiciones propias de nuestro laboratorio, siendo el proceso de adaptación el motivo de esta investigación.
En algunos países como India, China, Alemania, España, Chile, Perú, Argentina, México, Colombia, Estados Unidos de Norte América y Canadá se encuentran laboratorios de plastinación e instituciones que la implementan, tanto facultades de medicina como de otras áreas de la salud3,4,18-25.
La consecución de piezas anatómicas humanas es cada vez más compleja, debido a requisitos legales e infraestructurales26-29, por lo que la UDEA busca alternativas para la innovación en la enseñanza a través de los modelos artificiales y la simulación virtual que han adquirido importancia. Igualmente la optimización y modernización de las prácticas de enseñanza tradicionales con cadáveres, se han convertido en un reto y prioridad.
Tradicionalmente, en el laboratorio de morfología se han empleado diluciones de formaldehído para la preservación de cadáveres y muestras anatómicas. Sin embargo, el contacto con esta sustancia genera náuseas, cefalea, irritación ocular y dermatitis, con riesgos para la salud30,31. A razón de ello se generó la búsqueda objetiva de otras técnicas de preservación, surgiendo la plastinación como una opción atractiva, dado que al finalizar el proceso se obtienen piezas secas, inodoras, de aspecto natural y duradero3,6,7,8 lo que permite disminuir las concentraciones de vapores de formaldehído minimizando riesgos para estudiantes, docentes y personal relacionado con los laboratorios.
Desde el año 2002 se ha implementado la técnica de conservación mediante plastinación25, dando inicio al proyecto de desarrollo del Laboratorio de Plastinación de la FM de la UDEA, que aunque independiente del Departamento y Laboratorio de Morfología, se creó gracias a su estrecha cooperación.
METODOLOGÍA
El Laboratorio de Plastinación de la FM de la UDEA cuenta con una temperatura ambiente de 24 °C32. Los equipos registran una temperatura ambiente que oscila entre los 18 y 22 °C y presión atmosférica de 637 mmHg.
Estas condiciones exigieron adaptar la técnica estándar alemana de referencia, creada por el científico Dr. Gunther Von Hagens quien la desarrolló con el uso de acetona a temperaturas bajas (-25 °C) en HedelbergAlemania3, (Figura 1).

Figura 1 a) Manómetros y válvulas de aguja. b) Equipos para la impregnación y curado. Laboratorio de plastinación
La técnica de plastinación resultante de la adaptación del método estándar alemán, en adelante mencionada como técnica UDEA, consta de cuatro etapas: fijación, deshidratación, impregnación forzada y curado; la disección de la pieza anatómica se realiza durante todo el desarrollo, por tanto, no se considera una etapa sino un proceso dinámico. Se emplea polímeros, catalizadores y equipos de la marca alemana Biodur® (Figura 1), sustancias adquiridas localmente y piezas anatómicas humanas obtenidas en colaboración con el Departamento de Morfología de la UDEA (Tabla 1).
Primera etapa (Fijación)
La primera etapa consta de inmersión, inyección y/o perfusión de las piezas anatómicas en solución de formaldehído al 10 % por un periodo mínimo de una semana, que varía según las características propias de la pieza anatómica y garantiza así la perfusión del formol a todos los tejidos. En ocasiones se han adicionado pigmentos vegetales de la industria alimentaria local con el fin de darle una apariencia natural. El formaldehído inserta puentes de metileno entre los átomos de nitrógeno de proteínas adyacentes, por lo cual se considera un excelente agente fijador33,34.
Segunda etapa (Deshidratación)
En Colombia la acetona es un producto químico controlado, debido a su potencial uso en la fabricación de estupefacientes y sustancias psicotrópicas35, por lo que es de difícil consecución y alto costo. Por esta razón en el laboratorio de plastinación de la FM de la UDEA se decidió reemplazar la acetona por alcohol isopropílico (en adelante cualquiera de estas sustancias serán mencionadas como solvente intermediario). Esta adaptación fue posible debido a que estas moléculas presentan características estructurales y físico-químicas similares.
En el Laboratorio de Plastinación de la FM de la UDEA se realiza la deshidratación en frío a -15 °C, debido a condiciones propias de las instalaciones. Esto difiriere de la temperatura recomendada en la técnica estándar alemana, que es de -25 °C, lo que disminuye la retracción de los tejidos propia de esta fase de la técnica3,14,32.
Esta etapa se realizó mediante la inmersión del espécimen en alcohol isopropílico, que era cambiado periódicamente por esta misma sustancia a mayor concentración, se considera por finalizada la deshidratación cuando se obtenían dos mediciones consecutivas de por lo menos 7 días de diferencia entre ellas y concentraciones superiores al 99 %. Similar al proceso de desengrasado con cloruro de metileno relatado en la técnica estándar alemana36. Se efectuó el proceso de desengrasado con alcohol isopropílico, dejando las piezas por una a dos semanas a temperatura ambiente, según las características propias de la misma.
Tercera etapa (Impregnación forzada)
La extracción del solvente intermediario, sea acetona o alcohol isopropílico, se realiza mediante una bomba de vacío tomando ventaja de la diferencia entre la presión de vapor del solvente intermediario y la del polímero3,14; la extracción es directamente proporcional a la presión de vapor del solvente intermediario, pero es inversamente proporcional a la presión en la cámara de vacío.
En la técnica estándar alemana, la impregnación forzada finaliza una vez no se observa la extracción del solvente intermediario a presiones de 5 mmHg o inferiores, ya que la temperatura recomendada para este proceso es igual o menor de -25 °C, también conocida como impregnación en frío3,14. En el método propuesto por la UDEA, se utiliza alcohol isopropílico, solvente intermediario que se caracteriza por su baja presión de vapor, aspecto que dificulta su extracción completa, pues lograrlo requiere presiones más bajas y los equipos utilizados tienen límite de descenso en la presión; cercano a -5 mmHg.
Consecuentemente se halló que cuando se modificaba únicamente el solvente intermediario al método estándar alemán se observa mayor retracción y rigidez respecto a aquellas piezas sometidas al mismo proceso pero deshidratadas con acetona. Incluso era frecuente, semanas después de culminar el proceso, percibir el olor del alcohol isopropílico, evidencia de que no se había extraído totalmente de los tejidos, debido a la limitación de los equipos para lograr un mayor descenso de la presión; suceso que no ocurría con las muestras deshidratadas con acetona. Como relacionamos previamente, la extracción del solvente intermediario es directamente proporcional a la presión de vapor, por lo tanto, una alta presión de vapor favorece la extracción de este. Esta propiedad se relaciona con la energía cinética que poseen las mismas37, así mientras más energía se transfiera a una sustancia, mayor será su vaporización y aumentará la presión de vapor. Es por esto que si se aumenta la temperatura del solvente intermediario, como en las impregnaciones realizadas a temperatura ambiente, se estará aumentando la presión de vapor y por ende se favorecerá su extracción de los tejidos.
Dado que en el Laboratorio de Plastinación de la UDEA la impregnación forzada en frío de piezas deshidratadas con el alcohol isopropílico no fue satisfactoria, se decidió adoptar en el protocolo la reimpregnación forzada de las piezas anatómicas a temperatura ambiente (18 °C - 22 °C), posterior a la ya realizada en frío. Con ello, la adaptación en el método estándar alemán a las condiciones del laboratorio consistió en la deshidratación de las piezas anatómicas con alcohol isopropílico, impregnación en frío y posterior reimpregnación a temperatura ambiente.
Esta etapa se realizó con una mezcla de Biodur® S10:S3 en una proporción de 100:1 según la descripción original de la técnica3,14. Estas impregnaciones mencionadas se realizaron descendiendo gradualmente la presión. La técnica UDEA protocolizó inicialmente descender de la presión atmosférica hasta alcanzar 50 mmHg, finalizando cada impregnación a 5 mmHg o menos, y no se aprecia burbujeo en la superficie de la mezcla Biodur® S10:S3, ello es un indicador de la no extracción de solvente intermediario de los tejidos.
Cuarta etapa (Curado)
El curado del polímero se realiza según el método estándar alemán que consiste en la vaporización del endurecedor, también conocido como entrecruzador de cadenas o Biodur® S6, bajo cámara sellada, esta era inicialmente rudimentaria, constaba de un contenedor plástico de 0,255 m3 sellada herméticamente, un recipiente de vidrio de 100 ml y una bomba de pecera comercial. Actualmente, se emplea el modelo HH13A1.0 Biodur®, el cual cuenta con un ventilador, tres recipientes de vidrio de 500 ml y tres bombas de pecera que vaporizan el entrecruzador de cadenas por medio del burbujeo que se produce al inyectar aire.
Esta etapa se realizó encendiendo la cámara de curado previamente sellada de forma intermitente en ciclos de tres a cuatro horas, conservando las piezas en su interior y encendiendo el ventilador para ayudar a la circulación del entrecruzador hasta completar el curado superficial de la pieza. Posteriormente se almacenaron no menos de 30 días en bolsas herméticas con lo que se favorece el mismo proceso, esta vez del polímero al interior del espécimen3 (Tabla 2).
RESULTADOS
Desde el inicio del proyecto en el año 2002 y hasta el 2017 se han plastinado alrededor de 343 piezas anatómicas con la técnica UDEA y estándar alemana. Con esta última se realizaron 110 con muestras animales, de las cuales 95, que se iban a descartar, tienen más de 10 años por lo que se consideran históricas, 15 con potencial de exhibición. Las 233 restantes corresponden a piezas humanas, de aquellas 83 son históricas. Debido a que este material hace parte de los primeros ensayos, no se emplea ni para docencia ni para uso exhibición (Figura 2). De las 343 piezas antes mencionadas, 150 son clasificados como especímenes de alta calidad y de amplia utilidad docente, 4 de ellas mediante el método estándar alemán sin modificación alguna y 136 mediante la técnica UDEA; de estas últimas, 93 presentan a la fecha más de 12 meses de haber completado el proceso de plastinación y de encontrarse en disponibilidad para la docencia. Es de anotar que estas piezas posteriormente a haber completado el proceso no han presentado cambios diferentes a los producidos durante la aplicación de la técnica en cuanto al aspecto, la flexibilidad o la retracción (Figura 3, Figura 4 y Figura 5).
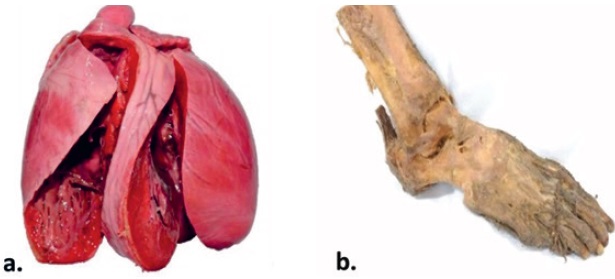
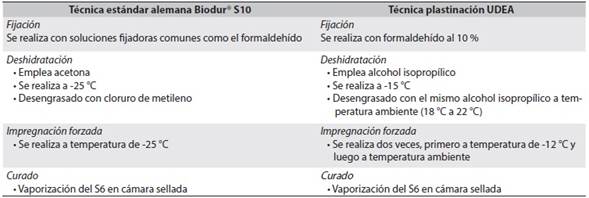
Figura 2 a) Corazón porcino teñido con pigmentos vegetales y plastinado mediante la técnica UDEA laboratorio de FM. b) Pie y mitad distal de pierna derecha humana deshidratada con alcohol isopropílico y plastinado mediante técnica estándar alemana laboratorio FM
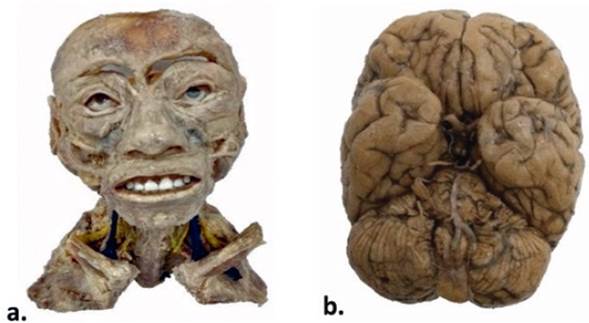
Figura 3 a) Cabeza humana plastinada mediante técnica UDEA laboratorio FM. b) Encéfalo humano mediante técnica UDEA
Figura 4 a) Bloque torácico y abdominal humano plastinado mediante técnica UDEA laboratorio FM. b) Corte toraco-abdominal humano plastinado mediante técnica UDEA laboratorio FM
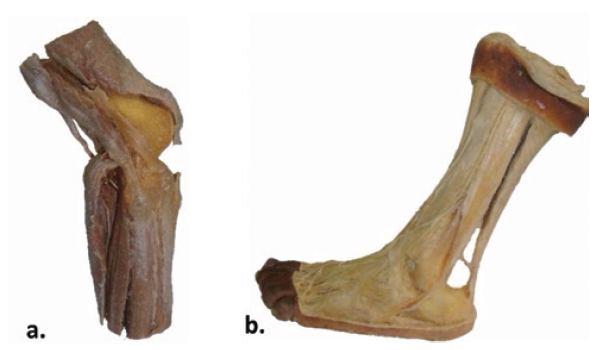
Figura 5 a) Rodilla humana plastinada mediante técnica UDEA laboratorio FM. b) Pierna y pie izquierdo humano plastinado mediante técnica UDEA Laboratorio FM
El resultado no favorable de la técnica de plastinación UDEA es la disminución de la vida útil de la mezcla de la silicona Biodur® S10:S3, pues esta al ser expuesta a temperatura ambiente acelera la reacción de elongación de cadena produciendo el aumento de la viscosidad del polímero, siendo posible realizar la impregnación bajo estas condiciones solo dos a tres veces3; este aumento de la viscosidad impide realizar satisfactoriamente la impregnación forzada.
DISCUSIÓN
El Laboratorio de plastinación de la FM de la UDEA es un proyecto aún en desarrollo, dado que a la fecha no todas las piezas anatómicas conservadas en soluciones tradicionales han pasado por este proceso. Es de destacar que a lo largo de los años se ha logrado superar diversos obstáculos, entre otros, adaptar el método estándar alemán a las condiciones propias de laboratorio UDEA, lo que permitió prolongar la vida útil de valiosas piezas anatómicas de carácter único, mediante una conservación seca, inodora, de aspecto similar al natural, duraderas, libres de riesgo biológico y con alta calidad docente, cumpliendo de esta forma con las premisas iniciales sobre la plastinación del Dr. Gunther Von Hagens3,6,7.
Es innegable la existencia de otros laboratorios que han adaptado la técnica estándar alemana, realizando modificaciones en diferentes etapas del proceso38,39, incluso han efectuado ajustes en la plastinación que involucran el reemplazo de los reactivos desarrollados para este fin por genéricos o de otras industrias19,20,40.
Aunque las adaptaciones realizadas por diferentes laboratorios, incluyendo el de la FM de la UDEA, han logrado cumplir con las premisas mencionadas en el anterior párrafo y si bien el Dr. Gunther Von Hagens describió la técnica estándar y los principios generales de la plastinación3,4,6,7, estas son consideradas complejas para la conservación de material biológico, pero a la vez versátiles y susceptible de adaptación a condiciones particulares.
El resultado no favorable respecto a la disminución de la vida útil de los polímeros, a diferencia de lo que relata en el método estándar alemán que puede ser reutilizado indefinidamente debido a su conservación en frío3, ha implicado en nuestro laboratorio reemplazara el usado o su dilución con nueva mezcla de la silicona Biodur® S10:S3 que aún conserve baja viscosidad. De esta forma es importante aclarar que la técnica de plastinación UDEA ha aumentado la cantidad de estos elementos empleados frente a la técnica original. Esto contrasta con la disminución de costos lograda al cambiar la acetona por alcohol isopropílico. Pese a lo anterior, la técnica de plastinación UDEA, aunque aumenta el consumo de polímeros, sigue presentando una relación costo/beneficio favorable pues disminuye los costos respecto a la aplicación de la técnica estándar alemana en nuestro medio.
Cabe señalar que otro de los beneficios que ha representado el desarrollo de la técnica en la UDEA ha sido la disminución del uso en las actividades académicas, de piezas anatómicas cadavéricas conservadas mediante métodos tradicionales a base de formaldehído, puesto que generaba riesgos de salud en estudiantes, docentes, técnicos y personal de apoyo, por la producción de vapores relacionado a la irritación ocular y en vías aéreas altas y bajas generando tos, mareos, cefaleas, además de estar directamente asociado con diferentes tipos de cáncer30,31,41.
Actualmente estas muestras se utilizan en prácticas anatómicas con estudiantes de pregrado de medicina, enfermería, instrumentación quirúrgica, nutrición y dietética, bioingeniería y química farmacéutica; para programas de especializaciones médicas como ortopedia, otorrinolaringología, neurología, neurocirugía, cirugía general, ginecología, obstetricia, urología, entre otras. De igual manera, se emplean en cursos formativos de pregrado que son desarrollados por la UDEA en centros de enseñanza extramurales o de pequeñas poblaciones en donde no cuentan con la infraestructura en conservación de piezas anatómicas en soluciones tradicionales. También se han empleado en diversas exposiciones en museos.
El uso de las piezas plastinadas constituye una herramienta útil para la reducción del riesgo biológico y químico en grupos no familiarizados con el área de la salud, permitiendo fortalecer diversos programas educativos tanto dentro como fuera de las instalaciones de la Universidad.
Con el pasar de los años se ha incrementado la necesidad de capacitar profesionales del área de la salud y la tanatopraxia, tanto de la UDEA como externos en las diferentes técnicas de plastinación y complementarias. Razones que motivaron a la institución a desarrollar programas académicos para suplir dicha necesidad.
Desde el primer semestre del año 2015 el Laboratorio de Plastinación de la FM de la UDEA ofrece la “Diplomatura de formación especializada en Plastinación y otras Técnicas Anatómicas”, en esta se encuentran las técnicas de repleción vascular, tinción ósea, diafanización de tejidos blandos, restauración de muestras anatómicas deterioradas, además de aclaramiento y tinción de tejidos blandos, siendo las anteriores técnicas complementarias a la plastinación.
A la fecha se han realizado cinco versiones de esta diplomatura con participantes de, Bogotá, Cali, Manizales, y países como Chile, México, Perú, Ecuador, Argentina, El Salvador y Honduras, lo que la hace un referente nacional e internacional. La técnica de plastinación UDEA se ha implementado en el laboratorio de la Facultad de Ciencias Agrarias, y en otras universidades como la de los Andes en Bogotá-Colombia, en Perú en el Centro Nacional de Plastinación de la Universidad Nacional de San Antonio Abad y en la Universidad Andina, ambas ubicadas en Cusco.