INTRODUCCIÓN
El aumento de la incidencia de los diversos tipos de cáncer (Ca), lleva a la búsqueda de mejores tratamientos que extiendan la supervivencia global (SG) y/o mejoren la calidad de vida relacionada con la salud (CVRS)1-5.
La SG a 5 años de las personas con tumores malignos ha mejorado en los Estados Unidos (EU) en los últimos cuarenta años (pasó del 49 % al 68 %), sin que se tenga clara la causa6 y algunos la asocien con el uso de medicamentos anti-Ca7.
Un meta-análisis de ensayos clínicos con asignación aleatoria (ECA), evaluó la contribución de la quimioterapia en la SG a 5 años para tumores malignos sólidos, encontrando aumento para Ca de testículo (40 %), enfermedad de Hodking (37 %), Ca de cérvix (12,0 %), linfomas (10,5 %) y Ca de ovario (8,8 %), los cuales explican menos del 10 % del total de tumores malignos; para el restante 90 %, donde se incluyen Ca de seno, de colón, de pulmón y de próstata, el aumento en la SG fue menor r (<2,5 %), equivalente a 3 meses7,8.
Entre 2002-2014 la Food and Drug Administration (FDA) aprobó 48 tratamientos anti-Ca, los cuales aumentaron la SG a 5 años en una mediana de 2,1 meses9; mientras la European Medicines Agency (EMA) aprobó 14 tratamientos, con incremento de la SG en una mediana de 1,2 meses7,10. Actualmente para incrementar la SG, se le da mayor importancia al diagnóstico precoz y al inicio temprano del tratamiento11,12.
La mayoría de los tratamientos anti-Ca tienen precios altos, muchos de ellos ofrecen poca mejoría en la disminución de la mortalidad o en la percepción de CVRS y en general pueden producir problemas serios de seguridad13,14. Entre 1975-1979, la mediana del costo mensual para los nuevos medicamentos fue de 120 dólares, mientras para 2010-2014 alcanzó los diez mil dólares, representando un crecimiento exponencial del precio.
Por lo anterior, se realizó una revisión narrativa para evidenciar la forma en que se realizan los estudios de eficacia de la quimioterapia para Ca y los métodos usados por los entes reguladores para aprobar dichas terapias.
METODOLOGÍA
Se realizó una revisión narrativa con la formulación de unas preguntas guías para desarrollar el contenido. La búsqueda se hizo en Pubmed con las palabras clave: “oncology end points”, “cancer”, “approval oncology drugs”, “approval anticancer drugs”, “oncology clinical research”. Se incluyeron artículos que abordaron los temas propuestos, publicados en inglés o español y disponibles en texto completo; no se hizo restricción por sitio, ni año de publicación. Por el tipo de revisión, no se cuantificó la cantidad de artículos recuperados.
¿CUÁLES DESENLACES SE USAN PARA EVALUAR LA EFICACIA DE LOS TRATAMIENTOS ANTI-CA?
Los estudios de eficacia de los medicamentos anti-Ca usan los siguientes desenlaces: de beneficio clínico para los pacientes, de evaluación del tumor y emergentes2,15,16.
Desenlaces de beneficio clínico para pacientes (DBCP)
Supervivencia Global: es el tiempo desde la asignación al azar de los tratamientos, hasta la muerte por cualquier causa. Se debe evaluar en ECA con análisis por intención de tratar3,17. Se considera como el DBCP más importante al ser preciso, fácil de medir y generalmente libre de sesgos1,2,4,15,16. No debe evaluarse con controles históricos, por los posibles sesgos de selección e información ante la posibilidad de que los pacientes más recientemente tratados hayan estado expuestos a mejores técnicas de imagen y menores cuidados de soporte2,17. La SG puede ser engañosa en los estudios de tamización de Ca debido a que en los cánceres detectatos con esa estrategia se adiciona el tiempo de evolución preclínico que de otra manera no se contaría ni se conocería, y al compararlos con los casos con diagnóstico por manifesticiones clínicas dan la falsa sensación de que los primeros sobrevivieron más tiempo, sin que eso sea un efecto real del tratamiento. Se sabe que algunos Ca nunca progresarán o incluso regresarán18.
La SG tiene dificultades como desenlace primario por los seguimientos largos en los estudios, volviendo impráctico su uso en pacientes con tumores malignos de buen pronóstico2,15,17,19. Además, para evaluarla se requieren muestras grandes y potentes que permitan encontrar diferencias clínicamente significativas4,17. Por último, los pacientes con Ca pueden recibir co-intervenciones que confundan los análisis de supervivencia2,15,16,18.
Tiempo hasta progresión de síntomas derivados del Ca: es el tiempo desde la asignación al azar de las intervenciones, hasta la reaparición de los síntomas derivados del Ca. En pacientes con tumores asintomáticos, se mide el tiempo hasta la aparición del primer síntoma2.
Este desenlace está sujeto a sesgos como la falta de cegamiento, los tratamientos previos, la frecuencia de evaluación de los participantes, el retraso entre la progresión del tumor y la aparición de síntomas, la selección de los pacientes y la dificultad para diferenciar entre síntomas asociados al Ca y la toxicidad del tratamiento2)(4.
Calidad de vida relacionada con la salud: es importante para evaluar la eficacia de los tratamientos anti-Ca, especialmente cuando la mejoría en la SG es marginal2,20. Tiene dificultades para usarse como desenlace en la aprobación de medicamentos antiCa, porque generalmente indica menos toxicidad del medicamento y no más efectividad. Los instrumentos de medición no están adecuadamente validados y se desconoce la diferencia clínicamente significativa2,4,17,20.
Desenlaces basados en el tumor: tienen limitaciones como las dificultades para evaluar el tamaño del tumor y su evolución producto del tratamiento; en algunos Ca (mesotelioma maligno, páncreas, tumores cerebrales), la medición del tumor es imprecisa por la pobre delimitación de las márgenes. Estos desenlaces se deben verificar en las investigaciones por revisores cegados a las intervenciones2.
Supervivencia Libre de Enfermedad (SLE): es el tiempo entre la asignación al azar de los tratamientos, hasta la recurrencia del tumor o muerte por cualquier causa. Se requiere que la intervención no deje signos remanentes del tumor. Su mayor relevancia se da en estudios que evalúan tratamientos adyuvantes luego de recurrencias sintomáticas, en uso de radioterapia o cirugía definitivas, cuando existe una proporción alta de pacientes con respuesta completa a la quimioterapia y en SG prolongada2,15,17. La SLE puede ser un desenlace de beneficio clínico, especialmente cuando la magnitud del beneficio pesa más que la toxicidad del tratamiento adyuvante2.
Frecuencia de Respuesta Objetiva (FRO)2,15,17: se define como la proporción de pacientes con reducción del tumor en una cantidad predefinida en un periodo de tiempo. Refleja la actividad anti-tumoral del tratamiento, mediante respuesta parcial (reducción del tamaño hasta 50 %) o respuesta completa (sin evidencia del tumor al menos por un mes)2,17. La significancia de este desenlace es determinada por la magnitud, duración y porcentaje de pacientes con respuesta completa2. El mayor uso de la FRO es en aprobación acelerada (AA) de medicamentos para pacientes con Ca refractario sin terapia existente, en estudios sin grupo control17. Está sujeto a sesgos de información, derivados de la frecuencia de evaluación de los pacientes y la tecnología con que se evalúa la respuesta del tumor15.
Tiempo hasta progresión (THP): es el tiempo entre la asignación al azar de las intervenciones y la progresión objetiva del tumor. No incluye las muertes, porque se aplica una estrategia estadística, la censura, que considera que ellas ocurren con un patrón no aleatorio de pérdida del estudio. Se acepta como desenlace cuando la mayoría de las muertes no se relacionan con el tumor, cuando se espera un periodo largo entre la progresión de la enfermedad y la muerte, y cuando se evalúan citostáticos porque estos no requieren reducción del tamaño del tumor para probar su eficacia2,15,17.
Supervivencia Libre de Progresión (SLP): es el tiempo que transcurre entre la asignación aleatoria a los tratamientos hasta la progresión objetiva del tumor (crecimiento >25 %) o muerte por cualquier causa. Este desenlace es difícil de evaluar por las dificultades que se tienen para definir progresión, al no contar con un estándar en imagenología para hacerlo (tipo de tecnología, frecuencia de las evaluaciones e intervalos entre estas), situación más problemática para lesiones malignas no medibles como son los cánceres sanguíneos y de las pleuras; además, se puede comportar con un patrón no aleatorio de pérdida del estudio y se asume que las muertes se relacionan aleatoriamente con la progresión del tumor2,15,17.
La SLP es superior al THP como variable de desenlace al incluir la muerte por cualquier causa y no sesgar su resultado con terapias subsecuentes. Algunos promueven que tiene mejor relación sub-rogada con la SG, aseveración no validada en la mayoría de los tumores malignos (excepto en los cánceres de ovario y de colon). La deben evaluar personas independientes a los investigadores para evitar sesgos1,2,17,18,21,22.
La SLP es útil cuando la SG luego de la progresión del tumor es corta o las muertes se relacionan al Ca17,20; además, se usa al considerar la progresión como una marca hacia la muerte. Está sujeto a sesgos de información, derivados de la frecuencia de las evaluaciones que se realizan a los pacientes y a los criterios para realizarlas en cada investigación23.
Tiempo hasta Falla del Tratamiento (TFT): se conoce como el tiempo entre la asignación aleatoria a los tratamientos hasta la descontinuación del mismo por progresión del tumor, aparición de toxicidad, preferencia del paciente o muerte. No se recomienda como desenlace para aprobar medicamentos anti-Ca, al no diferenciar entre toxicidad del tratamiento y la progresión de la enfermedad2,15,17.
Duración de la respuesta: se define como tiempo entre la documentación de la respuesta al tratamiento (completa o parcial) y la progresión del Ca. Algunos la recomiendan como sub-rogado de CVRS y SG, en estudios de pacientes con Ca refractario al tratamiento, aunque no existe suficiente evidencia que lo avale. Este desenlace puede tener sesgos de información por la frecuencia del seguimiento a los pacientes y la tecnología para evaluar la respuesta al tratamiento15,17.
Desenlaces emergentes
Respuesta Inmune Relacionada al Tumor (RIRT): incluye el concepto “carga tumoral general”, al involucrar el índice de la combinación del tamaño de las lesiones iniciales más las nuevas lesiones detectadas luego de inicio del tratamiento. Se compone de cuatro tipos de respuesta inmune: completa, parcial, en enfermedad estable y en enfermedad progresiva15,24,25.
Enfermedad Residual Mínima (ERM): es una estrategia nueva para detectar trazas de tumores malignos sanguíneos no detectadas con pruebas de laboratorio convencionales, mediante tecnologías altamente sensibles. La FDA propone la ERM como predictor de SLE y afirma que se correlaciona con la SG15.
Los desenlaces RIRT y ERM, no se proponen como objetivos primarios en ECA diseñados para evaluar la eficacia de tratamientos anti-Ca15.
¿CÓMO SE APRUEBAN LOS MEDICAMENTOS ANTI-CA?
Desde 1902 la Public Health Service Act exigía para aprobar productos biológicos (vacunas, sueros, toxinas y anti-toxinas), que estos fueran seguros, puros y potentes, soportados en estudios con desenlaces clínicos importantes2,17. A partir de 1962, la Federal Food, Drug and Cosmetic Act en los E.U exigió para aprobar un medicamento, evidencia sobre su efectividad, derivada de investigaciones clínicas adecuadas bien controladas2,17,26.
La FDA ha utilizado diferentes desenlaces para aprobar los medicamentos anti-Ca, así: en los años setenta con estudios que evaluaron la Frecuencia de Respuesta Objetiva (FRO); en la década de los ochenta exigieron evidencia directa del DBCP (SG, CVRS, funcionamiento físico y síntomas relacionados al tumor); y en el último decenio del siglo veinte agregaron variables sub-rogadas del DBCP (Supervivencia Libre de Enfermedad, Respuesta Completa Durable)17, lo que llevó a un mayor uso de desenlaces relacionados con el tiempo hasta el evento (período 1990-99: 13,2 %; quinquenio 2006-11: 43,4 %), y la SG se usó con menor frecuencia (pasó del 30,2 % al 14,5 % en los mismos períodos)15.
En 1992 la FDA instauró la aprobación acelerada (AA) para dar respuesta a la necesidad de aprobar tratamientos para pacientes con enfermedades graves que amenazaran la vida17,27. Para aprobar el medicamento, este debía ser superior a la terapia disponible u ofrecer una alternativa de intervención cuando esta no existiese17. Las AA generalmente se basan en estudios con desenlaces sub-rogados asociados a DBCP y se deben presentar evidencias posteriores que prueben la eficacia para las indicaciones avaladas2,21,27. Si no se muestran beneficios clínicos en investigaciones pos-aprobación, se debe retirar el medicamento del mercado2,19. En 2006 se propuso que los análisis interinos de ECA fase III, sirvieran para realizar la AA de tratamientos anti-Ca27.
La FDA para aprobar un medicamento anti-Ca exige al menos dos estudios clínicos adecuados bien controlados. Aceptan uno solo, cuando una nueva investigación es “imposible” de realizar, desde lo práctico o lo ético y se tiene un trabajo multi-céntrico con un DBCP altamente confiable, estadísticamente significativo2,17.
En Europa la entidad encargada de la aprobación de los medicamentos anti-Ca es la EMA, tarea que realiza desde 2005 y cuyo procedimiento difiere del que realiza la FDA en los detalles técnicos, uno de los cuales es el menor uso de mecanismos de aprobación rápida y la exigencia de datos más robustos, lo que hace que el tiempo para acceder a nuevos productos anti-Ca sea más largo28-31.
Las agencias que aprueban los medicamentos antiCa, realizan análisis riesgo/beneficio evaluando la toxicidad (gravedad, duración, reversibilidad y la proporción de pacientes que la padecen); evalúan las características de la terapia disponible y la refractariedad de la enfermedad al tratamiento. Cuando encuentran beneficio marginal para los pacientes con un fármaco, consultan la opinión de expertos para tomar la decisión final32.
¿QUÉ CARACTERÍSTICAS TIENEN LOS ESTUDIOS CON LOS CUALES APROBARON MEDICAMENTOS ANTI-CA?
Entre 1990-2002 la FDA aprobó 71 aplicaciones de medicamentos anti-Ca, el 80,3 % mediante aprobación regular (AR) y el 31,6 % de las investigaciones utilizaron como desenlace la SG; el 19,7 % de las aplicaciones recibieron AA, sin incluir la SG como desenlace, mientras la FRO la reportaron dos terceras partes de las investigaciones33.
En el período 2005-2007, la FDA aprobó 53 indicaciones de medicamentos anti-Ca y trastornos hematológicos; la AA la emplearon en 17,0 % de estas y el desenlace más usado fue la FRO (66,7 %). La AR la utilizaron para el 83,1 % de las indicaciones: 22,7 % tuvieron como desenlace la SG, 22,7 % la FRO, 25 % la SLP o THP, 9,1 % la SLE, 6,8 % la SG más SLP y 22,7 % otros desenlaces; las AR se basaron en un estudio para cada indicación, el 30,2 % se valieron de estudios sin comparación y el 69,8 % en ECA32.
Entre 2005-2012, la FDA aprobó 41 indicaciones antiCa; el 84 % con estudios que incluyeron desenlaces sub-rogados. Para 2014-2015 aprobaron 17 indicaciones, 94,1 % de ellas evaluaron desenlaces sin beneficio clínico directo (FRO y SLP)34.
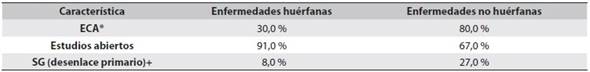
La EMA entre 1995-2004 se basó en 48 estudios para aprobar medicamentos anti-Ca (52,1 % ECA); los desenlaces primarios fueron: SG (8,3 %), FRO (62,5 %) y THP/SLP (29,2 %). Hallaron, además, un aumento de la SG así: media de 1,5 meses, mediana de 1,2 meses y rango 0-3,7 meses. Solo 5 de las indicaciones aprobadas tuvieron en cuenta al menos dos ECA10. Entre 2009-2013 esta misma agencia aprobó 48 medicamentos anti-Ca para 68 indicaciones, de las cuales 58 recibieron AR y en 10 la autorización fue condicional; 88 % de las aprobaciones las soportaron por al menos un ECA. Como desenlace primario, el 26,4 % de las investigaciones usaron la SG y ninguno involucró la CVRS. Los estudios restantes emplearon desenlaces subrogados (SLP 46 %, FRO 16 %, SLE 6 %); el aumento de la SG lo documentó en el 35 % de las indicaciones con una mediana de 2,7 meses (rango 1 a 5,8). De las 44 indicaciones que no mostraron beneficio en la SG en el momento de la aprobación, luego de un seguimiento hasta de 8 años, solo el 7 % mostró extensión de la vida y el 11 % mejoró la CVRS; ninguna de las que recibió aprobación condicional produjo mejorías en estos desenlaces5 (Tabla 1)35, (Tabla 2)36.
Tabla 1 Características de los estudios clínicos para evaluar medicamentos oncológicos vs. otras especialidades médicas - Clinical Trials (2007-2010)

*ECA: ensayo clínico con asignación al azar
¿EXISTEN CUESTIONAMIENTOS ÉTICOS A LOS TRATAMIENTOS ANTI-CA?
Muchos de los tratamientos farmacológicos anti-Ca reciben cuestionamientos éticos por los limitados beneficios para las personas que los reciben y la baja conciencia que tienen los pacientes de este hecho4,7,11. Además, la alta relación costo/beneficio de estas terapias, en muchos casos, no justifica su uso y se duda de la validez de la eficacia derivada de las investigaciones con medicamentos anti-Ca, debido a que solo el 3 % de las personas con Ca participan en los estudios para probar su eficacia11; es difícil extrapolar los resultados del 3 % de los pacientes al 97 % restante, debido a que estos últimos recibirán intervenciones con equipos, procedimientos e instalaciones diferentes a las usadas en las investigaciones3,37. La mitad de estos pacientes cree que dicha intervención es su única opción, lo que se puede convertir en una presión no ética hacia ellos38. De otro lado, la SG es un desenlace que las personas consideran importante y lo entienden con facilidad, pero la mayoría de las investigaciones usan desenlaces primarios sub-rogados difíciles de entender que no ofrecen beneficio clínico37.
¿POR QUÉ SE USAN LOS DESENLACES SUB-ROGADOS EN LOS ESTUDIOS PARA MEDICAMENTOS ANTI-CÁNCER?
Los sub-rogados son variables que se encuentran dentro del proceso que lleva a la aparición de un DBCP y no representan beneficio clínico directo. Se usan cuando los desenlaces críticos e importantes son raros o se presentan a largo plazo5,39. Otras razones para usar estos desenlaces son: 1) las terapias que reciben los pacientes antes y después de los estudios, lo que dificulta evaluar el efecto clínico de la intervención; 2) la posible alteración de la SG al cruzar los pacientes a nuevas terapias luego de las investigaciones, cuando se encuentra una adecuada eficacia de estas21; 3) la historia natural de algunos Ca muestra una SG larga, explicada por efecto del diagnóstico y el tratamiento tempranos, lo que obligaría a realizar investigaciones de larga duración con muestras grandes, lo que dificulta su realización39 y; 4) el uso de desenlaces sustitutos, acorta la duración de las investigaciones y el tiempo de aprobación de los medicamentos7,14.
La FDA entre 2009-2014 aprobó 55 indicaciones (25 AA y 30 AR) de medicamentos anti-Ca basada en desenlaces sub-rogados, de las cuales, posteriormente el 18,2 % mostraron beneficio sobre la SG, el 27,3 % no mostraron mejoría de ésta y en el 54,5 % dicho beneficio permaneció desconocido. Cuando usaron la AA, una de cada cuatro aprobaciones benefició a la SG; con la AR el aumento de la SG se documentó en una de cada diez aprobaciones; no mostraron beneficio el 12,0 % de los medicamentos con AA y el 40,0 % con AR22.
De los medicamentos que recibieron AA en 2010, no fue completa la aprobación en el 45 %, debido a que los estudios post-mercadeo no confirmaron el beneficio clínico inicial o los investigadores no entregaron los resultados en los plazos establecidos40.
¿EXISTEN PRESIONES PARA APROBAR LOS MEDICAMENTOS ANTI-CA?
En 2012 la FDA introdujo la categoría “breakthrough” para aprobar medicamentos anti-CA con resultados “muy buenos” en los estudios iniciales y la EMA cuenta con mecanismos de aprobación expedita, incrementando el riesgo de aprobar prematuramente intervenciones con evidencia limitada26,28; esto facilitó la presión para la aprobación de tratamientos anti-Ca, mediante el “lobby” que hacen grupos “protectores de pacientes”, generalmente patrocinados por la industria farmacéutica, con anuncios sugestivos como: “la droga que está cambiando el juego”, “el medicamento revolucionario”, “el tratamiento milagroso” o “la droga innovadora”7.
¿EXISTE LUCRO POR LA APROBACIÓN DE MEDICAMENTOS ANTI-CÁNCER?
Los tratamientos anti-Ca tienen un alto costo, situación que viola los principios éticos, justicia y equidad; al promover terapias con pocos beneficios clínicos, se pueden negar recursos que permitan implementar en forma temprana estrategias diagnósticas y de intervención para las neoplasias malignas7,13,14.
Los tratamientos anti-Ca pueden beneficiar a algunos pacientes y lucra económicamente a los gobiernos y multinacionales farmacéuticas. En 2015 en E.U se vendieron 50 billones de dólares en medicamentos anti-Ca; el gobierno recibió 3,8 billones de dólares en impuestos (30-35 % sobre el margen de ganancia del 22 % de los laboratorios)7. Estos costos afectan la economía de los pacientes y sus familias4,41. Además, a pesar del imbalance riesgo/beneficio de estos tratamientos, en muchos casos el personal de salud no solicita consentimiento informado a los pacientes para suministrárselos4,7.
Los pacientes en general son poco conscientes de los reales beneficios del tratamiento anti-Ca: tres cuartas partes de ellos los sobreestiman y solo 30 % reconocen que hablaron con su médico sobre el efecto de la intervención sobre la SG42,43.
La incidencia de eventos adversos (EA) con tratamientos anti-Ca es hasta del 80 %, los EA graves afectan a 6 de cada 10 pacientes y pueden producir la muerte, especialmente durante el primer mes de intervención44,45.
Una gran proporción de personas con Ca desean terminar sus vidas rodeadas de su familia en su hogar, sin ser conscientes que los tratamientos con medicamentos anti-Ca aumentan el riesgo de muerte en ambientes hospitalarios46,47.
¿CÓMO MEJORAR LA INVESTIGACIÓN CLÍNICA DE LOS TRATAMIENTOS ANTI-CA?
Para mejorar la calidad de las investigaciones de eficacia de los medicamentos anti-Ca, la American Society Clinical Oncology (ASCO) convocó a cuatro grupos de investigación en Ca, para proponer investigaciones con DBCP y acordar las diferencias clínicamente significativas para dichas variables4.
Para personas con Ca páncreas, con una mediana de SG entre 10-11 meses, propusieron como mejoría clínicamente significativa, aumentar esta supervivencia entre 4-5 meses, HR 0,67-0,69 y una frecuencia de supervivencia a un año que pase del 48 % al 63 %; para personas con Ca pulmón (células no escamosas), la mediana de SG es cercana a 13 meses, propusieron un incremento clínicamente significativo de 3-4 meses, HR 0,76-0,80 y un mejoramiento en la supervivencia a un año que pase del 35 % al 50 %; para pacientes con Ca seno sin metástasis con mediana de SG de 18 meses, establecieron como incremento clínicamente significativo de 4,5-6,0 meses, HR 0,75-0,80 y que la supervivencia a un año pase del 63 % al 71 %. Para quienes padecen Ca colon que progresa a pesar de tratamientos previos o no candidato para una segunda o tercera línea de intervención, en quienes la SG está entre 4-6 meses, propusieron mejorarla entre 3-5 meses, HR 0,67 y aumentar la supervivencia a un año del 25 % actual al 35 %4.
RECOMENDACIONES
El cuidado de los pacientes con Ca, requiere que estos se empoderen de su padecimiento y tratamiento, con información precisa e imparcial brindada por los profesionales de la salud; lo anterior se debe acompañar de intensificación de acciones de prevención y detección temprana del Ca, las cuales mejoran la SG y la percepción de CVRS.
Se recomienda aumentar el umbral de criterios de aprobación de los medicamentos anti-Ca, realizando ECA que evalúen DBCP específicos para cada enfermedad (SG y CVRS) y tener en cuenta balances riesgo/beneficio y costo/beneficio. Además, es importante que los estudios de eficacia se realicen mediante ECA, para evitar la aprobación de tratamientos sin beneficio clínico.
Evitar el “Síndrome del Camino Fácil”, el cual parece afectar la aprobación de los medicamentos anti-Ca, pues cerca del 90 % de estos tratamientos tienen alto riesgo de eventos adversos serios sin ventajas clínicas importantes48.