INTRODUCCIÓN
El cáncer de próstata es el segundo más común en hombres, el primero en Norteamérica, Europa y en algunas regiones de África, el cuarto más común en el mundo y poco frecuente en China y otros países asiáticos. En Colombia, la incidencia en el 2012 fue de 51,4/100.000 hombres, con 9.564 casos diagnosticados en Colombia, 233.159 en Estados Unidos y 1’094.916 en el mundo (30,4 casos/100.000 hombres). Para 2020, el Observatorio Mundial de Cáncer (Global Cancer Observatory, GCO) pronostica alrededor de 1’392.727 nuevos casos de cáncer de próstata alrededor del mundo y aproximadamente 385.560 muertes relacionadas1-3. Dada la alta incidencia de esta neoplasia y la incompleta efectividad terapéutica, es necesario encontrar nuevas alternativas de tratamiento, más eficientes y que disminuyan los efectos secundarios en el paciente. En este sentido, los ácidos grasos omega-3 y sus derivados eicosanoides, han demostrado propiedades antiinflamatorias que pueden reducir la carcinogénesis4,5. Para ilustrar, estudios epidemiológicos sugieren que las dietas ricas en ácidos grasos omega-3 como EPA y DHA reducen la incidencia de cáncer6-8, ya que sus derivados eicosanoides exhiben propiedades antiinflamatorias, al reducir la síntesis de prostaglandinas E2 derivadas de los ácidos grasos omega-6, que favorecen actividades proinflamatorias, carcinogénicas y promueven la angiogénesis4,5.
Otros mecanismos mediante los cuales los ácidos grasos omega-3 pueden inhibir la progresión de la carcinogénesis, incluyen regulación en la transducción de señales de regulación de la expresión génica, por ejemplo, disminución de la activación del factor de transcripción nuclear NF-kB de oncogenes ras, supresión de la expresión de p21ras y COX-2 (ciclooxigenasa-2). Estos efectos se ven reflejados en los cambios en el crecimiento y la diferenciación celular, alteración en el metabolismo de estrógenos, adhesión celular, modificación de la composición de los fosfolípidos de la membrana celular y la función de los receptores, entre otros. Larsson y Shin5 sugieren un mecanismo adicional, basado en el incremento o disminución en la producción de radicales libres y especies reactivas de oxígeno (ROS) generados por los ácidos grasos omega-3, especialmente el DHA, los cuales pueden inducir apoptosis5,8.
Algunos reportes en las líneas celulares de cáncer de próstata humana, PC-3 y DU-145, tratadas con los ácidos grasos LA, EPA y DHA aumentaron la proliferación de células tratadas con ácido LA y disminuyeron en 65 % la viabilidad de las células tratadas con ácidos omega-3, de manera dependiente de la dosis9. De forma similar, otros estudios relacionan altos consumos de ácidos omega-6 con la proliferación de tumores en modelo murino de xenoinjertos, establecido a partir de células de adenocarcinoma de próstata humano (LNCaP)10. Otros estudios, encontraron asociación entre la alta ingesta de ácidos omega-3 (ALA, EPA, DHA), omega-6 (LA y AA) y el riesgo de padecer cáncer de próstata avanzado. Sin embargo, el consumo solo de EPA y DHA podría reducir el riesgo de padecer el mismo cáncer, mientras que LA y AA no mostraron ninguna correlación11.
Existen pocos reportes sobre los efectos genotóxicos de los ácidos grasos omega, por ejemplo, se ha evidenciado el efecto genoprotector del ácido omega-3 EPA y ningún efecto significativo de los ácidos grasos omega-6 AA y omega-9 (OA) en células no tumorales12,13. Sin embargo, los resultados son variables en células tumorales tratadas con estos ácidos grasos, y se ha planteado que la inducción de apoptosis en células cancerosas puede ser desencadenada por el incremento en los niveles de ROS.
Teniendo en cuenta que el estrés oxidativo inducido por ROS es una de las principales causas de mutaciones y daños en el ADN, es necesario cuantificar el daño genético que los ácidos grasos omega-3 podrían causar en la célula tumoral, teniendo en cuenta que se consideran preventivos del desarrollo del cáncer y que sus derivados eicosanoides son reconocidos antiinflamatorios. De la misma manera, es muy importante, evaluar el daño en el ADN inducido por ácidos grasos omega-6 en células tumorales, ya que estos omega-6 son reconocidos proinflamatorios, promotores de cáncer. Basados en lo anterior, este estudio evaluó los potenciales efectos citotóxico, genotóxico y anticlonogénico de ácidos grasos omega-3, omega-6 y omega-9 en la línea celular PC-3 derivada de cáncer de próstata, con el fin de analizar sus efectos sobre la viabilidad celular a nivel de membrana celular, mitocondrial y la capacidad de formación de colonias después de un tratamiento con diferentes concentraciones de los ácidos omega en las células tumorales evaluadas.
METODOLOGÍA
Cultivos celulares
La línea celular tumoral de próstata PC-3 (ATTC®, CRL-1435™) fue cultivada en frascos T-25 con medio DMEM (Sigma), 5 % de suero bovino fetal (SBF, Eurobio), penicilina 100 U/mL y estreptomicina 100 µg/mL, e incubadas a 37 °C en atmósfera húmeda con 5 % de CO2 . El subcultivo para el mantenimiento de la línea celular PC-3 se realizó dos veces por semana antes de alcanzar el 80 % de confluencia. Las células fueron desprendidas del frasco de cultivo o del plato de 6, 24 o 96 pozos, usando 0,3-1 mL de Tripsina-EDTA 1X (Sigma) según el caso, e incubadas a 37 oC durante un minuto. Luego del desprendimiento celular, la tripsina fue inactivada con 0,5-1 mL de medio suplementado con SBF al 5 %.
Preparación de los ácidos grasos
Los ácidos grasos omega-3 (ALA, EPA, DHA), omega-6 (LA, AA) y omega-9 OA (Sigma) fueron disueltos en el solvente etanol para análisis (99,9 % J. Baker), y así preparar soluciones stock 10 mM, almacenadas a temperatura ambiente (20 °C). Las soluciones de trabajo se prepararon en PBS, una hora antes de su uso, con el fin de evaluar concentraciones finales de 25, 50, 100 y 150 µM de cada ácido graso. Las concentraciones evaluadas se escogieron basados en reportes previos de literatura en otras líneas celulares. Además, en este estudio se realizaron ensayos previos en la línea PC-3 con concentraciones <50 µM, las cuales no mostraron efecto significativo sobre la viabilidad relativa de las células.
Ensayo MTT
La viabilidad celular relativa se evaluó con algunas modificaciones del protocolo de Mosmann14. Las células PC-3 fueron sembradas en platos de 96 pozos a una densidad celular de 5x103 células/pozo en las condiciones antes descritas e incubadas durante 24 horas. Después de ese tiempo, los cultivos fueron tratados con los 6 ácidos grasos evaluados en concentraciones finales de 25, 50, 100 y 150 µM e incubados durante 48 horas a 37 °C en atmósfera húmeda con 5 % de CO2. Luego de este tiempo, se adicionaron 10 µL de MTT (5 mg/mL, Sigma) a cada pozo, se incubaron en oscuridad durante 3 horas y posteriormente, a cada pozo, se le adicionó 100 µL de isopropanol ácido (Tritón 10 %, HCl 37 % humeante). Las absorbancias fueron leídas a 570 nm en espectofotómetro Multiskan FC Microplate Photometer-Thermo Scientific y la viabilidad celular relativa al control no tratado (negativo), fue calculada de la relación entre la absorbancia de cada tratamiento y la del control con células no tratadas. A cada una de ellas, incluyendo la del control no tratado, se les restó la absorbancia del control blanco (medio sin células). Se realizaron los controles negativo, blanco, control solvente (etanol 1,5 %) y control positivo (Peróxido de Hidrógeno (H2 O2, 100 µM). Los experimentos fueron realizados por triplicado y en réplicas de tres pozos por cada tratamiento en cada plato.
Ensayo de exclusión de colorante con Azul de Tripano
Los experimentos se realizaron por triplicado basados en el protocolo de Strober15. Las células PC-3 se sembraron en platos de 24 pozos. En cada pozo, se adicionó 1 mL de medio y 5x104 de células con las mismas condiciones de cultivo ya descritas. Luego de 24 horas, las células fueron tratadas durante 48 horas con concentraciones finales de 25, 50, 100 y 150 µM de cada uno de los 6 ácidos grasos evaluados. Las células fueron desprendidas con 300 µL de Tripsina-EDTA 1X e incubadas a 37 °C por un minuto y la suspensión celular recolectada por centrifugación. Luego, a 10 µL de la suspensión se le adicionó 10 µL de Azul de Tripano (0,4 %) y se colocó 10 uL de la mezcla en una Cámara de Neubauer, donde se realizó conteo del número de células en 5 campos. Se hicieron los respectivos controles: negativo (células sin tratamiento), solvente (etanol 1,5 %) y positivo (H2 O2, 100 µM). La viabilidad celular relativa fue calculada como el porcentaje de células vivas sobre el total de células (vivas y muertas) por cada tratamiento y luego comparadas con el control negativo.
Electroforesis alcalina de células individuales (Ensayo cometa)
Los experimentos se realizaron por triplicados usando el protocolo de Tice, et al.16 con algunas modificaciones. Se incubaron durante 24 horas 5x104 células PC-3/pozo en platos de 24, en las condiciones de cultivo antes descritas. Luego, las células fueron tratadas por 48 horas con las siguientes concentraciones de ácidos: 150 µM (ácido omega-3 ALA y omega-9 OA); 100 µM (omega-3 DHA) y 50 µM (omega-3 EPA y omega-6 AA y LA). Estas concentraciones, fueron definidas a partir de los resultados de las pruebas de MTT o Azul de Tripano, en las cuales se encontró reducida (≤ 50 %). La viabilidad celular. Posterior al tratamiento, las células se desprendieron del pozo con 500 µL de Tripsina-EDTA 1X durante 1 minuto a 37 °C y fueron centrifugadas. Aproximadamente, 4x104 de las células de la suspensión, fueron mezcladas con 80 µL de agarosa de bajo punto de fusión (LMP 0,6 %, ~37 °C) y colocadas en portaobjetos, previamente preparados con agarosa de punto de fusión normal (NMP 1 %).
A cada portaobjetos, se le colocó cubreobjetos y se incubaron a 4 °C durante 15 minutos para solidificar la agarosa. Posteriormente, las células fueron incubadas durante 24 horas a 4 °C, con el buffer de lisis (2,5M NaCl, 0,1M Na2 EDTA, 10 mM Tris base, 1 % Nlauril sarcosinato de Sodio, 10 % DMSO y 1 % Triton X-100, ajustado a pH 10,0) y reincubadas por 20 minutos en buffer (NaOH 50 mM/EDTA 1 mM, pH 13) para desnaturalizar el ADN dentro de los núcleos. La electroforesis alcalina (pH=13) se corrió a 25 V y 300 mA durante 25 minutos. Los portaobjetos fueron lavados tres veces con buffer neutralizante (Tris 0,4 M, pH 7,4) durante 5 minutos. Los núcleos fueron coloreados con Bromuro de Etidio (0,01 mg/mL), luego, 50 núcleos/tratamiento fueron evaluados con objetivo 20X del microscopio de fluorescencia (Leica), cuantificados (% ADN en la cola del cometa), fotografiados con cámara digital Panasonic DMC-FP1 y analizados con el software CASP (Comet Assay Software Project).
Intercambio de cromátidas hermanas (ICHs)
El protocolo se realizó con algunas modificaciones al reportado por Perry and Wolff17 en experimentos por triplicado. Los cultivos exponenciales de células PC-3 fueron incubados en frascos de cultivo T-25 con BrdU (2 mg/mL, Sigma) durante 24 horas a 37 °C en atmósfera húmeda, 5 % de CO2 y protegidos de la luz, luego tratados con concentraciones obtenidas de la prueba de la viabilidad celular ≤ 50 %, de la siguiente manera: 50 μM de EPA, DHA y AA durante 24 horas y el respectivo control, no tratado. La coloración diferencial de las preparaciones cromosómicas se realizó sumergiéndolas durante 10 minutos en solución a 0,5 mg/ml de bis-Benzimide (Hoechst-33258, Sigma), sometidas a fotólisis en solución 2xSSC (pH 6,8) a 45 °C durante 25 minutos y coloreadas con solución de Giemsa (4 %, pH 6,8) durante 4 minutos. Finalmente, se calculó el índice mitótico (IM) y se clasificaron las metafases así: de primer ciclo (M1), segundo ciclo (M2) y luego, se contó el número de ICHs/metafase en las células M2, de segundo ciclo.
Ensayo de clonogenicidad
El protocolo empleado fue el reportado por Freshney18 con algunas modificaciones. Las células PC-3 se sembraron en platos de 24 pozos así: 4,5x104 células/pozo en 1 mL de medio DMEM suplementado con 5 % de SBF, además de las otras condiciones de cultivo ya descritas. A las 24 horas, las células fueron tratadas con diferentes concentraciones de ácidos grasos omega: 150 µM (ALA y OA), 50 µM (EPA, LA y AA) y 100 µM (DHA), posteriormente incubadas durante 48 horas a 37 °C y 5 % de CO2. Después del tratamiento, las células fueron resembradas en platos de 6 pozos así: 200-300 células/pozo/2,5 mL de medio DMEM con 5 % de SFB y luego incubadas durante 10 días. Después de ese tiempo, se contabilizó el número de colonias/pozo y se calculó la Eficiencia de clonogenicidad relativa (ECR) mediante la ecuación: ECR = (N° de células contadas en el tratamiento/N° de células contadas en el control no tratado) x 100 (1). Se realizaron los controles: negativo (células sin tratamiento), solvente (etanol 1,5 %) y control positivo (H2 O2, 300 µM).
Evaluación de viabilidad celular
Las evaluaciones del efecto de ácidos grasos omega 3, 6 y 9 sobre la viabilidad celular relativa al control no tratado mostraron resultados similares mediante las pruebas MTT y Azul de Tripano. Los resultados de los ácidos EPA y DHA obtenidos con MTT, disminuyeron significativamente < 30 % la viabilidad celular relativa al control no tratado, con las concentraciones más altas (100 y 150 µM) y de manera dependiente de la dosis. Por otro lado, los ácidos LA y AA redujeron (~50 %) la viabilidad relativa con la concentración 150 µM (Figura 1, A). En la prueba de Azul de Tripano, el ácido EPA (150 µM) afectó totalmente la viabilidad, causando muerte a las células PC-3, mientras que los ácidos DHA, LA y AA redujeron (< 10 %) significativamente la viabilidad celular relativa al control, con la concentración 150 µM. En ambos ensayos, el ALA también mostró disminución estadísticamente significativa a 70 %, y el OA no causó ningún efecto (Figura 1, B). Estos resultados fueron consistentes con los cambios morfológicos (células redondeadas y granulosas), y en algunos casos, la disminución del tamaño, visibles al microscopio, inducidos por las concentraciones 100 y 150 µM de los ácidos grasos omega-3: EPA, DHA, y omega-6: AA.
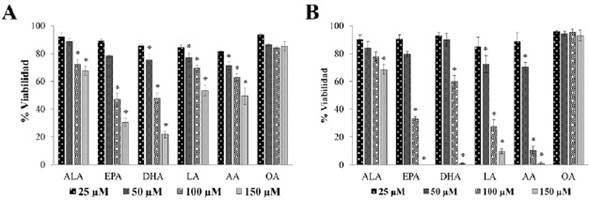
Figura 1 (A) Efecto sobre la viabilidad celular mediante MTT. (B) Efecto sobre la viabilidad celular mediante azul de tripano de células tumorales de próstata PC-3, tratadas durante 48 horas, con concentraciones de 25, 50, 100 y 150 μM de ácidos grasos omega-3 (ALA, EPA y DHA), omega-6 (LA, AA) y omega-9 (OA). Los datos se muestran como la media ± S.E. La significancia estadística se calculó con *p < 0,01, relativa al control no tratado (C-)
Considerando todos los resultados obtenidos mediante las pruebas de viabilidad, se puede concluir que los ácidos omega-3 (EPA y DHA) afectan más la viabilidad asociada a la integridad y permeabilidad de la membrana celular (detectada por el Azul de Tripano) que la actividad enzimática, capaz de reducir al compuesto formazán, la sal de tetrazolio (MTT).
Evaluación de efecto genotóxico
Los resultados de genotoxicidad obtenidos mediante el ensayo cometa, mostraron daño significativo en el ADN, causado por el tratamiento con ácido omega-3 EPA (50 µM), pero no se evidenció daño significativo en el ADN con los otros ácidos grasos evaluados (Figura 2, B). A pesar de que los ácidos omega-3 DHA y omega-6 AA no causaron daño genético significativo, se aprecia un incremento en el porcentaje de ADN en la cola del cometa, respecto al control negativo.
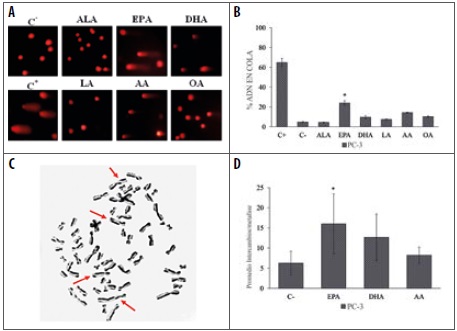
Figura 2 (A) Fotografías (20X) de cometas obtenidos en células PC-3 tratadas durante 48 horas, con ácidos grasos omega (ALA 150 μM, EPA 50 μM, DHA 100 μM, LA 50 μM, AA 50 μM y OA 150μM). (C-) células no tratadas; (C+) células tratadas con H2O2 (300 μM) durante 1h. (B) Cuantificación de daño genotóxico del ensayo cometa representado en (A). (C) Fotografía (100X) de metafase de segundo ciclo (M2) obtenidas de células PC-3 tratadas con EPA (50 μM). (D) Promedio de ICHs/metafase en células PC-3 tratadas con ácidos omega-3 (EPA y DHA, 50 μM) y omega-6 AA (50 μM). Los datos se muestran como la media ± S.E. La significancia estadística se realizó con *p < 0,01 comparada con el control no tratado (C-)
Las células de cáncer de próstata PC-3 tratadas con EPA, DHA y AA permitieron evaluar el número promedio de intercambios entre cromátidas hermanas en cada metafase analizada. Las células PC-3 tratadas con EPA (50 µM) mostraron incremento significativo (16,0 ± 5,5 ICHs/metafase) en el promedio de ICHs/ metafase, comparados con el control negativo (6,3 ± 1,9 ICHs/metafase) (Figura 2, D), consistente con los resultados de genotoxicidad observados en el test cometa alcalino. El promedio del número de ICHs encontrado en el tratamiento con EPA fue mayor (12,7 ± 4,8 y 8,5 ± 1,5 ICHs/metafase) que el obtenido con DHA y AA, respectivamente.
Evaluación del efecto sobre la clonogenicidad
En los experimentos de eficiencia de clonogenicidad, se realizaron controles negativo, solvente y positivo con H2 O2 (100 µM) durante una hora antes de la resiembra. El efecto sobre la capacidad de formar colonias fue analizado por la cuantificación de la eficiencia de clonogenicidad relativa (ECR) basados en el conteo del número de colonias formadas a partir de una sola célula PC-3, tratadas con los ácidos EPA (50 µM), DHA (100 µM) y AA (50 µM). Los resultados mostraron que estos tres ácidos omega disminuyeron el potencial clonogénico (ECR < 20 %) (Figura 3, C). De forma similar, los ácidos grasos ALA y OA disminuyeron (ECR < 25 %) la formación de colonias, mientras que el LA sólo la redujo (ECR < 40 %) en células PC-3 (Figura 3, C). Los resultados obtenidos del potencial clonogénico de las células PC-3 se correlacionan con la reducción significativa de la viabilidad celular relativa inducida por los ácidos EPA, DHA y AA, y el daño genético encontrado.
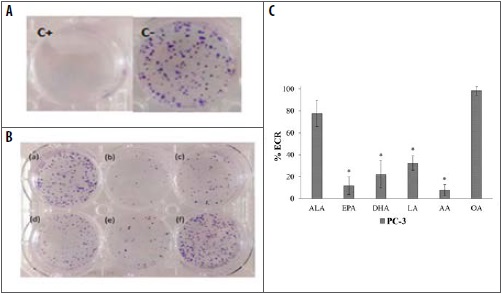
Figura 3 Efecto sobre la formación de colonias de células PC-3 tratadas con ácidos grasos omega. (A) Controles Negativo (C-) y Positivo (C+). (B) Colonias de células PC-3 tratadas con (a) ALA (150 μM), (b) EPA (50 μM), (c) DHA (100 μM), (d) LA (50 μM), (e) AA (50 μM) y (f) OA (150 μM), después de 10 días de incubación. (C) Valores de clonogenicidad relativa (ECR) respecto al control no tratado (C-) de células PC-3 tratadas con ácidos grasos omega. Los datos se muestran como la media ± S.E. La significancia estadística se calculó con *p < 0,001
DISCUSIÓN
Los resultados de la pruebas de actividad biológica de los ácidos grasos omega en la línea celular tumoral de próstata PC-3 mediante la prueba MTT, revelaron disminución significativa en la viabilidad relativa de las células PC-3, tratadas con los ácidos grasos omega-3 (EPA y DHA) y omega-6 (LA). De manera particular, la disminución de la viabilidad celular relativa, fue mayor en células tratadas con DHA, comparadas con las tratadas con el EPA. Todos los tratamientos mostraron efecto de los ácidos grasos omegas de manera dependiente de la dosis en la línea celular tumoral evaluada. Los resultados de la viabilidad relativa obtenida por MTT y Azul de Tripano (Figura 1) sugieren que los ácidos grasos omega-3 y omega-6 afectaron la membrana celular (Figura 1, B) y la actividad enzimática mitocondrial (Figura 1, A), lo cual podría depender de la composición de fosfolípidos y ácidos grasos poliinsaturados de la membrana celular, asociados a receptores de supervivencia y proliferación, similar a lo reportado, en diferentes tipos celulares tumorales19,20. Es muy posible que lo anterior explique por qué los tratamientos con los ácidos grasos omega evaluados, indujeron cambios en la morfología celular, como consecuencia de la pérdida de uniones célula-célula y célula-sustrato, sugiriendo defectos en las proteínas de adhesión celular y en el funcionamiento de algunos receptores de membrana.
Estructuralmente, los ácidos grasos omega-3, EPA y DHA, poseen mayor número de enlaces insaturados comparados con los omega-6 (AA y LA) y el omega-9 (OA). Esta particularidad, los hace más flexibles y les permite incorporarse fácilmente en la membrana celular. Se ha reportado que la incorporación de EPA y DHA en la membrana celular, induce desórdenes moleculares en la composición de los fosfolípidos de membranas, cambios físicos y químicos, islas lipídicas, expulsión de fosfolípidos formados por AA, causando cambios en la fluidez y permeabilidad de la membrana plasmática, y también afectando la morfología celular8,20,21. Estos reportes dan soporte a los resultados observados con EPA, DHA y AA, los cuales afectaron la viabilidad relativa de las células PC-3, detectadas por azul de tripano, hecho que podría estar asociado a un efecto sobre la integridad de la membrana celular, que es reflejado en los cambios morfológicos visualizados.
Por otro lado, los resultados obtenidos en las células PC-3 tratadas con los ácidos omega-6, sugieren que estos ácidos omega-6, podrían comportarse como inhibidores competitivos del ácido omega-3 presente en la membrana celular, y así disminuir su efecto antitumoral, similar a lo reportado en algunos estudios9,22,23. El efecto antitumoral de los ácidos grasos omega-3 como DHA y EPA se ha explicado por mecanismos como la inhibición de la síntesis o modificación de los eicosanoides proinflamatorios derivados del AA21,24, lo cual, también podría explicar los resultados obtenidos en los tratamientos con este ácido omega-6 en las células PC-3.
Adicional al gran número de enlaces insaturados del ácido graso DHA, la longitud de la cadena hidrocarbonada de este ácido omega-3 también podría facilitar su incorporación en los fosfolípidos de la membrana mitocondrial, contribuir al aumento de la oxidación lipídica y a la generación de ROS, causando disfunción mitocondrial8 por tanto, conducir posteriormente a apoptosis. Las dos características particulares del DHA mencionadas, podrían explicar la disminución de la viabilidad relativa de las células PC-3 encontradas en este estudio y permitirían sugerir, que los ácidos omega-3 EPA y omega-6 AA se comportan de manera similar. Además, otros estudios sugieren que los ácidos grasos omega-3 inhiben diferentes vías de señalización como AKT, mTOR y ERK por inducción de autofagia y apoptosis dependiente de caspasa-3, incremento de proteínas Bcl-2 y de ROS intracelular 8,19, lo cual podría evaluarse en estudios posteriores en las células PC-3.
La evaluación del efecto genotóxico en células tumorales de próstata PC-3, mostraron daño respecto al ADN mediante el ensayo cometa (Figura 2, B), y un incremento en el número de ICHs en las metafases analizadas (Figura 2, D), de células PC-3 tratadas principalmente con EPA. Estos resultados podrían sugerir que el ácido EPA podría incrementar las ROS intracelulares, lo mismo que la producción de radicales libres por reacciones de lipoperoxidación de los ácidos omega-3, que pueden inducir cambios en diferentes vías de señalización. Los resultados obtenidos en este estudio, son contrarios al efecto genoprotector del EPA reportado en células no tumorales, en las que EPA no induce daño en ADN y puede reducir el efecto mutagénico o genotóxico de algunas sustancias12,25.
Considerando estos reportes y los resultados obtenidos en este estudio, se puede sugerir que el ácido omega-3 EPA actúa de manera selectiva en células tumorales y no afecta significativamente las células no tumorales. Lo anterior, habría que corroborarlo en posteriores estudios con las células no tumorales, preferiblemente derivadas de próstata.
Como se mencionó, diversos estudios han evaluado la selectividad de los ácidos grasos omega en líneas celulares tumorales y no tumorales. Se ha evidenciado que los ácidos omega-3 no afectan o afectan poco la viabilidad de células normales. Esta respuesta diferencial de las células tumorales podría deberse a que estas células, se ha demostrado, son deficientes en ácidos grasos poliinsaturados omega-3 (EPA y DHA) y omega-6 (AA) comparadas con las células normales, posiblemente por la poca actividad de la enzima desaturasa involucrada en la conversión de estos ácidos. Esta situación, puede estimular la incorporación excesiva de dichos ácidos omega en la membrana celular de las células tumorales24,25 y, tal vez, sensibilizarlas al tratamiento antitumoral, incrementando las respuestas celulares inducidas por los ácidos omega o sus derivados eicosanoides o el de las ROS y radicales libres, causantes de daño en el ADN.
La disminución de la viabilidad relativa de las células PC-3 causadas por los ácidos omega (EPA, DHA y AA) evaluados en este estudio, pueden también ayudar a explicar la posible causa del daño genotóxico observado en el tratamiento, con omega-3 EPA principalmente, y por los demás ácidos. Los resultados obtenidos revelan que las diferencias en el daño producido por los ácidos grasos omegas EPA, DHA y AA, observado en las pruebas de viabilidad celular y genotoxicidad contribuyen en gran medida a la disminución de la capacidad de formación de colonias, lo cual podría reflejar la incapacidad de recuperar la homeostasis celular, causada por estos ácidos grasos omega con la disminución de su potencial proliferativo. Además, estarían de acuerdo con la disminución en el número de colonias y de la proliferación (≤ 20 %) de otra línea celular tumoral de próstata, LNCaP, tratadas con DHA (20 µM), lo cual fue reportado por Cavazos26. Estos resultados también son consistentes con otros estudios, que reportan que los ácidos omega-3 (EPA y DHA) pueden ser inductores de autofagia, apoptosis, y producción de ROS mitocondrial, además de inhibidores de la migración de células tumorales de próstata (PC-3, DU145 y LNCaP) y de mama (MCF-7 y MDA-MB-231)8,26-30.
Los resultados anteriormente descritos demuestran que estos ácidos grasos omega, de manera indirecta y a través de sus derivados eicosanoides, ROS o radicales libres, podrían causar daño al ADN a nivel de cadena sencilla, y posiblemente en la cadena doble, originando un intercambio recíproco entre las cromátides hermanas y reflejando mecanismos de reparación activos en las células tumorales de próstata PC-3. Estos resultados permiten plantear que, la inducción de daño en el ADN y la necesidad de reparación del material genético contribuirían a la disminución del potencial proliferativo de las células tratadas con EPA, DHA y AA, reflejado en la disminución de la formación de colonias, ya que estos tres ácidos omega, fueron también, los que mostraron más daño genotóxico.
En resumen, a pesar de que el ácido EPA causó efecto sobre la viabilidad celular a nivel de membrana (citotóxico), disminuyó la eficiencia de clonación relativa (ECR) (antiproliferativo) y causó efecto genotóxico (daño en el ADN), los mecanismos de sobrevivencia y reparación de ADN están activos, lo cual se puede evidenciar en la obtención de metafases de segundo ciclo obtenidas en la prueba de ICH, la cual requiere de al menos dos ciclos de proliferación celular, para la obtención de los extendidos cromosómicos.
Tomando todos los resultados en conjunto, se puede sugerir que el daño detectado a nivel de membrana celular, en la actividad enzimática de succinato deshidrogenasa mitocondrial y en el ADN, muestran su efecto a corto y a largo plazo en la disminución de la integridad celular de las células de próstata PC-3 tratadas con los ácidos omega evaluados. A corto plazo, probablemente estos ácidos omega, causan disminución de la viabilidad celular inmediatamente después del tratamiento y, a largo plazo, afectan la capacidad de formación de colonias, en las células sobrevivientes del tratamiento inicial.
En conclusión, este estudio reveló que los ácidos grasos omega-3 EPA, DHA y omega-6 AA reducen la viabilidad relativa de las células tumorales de próstata PC-3, de manera dependiente de la dosis, además, aumentan el efecto genotóxico y pueden disminuir la capacidad de reparación al daño y de la proliferación a largo plazo, comparados con los otros ácidos grasos omega evaluados. Para corroborar esta última hipótesis, se requieren estudios más detallados del ciclo celular y la inducción de apoptosis en esta línea celular, igualmente en células no tumorales, con el fin de dilucidar las potenciales diferencias entre las líneas celulares de diferente origen (normal o neoplásica) e intentar explicar los posibles mecanismos de acción.














