INTRODUCCIÓN
Las enfermedades autoinflamatorias se caracterizan por episodios recurrentes de inflamación en ausencia de células T autorreactivas y autoanticuerpos, están causadas por mutaciones en los genes que codifican proteínas involucradas en la respuesta inmune innata. Un prototipo de estas enfermedades es el síndrome periódico asociado al receptor del factor de necrosis tumoral (TRAPS), en el que se han descrito diferentes tipos de mutaciones en el gen que codifica al receptor del factor de necrosis tumoral alfa (TNF-alfa), igualmente en otros procesos celulares como el mal plegamiento de las proteínas, el estrés oxidativo y la disfunción mitocondrial1,2.
Los criterios diagnósticos de la enfermedad son episodios recurrentes que duran más de 5 días con manifestaciones de 2 a 9 meses, en los que aparecen síntomas inflamatorios como fiebre, dolor en las extremidades, eritema macular migratorio, mialgias, artralgias o sinovitis monoarticular, dolor abdominal, dolor en el pecho, conjuntivitis y edema periorbitario; puede haber varios miembros afectados de una misma familia. El diagnóstico requiere el análisis genético y su pronóstico está determinado por el desarrollo de amiloidosis secundaria a los episodios inflamatorios repetidos3.
Se presenta una revisión narrativa de la literatura, cuya estrategia uso combinaciones de términos MESH tanto en búsqueda libre como avanzada, en las bases de datos PubMed y Science Direct. No se incluyó literatura gris.
Aspectos del TNF-alfa y sus receptores transmembrana y soluble
El TNF-alfa es una citocina proinflamatoria producida por macrófagos activados y por otras células como monocitos, neutrófilos, células asesinas naturales (NK) y células T. Ejerce efectos pleiotrópicos sobre la inmunidad, la inflamación, la proliferación celular, la diferenciación y la apoptosis; también actúa como un pirógeno endógeno4.
Tiene dos formas biológicamente activas, una forma transmembrana (tmTNF) y una soluble (sTNF). El mTNF-alfa es un precursor del sTNF, que es liberado después de ser procesado por TACE (enzima convertidora del TNF). La forma soluble de esta enzima tiene el efecto de neutralizar el TNF2.
El TNF-alfa se expresa como un homotrímero que ejerce sus actividades a través de la unión a dos tipos de receptores: TNFR1 y TNFR25, que son glicoproteínas transmembrana caracterizadas por tener una región extracelular con 4 dominios ricos en cisteína (CRD 1-4), cada uno con 3 enlaces de disulfuro de cisteínacisteína. Además, poseen un dominio transmembrana que participa en la solubilización del receptor y un dominio de muerte intracelular que está implicado en la transducción de señales. La unión de TNF al TNF-R1 induce una cascada de señalización a través de su dominio de muerte intracelular, que conduce posteriormente a la activación del complejo I (o inflamatorio) del NFkB y procede a la transcripción de genes anti-apoptóticos, pro-inflamatorios y del complejo II de apoptosis (caspasas)6.
Antecedentes históricos
TRAPS se describió por primera vez en 1982, en familias irlandesas y escocesas con múltiples miembros y un síndrome hereditario de fiebre periódica. Presentaban semejanzas con la fiebre mediterránea familiar (FMF), siendo su primer nombre el de fiebre hiberniana familiar (FHF). Posteriormente se describieron nuevos casos, tanto familiares como esporádicos, que recibieron nombres diferentes, tales como fiebre periódica benigna, FMF dominante y fiebre periódica dominante con amiloidosis7.
Desde el descubrimiento del gen responsable, TNFRSF1A, en 1999, la fisiopatología ha sido ampliamente investigada; sin embargo, la patogénesis de TRAPS aún no está completamente entendida, ya que presenta mucha heterogeneidad clínica entre las diferentes mutaciones, así como entre los pacientes con la misma mutación8.
Bases genéticas
Aproximadamente 100 mutaciones en TNFRSF1A capaces de inducir el desarrollo de esta enfermedad han sido reportadas y registradas en la base de datos INFEVERS, que recopila todas las mutaciones responsables de los síndromes hereditarios de fiebre periódica, ahora denominados enfermedades inflamatorias hereditarias, entre las que están FMF, TRAPS, síndrome hiperinmunoglobulina D (SHID), síndrome de Muckle-Wells, Urticaria familiar por frío (FCU) y síndrome crónico infantil neurológico cutáneo y articular (CINCA)9. Los estudios se han centrado en las mutaciones del dominio de las Pirinas, que son comunes en poblaciones ancestrales del Mediterráneo. Generalmente se ha reconocido que ocurren con más frecuencia en determinados grupos étnicos, como la FMF en judíos sefardíes, asquenazíes, armenios, árabes y turcos. En Latinoamérica existen al menos tres casos reportados de FMF10, la mayoría de reportes de TRAPS son de la población europea11 y japonesa12. No se encontraron publicaciones de casos de TRAPS en la literatura colombiana13,14.
El receptor TNFR1 está formado por tres tipos de estos dominios: el CRD1, o dominio preligando que interactúa con otros homólogos produciendo homotrímeros; el CRD2 y CRD3 que interactúan con el factor de necrosis tumoral alfa13. La mayoría de las mutaciones asociadas a TRAPS alteran la estructura tridimensional del TNFR1 al sustituir aminoácidos en los dominios ricos en cisteína y alterando los enlaces disulfuro1,15.
Aún no es clara la relación entre el genotipo y el fenotipo de la enfermedad, dado que hay un alto grado de heterogeneidad entre las diferentes mutaciones y los pacientes con la misma mutación. Las que afectan los residuos de cisteína tienen una alta penetrancia de la enfermedad y una mayor probabilidad de progresión en amiloidosis6,16. En las de baja penetrancia los pacientes tienen síntomas inflamatorios leves que aparecen de forma tardía (en la adultez es más común su aparición) con bajo riesgo de desarrollar amiloidosis. Los cambios se caracterizan por introducir o eliminar residuos de prolina (P46L, L57P, S86P y R92Q) o interferir en los enlaces de hidrógeno que son los que dan la estabilidad del receptor16.
Hay mutaciones raras que alteran aminoácidos individuales y no afectan los residuos de cisteína como la P46L y R92Q, éstas se asocian con manifestaciones más heterogéneas y benignas de la enfermedad. Ocurren en pacientes sin historia familiar, en familiares asintomáticos de un caso índice y en otras condiciones inflamatorias como la artritis reumatoide, la esclerosis múltiple (EM) y la ateroesclerosis; incluso, con menor frecuencia, en personas sanas. Esta mutación podría llevar a la coexistencia de EM y TRAPS4.
Otra mutación recientemente descrita es la S59P o pSer88Pro, en la cual se sustituye prolina por serina. La estructura cíclica de la prolina genera una conformación rígida que interfiere, junto con otros aminoácidos, en la formación del enlace peptídico, afectando así la estructura secundaria de la proteína. El fenotipo de esta, se caracteriza por presentar gran inflamación, responder parcialmente al tratamiento con esteroides y con sensibilidad al inhibidor de la IL-1. La S59P determina una activación constitutiva de la vía de IL-1β, por lo que se relaciona con inhibición de la apoptosis y activación del factor de transcripción NFkB, con el subsecuente incremento de citocinas proinflamatorias17.
Es probable que varias mutaciones del TNFRSF1A aún no se hayan identificado, puesto que numerosos pacientes con características clínicas de TRAPS no tienen ninguna de las descritas hasta la fecha18-20.
Hipótesis de la patogénesis de TRAPS
La Figura 1 resume los eventos relacionados con la fisiopatología de TRAPS que se explican a continuación.
Hipótesis de señalización celular defectuosa
Varios estudios han encontrado que la mayoría de los receptores de TNF mutados nunca alcanzan la superficie celular y quedan atrapados en el retículo endoplásmico, donde desencadenan una respuesta inflamatoria intracelular que resulta en la expresión constitutiva de citocinas proinflamatorias3. La disminución del receptor de la membrana disminuye el desprendimiento de este y, por ende, de la forma soluble6,21.
Esta hipótesis surgió de la demostración de niveles desproporcionadamente bajos en sangre del receptor soluble del TNF, durante los ataques en pacientes con las mutaciones C33Y, T50M, C52F y C88R22. A diferencia de pacientes con artritis reumatoide, donde los niveles del receptor comienzan en el rango normal y pueden aumentar veinte veces23.
Las mutaciones de sentido erróneo de cisteína generan una conformación alterada en el dominio extracelular24, impidiendo la degradación proteolítica por TACE, una metaloproteinasa que escinde al TNFR1 en la membrana celular y libera sTNFR1 al torrente sanguíneo, donde se une al TNF circulante y atenúa la inflamación25.
Este mecanismo es común a otras enfermedades inflamatorias como la artritis reumatoide y el lupus eritematoso sistémico13, aunque no se presenta en todas las mutaciones. Para los pacientes con disminución en sTNFR1 podría emplearse etanercept que neutraliza el TNF circulante2.
Hipótesis de la reducción de la señalización de NFkB
Una consecuencia de la mayoría de las mutaciones TRAPS es la activación del factor de transcripción NFkB. Se describen mecanismos que regulan ascendentemente la expresión del receptor de TNF, pudiendo causar activación celular a través de la vía de señalización de NFkB15,26.
Por otro lado, se describe que la señalización NFkB reducida es una característica de cuatro mutaciones TRAPS que se correlaciona con la reducción de la expresión de mTNF. La formación correcta del dominio extracelular de TNFRSF1A es importante para la localización y la función del receptor27.
En TRAPS, la inflamación mediada por TNF, además de motivar la activación de NFkB, también puede resultar en la activación de vías adicionales como MAPK (proteincinasas asociadas a mitógenos), como en las mutaciones T50M y C33Y6.
Simón et al., en un estudio con ratones knock-in con sTNFR1 mutado encontraron que este no funcionaba como un receptor para TNF-α, pero inducía la inflamación mediante la acumulación intracelular con activación de la cinasa c-Jun N-terminal (JNK) y, la señalización de MAPK p38, posiblemente mediante la inducción de especies reactivas del oxígeno, lo que resulta en una mayor producción de citocinas proinflamatorias y quimiocinas6,28.
Hipótesis de las proteínas mal plegadas
Hay mutaciones que pueden tener un efecto más drástico en la estructura tridimensional del receptor. Enfermedades como la fibrosis quística, la enfermedad de Alzheimer y la enfermedad de Parkinson, también involucran trastornos conformacionales, acumulación y agregación de proteínas mal plegadas29,30.
Se han descrito varias hipótesis de la etiología de la enfermedad basados en este concepto, como la internalización defectuosa, alteración en el tráfico intracelular del receptor, alteración en la apoptosis y la autofagia15,31. Las mutaciones pueden llevar a un defecto en la habilidad de las metaloproteinasas para escindir el TNFR1 de la membrana celular, disminuyendo la inactivación del receptor y permitiendo el estímulo repetido sobre el mismo13.
Se sostiene que las mutaciones en los ectodominios de TNFRSF1A conducen a un cambio conformacional que causa el mal plegamiento con un efecto de ganancia de función. El TNFR1 mal plegado se retiene en el retículo endoplásmico, presenta un tráfico defectuoso y no neutraliza el TNF, perpetuando así la inflamación. Posiblemente los receptores mal plegados se acumulan en el citosol y forman agregados que generan estrés al retículo endoplásmico; por otro lado, los agregados intracelulares de la proteína mal plegada podrían inducir la activación constitutiva de NFkB por señalización independiente del ligando19-21.
Alteración del tráfico del receptor mutado
Cuando hay elevación de TNF, TNFR1 se transporta a la superficie celular, pero el receptor mutado es retenido en el citoplasma21,22,26,32,33.
El mal plegado del receptor es una característica universal de mutaciones TNFR1 en TRAPS22,23,25,26-34. Por ejemplo, en ratones knock-in TNFR1 que expresan la mutación T50M, el receptor se retuvo específicamente en el retículo endoplásmico34.
El receptor mutado sí interactúa y desencadena una respuesta inflamatoria, pero es incapaz de activar la vía de transcripción NFKB inducida por TNF-α, lo que conduce a la reducción de la apoptosis con el incremento en la supervivencia de las células inflamatorias activadas35,36.
Inicialmente se tenía precaución con esta hipótesis de mal plegamiento, porque aunque el TNF mal plegado inducía claramente una respuesta inflamatoria, este modelo era dependiente de datos generados en líneas celulares en lugar de células tomadas de pacientes con TRAPS37. Posteriormente se encontró que los monocitos de los pacientes con esta tienen una mayor expresión de marcadores de estrés del retículo endoplásmico, como parte de la respuesta de la proteína mal plegada2.
Deterioro de la autofagia
La autofagia está involucrada con la mayoría de las vías de respuesta al estrés celular, incluyendo las que participan en la eliminación de agregados de proteínas mal plegados. Juega un papel crucial en el correcto funcionamiento del sistema inmune innato y ha demostrado ser el principal mecanismo celular a cargo de la eliminación TNFR138.
La disminución de la autofagia, potencia la respuesta inflamatoria con activación del NFkB, producción de especies reactivas de oxígeno (ROS) y apoptosis37.
Por otro lado, las ROS inducen la autofagia en monocitos de pacientes con TRAPS39.
La alteración de la activación de NFkB y la excesiva secreción de IL-1βse han reportado tanto en modelos in vitro como en monocitos de pacientes con TRAPS, probablemente debido al deterioro de la autofagia40. Además el NFkB se activa por el inhibidor de la autofagia, mTOR28.
En la mutación C55Y la autofagia se deteriora, se acumula p62 que genera la activación excesiva de NFkB y los monocitos muestran una mayor secreción de la citocinas proinflamatorias como IL-1β37,41.
Defectos en la apoptosis
Se cree que esta se produce por una diferencia en el umbral de activación, en donde posiblemente los genes de supervivencia son los primeros en ser activados y más tarde, tras la formación de un segundo complejo intracelular, se produce la vía de la apoptosis. La alteración en la apoptosis se ha asociado a formas graves de TRAPS, probablemente por su capacidad para sostener la activación e inflamación, ligando-dependiente e independiente NFkB17.
Los neutrófilos y los fibroblastos dérmicos de pacientes con TRAPS presentan disminución de la apoptosis cuando se exponen a TNF, con acumulación de citocinas proinflamatorias IL-6 e IL-8, por activación de NFkB42.
La caspasa-8 es crucial para la inducción de apoptosis por TNF, en los neutrófilos de los pacientes con TRAPS es menos activa43 debido a que Beclin-1 está parcialmente secuestrado en los agregados que contienen TNFR1 mutado44.
Los cambios conformacionales en la porción extracelular del TNFR1 interfieren con la internalización del receptor, lo que lleva a una formación defectuosa de complejo TNFR1 II que se requiere para la activación de la apoptosis, resultando en una acumulación de TNFR1 en la superficie celular, lo que genera una activación constitutiva del receptor y la consecuente activación de NFkB (mutación C73R)21.
Los pacientes con la mutación R92Q debutan en una edad más tardía. Generalmente en la edad adulta los episodios son de más corta duración, la erupción es menos típica, presenta menos dolor abdominal y en el tratamiento requieren menos esteroide; en ellos los neutrófilos son resistentes a la apoptosis inducida por TNF-α42,45. Al parecer estos pacientes son más propensos a desarrollar otras enfermedades inflamatorias y autoinmunes como artritis precoz, enfermedad de Behçet, trombosis venosa profunda extracraneal, aterosclerosis o pericarditis recurrente4.
Producción de especies reactivas del oxígeno
Los ROS inducen la autofagia, la cual a su vez reduce eficazmente los niveles de ROS46.
Las células de pacientes con mutaciones asociadas a TRAPS producen espontáneamente ROS en la mitocondria, implicados en la señalización TNFR1 independiente de la unión ligando-receptor, además de mejorar la señalización desencadenada por interacción de estos47, la activación de la JNK (cinasa cJun N-terminal) y la actividad sostenida de MAPK que optimiza la respuesta inmune innata48 y, al tiempo la activación de NFkB en monocitos49. Las ROS también se han asociado al defecto en la apoptosis en pacientes con TRAPS49.
Alteración en la unión TNF-receptor
El mal plegado del receptor es una característica universal de las mutaciones en TRAPS. El TNFR1 mutado es incapaz de unirse a TNF50.
Niveles elevados de expresión de IL-22
Esta citocina derivada de células T induce inflamación del hígado, páncreas, intestino y piel. Los niveles elevados de IL-22 se han descrito en TRAPS y en pacientes con psoriasis y pitiriasis rosada51.
RELACIÓN CON OTRAS ENFERMEDADES AUTOINFLAMATORIAS
El concepto de enfermedades autoinflamatorias fue inicialmente sugerido por Dan Kastner en 1999, quien reconoció un grupo de desórdenes inmunológicos caracterizados por episodios “aparentemente no provocados” de inflamación y fiebre sin títulos altos de autoanticuerpos ni de la activación de las células T antigenoespecíficas, lo que las diferencias de las enfermedades autoinmunes e implica una desregulación en el sistema inmune innato52. La definición original refería que la inflamación era “aparentemente sin provocación”, aunque ahora sabemos que con frecuencia existen factores desencadenantes como el frío en el síndrome autoinflamatorio familiar inducido por el frío, las vacunas infantiles en el SHID, el trauma físico en TRAPS y el síndrome PAPA (Artritis piógena, pioderma gangrenoso y acné), el trauma mecánico en la piel y el tracto gastrointestinal en el síndrome DIRA (Deficiencia del antagonista del receptor Il-1), el esfuerzo físico extenuante en la FMF, el estrés psicológico y los ciclos menstruales en varias de estas enfermedades53.
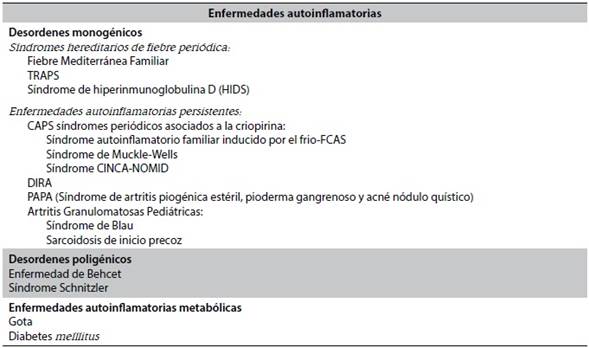
Los síndromes autoinflamatorios se presentan típicamente en la infancia. El único que se manifiesta en la edad adulta es el síndrome de Schnitzler, en la sexta década. FMF, CAPS y TRAPS se asocian al aumento del riesgo de amiloidosis, ellos se benefician de la terapia de Bloqueo IL-1 de tempranamente54, (Tabla 1).
MANIFESTACIONES CLÍNICAS
Los pacientes con TRAPS presentan episodios febriles que suelen durar más de 10 días y los síntomas son casi continuos en un tercio de los pacientes. Muchos refieren no sentirse completamente bien entre un brote y otro55,56. En el resto de los pacientes se presentan brotes cada 2 a 9 meses. Más del 95 % de los pacientes presentan fiebre, la que siempre se manifiesta en la edad pediátrica54.
El síntoma diferenciador más claro del TRAPS es la mialgia que la presenta aproximadamente el 90 % de los casos y afecta característicamente solo a un área corporal. La mialgia, típicamente sigue un camino migratorio en sentido centrífugo acompañando al exantema eritematoso. Se producen por una fascitis monocítica inflamatoria, no por miositis. Las artralgias son muy frecuentes, mientras que la artritis se manifiesta solo en un porcentaje pequeño de pacientes56.
Las manifestaciones digestivas están presentes en 75 al 92 % de los casos. La más importante es el dolor abdominal, que puede ser secundario a una peritonitis inflamatoria o a una inflamación de los músculos de la pared abdominal, el dolor se puede confundir con un abdomen agudo y algunos son intervenidos57. También se presenta vómito y constipación3.
Las manifestaciones oculares son muy frecuentes, más del 80 % pueden ser conjuntivitis, edema y/o dolor periorbitario (unilateral o bilateral). El edema periorbitario puede aparecer de forma prodrómica. Existen otras manifestaciones menos frecuentes como las adenopatías, el dolor torácico (por afectación pleural o por afectación de los músculos intercostales), cefalea, linfadenopatías, dolor y edema testicular3 (Tabla 2).
Los síntomas son acompañados de incremento en los reactantes de fase aguda como la velocidad de sedimentación globular, la proteína C reactiva (PCR), la haptoglobina, el fibrinógeno y la ferritina56. Además de la neutrofilia, trombocitosis, el aumento de amiloide en suero y aumento policlonal de inmunoglobulinas, no se detectan autoanticuerpos. Estas alteraciones tienden a atenuarse durante los periodos asintomáticos3. Hay casos de pacientes reportados cuya única manifestación es la pericarditis recurrente58. En los niños pequeños con fiebre persistente de origen desconocido, debe sospecharse TRAPS48.
Para los pacientes portadores de la variante R92Q de baja penetrancia, el fenotipo varía dependiendo de la edad de aparición. En una serie de 18 pacientes, el 61 % de los casos iniciaron en la infancia, y 39 % en la adultez. En todos los pacientes se presentó fiebre recurrente, mialgias y lesiones cutáneas. En los niños predominó un cuadro clínico de dolor abdominal, vomito, adenitis cervical y faringitis, mientras que en los adultos fue más frecuente el dolor torácico, la cefalea y episodios más prolongados. En ambos casos, el pronóstico y el tratamiento no varió49.
MANIFESTACIONES CUTÁNEAS
Los hallazgos cutáneos son de particular importancia en TRAPS, ya que se ha demostrado que ayudan a orientar el diagnóstico. Estos ocurren por lo general durante los primeros dos años de vida54.
Pueden ser máculas eritematosas o placas edematosas que semejan celulitis dolorosas, que inician en la zona proximal de miembros superiores e inferiores y migran hacia las zonas más distales. El tamaño de estas lesiones varía de 1 a 28 cm; son dolorosas a la palpación, calientes y blanquean con la presión54. Pueden ser semejantes a la erisipela, la urticaria, el edema periorbitario y la estomatitis aftosa54.
La histología de las lesiones cutáneas en TRAPS no es específica, no pueden diferenciarse de un exantema viral o de una reacción tipo enfermedad del suero. Se encuentra un infiltrado dérmico perivascular de linfocitos y monocitos54. El hallazgo más característico es un infiltrado dérmico de linfocitos y monocitos. Por inmunohistoquímica se evidenció la presencia de células CD3+, CD4+, CD8+, CD68+, CD79a- y CD20-. Ninguna de las biopsias mostró vasculitis leucocitoclástica, granulomas o macrófagos multinucleados15.
La IL-8 juega un papel regulador en monocitos y fibroblastos. Esta quimiocina parece tener un papel importante en las manifestaciones dermatológicas y en la fascitis monocítica de la afectación muscular durante los ataques de TRAPS22.
COMPLICACIÓN
La amiloidosis ocurre en pacientes que padecen enfermedades inflamatorias de curso crónico, infecciosas y no infecciosas por la elevación repetida de sustancias de fase aguda, incluyendo al precursor amiloide SSA. Se manifiesta como un síndrome nefrótico que progresa a falla renal21. Ocurre no solo en TRAPS, sino también en la fiebre mediterránea familiar y en la artritis reumatoide59.
Presentan más riesgo los pacientes portadores de mutaciones que afectan a los aminoácidos cisteína, comparado con los portadores de mutaciones que afectan otros aminoácidos (el 24 frente al 2 %, respectivamente). El signo más precoz es la proteinuria3.
TRATAMIENTO
e basa en prednisolona o su equivalente a 20 a 30 mg/día21. Los inmunomoduladores como metotrexate, azatioprina, ciclosporina o colchicina no ofrecen beneficio21.
Los anti-TNF como etanercept (proteína de fusión que actúa como receptor señuelo del TNF) se emplean para disminuir la severidad, frecuencia y duración de los episodios, sin embargo, no son útil en todos los pacientes. Según el tipo de mutación de cada paciente se han descrito diferentes respuestas al infliximab, desde respuesta satisfactoria al medicamento hasta reacciones inflamatorias paradójicas. Adalimumab ha sido útil, aunque también puede provocar estas reacciones paradójicas60,61.
El uso de terapia anti-IL-1, ya sea con anakinra que es una proteína recombinante, antagonista de IL-1, o canakinumab, un anticuerpo monoclonal que bloquea IL-1B, se han demostrado respuestas satisfactorias, en especial en los pacientes que no han respondido a etanercept12. En un estudio fase II, de prueba de concepto, con 19 pacientes, se evaluó la respuesta a la administración de canakinumab de 150 mg cada cuatro semanas por el transcurso de 4 meses, para luego ser suspendido hasta por 5 meses y reiniciado con las recaídas, con una administración en intervalos de 4 a 8 semanas por 24 meses. El canakinumab tuvo buena tolerancia y disminuyó rápidamente la actividad de la enfermedad, en promedio, a los 4 días. Luego de la suspensión hubo una reactivación con un promedio de 91.5 días53.
A pesar de que el TRAPS cuenta con diferentes opciones de tratamiento, este aún es complejo, hay reportes de falta de respuesta al anakinra en pacientes con la mutación T50 M, en los que ya había fallado el tratamiento con etanercept.
De forma anecdótica, también se ha empleado moxifloxacino por la eliminación de los productos bacterianos o por sus efectos antiinflamatorios62.
CONCLUSIÓN
Los síndromes autoinflamatorios están causados por mutaciones en genes que codifican proteínas fundamentales en la respuesta inmune innata. Suelen manifestarse tempranamente y afectan a varios miembros de la familia. Uno de estos es el síndrome periódico asociado al receptor del factor de necrosis tumoral, TRAPS. La mayoría de las mutaciones asociadas a este son puntuales y generan sustituciones de un solo aminoácido del ectodominio CRD1, CRD2 o CRD3. Las características clínicas más importantes de TRAPS son la fiebre y las mialgias migratorias, que van acompañadas de una erupción cutánea eritematosa que la mayoría de las veces simula una celulitis infecciosa con elevación de los reactantes de fase aguda. El diagnóstico tardío puede llevar a amiloidosis y finalmente, puede generar una falla renal. A pesar de que no se conoce su prevalencia en nuestro medio, es posible que exista un importante subdiagnóstico que nos anima a estar alertas con los pacientes que manifiestan episodios febriles recurrentes.