INTRODUCCIÓN
Las infecciones por bacterias multirresistentes han aumentado en prevalencia e incidencia a nivel hospitalario, creando un problema frecuente para realizar su abordaje y tratamiento que implican mayores costos al sistema de salud, por el aumento significativo en la morbimortalidad en los pacientes, además del requerimiento de uso de agentes antimicrobianos más potentes y con dosis mayores.
Dentro de este grupo de infecciones cabe resaltar el aumento de multirresistencia en bacilos gram negativos como enterobacterias, Pseudomonas aeruginosa y Acinetobacter baumannii, con las dificultades en el manejo de estos microorganismos. Una alternativa de tratamiento para estas bacterias es el uso de colistina intravenosa, el cual es un fármaco de alto costo con toxicidad renal asociada, pero al que se le atribuyen éxitos terapéuticos. A continuación, se describe el caso de un paciente con aislamiento de germen multirresistente y la opción terapéutica instaurada de acuerdo a guías de práctica clínica1,2.
REPORTE DE CASO
Paciente de 56 años con antecedente de hiperplasia prostática benigna y enfermedad diverticular, quien ingresa a un hospital universitario por cuadro clínico de hemorragia de las vías digestivas bajas por una enfermedad diverticular complicada que requirió la intervención quirúrgica de colectomia subtotal e ileoproctoanastomosis término-terminal, con una posterior laparotomía exploratoria con drenaje de hematoma retroperitoneal que requirió múltiples lavados (10 lavados peritoneales en total) junto con la remodelación de anastomosis ileocólica, con cierre definitivo de pared abdominal seis días después. Se encontró una peritonitis residual con aislamiento de Klebsiella pneumoniae productora de carbapenemasa (KPC) manejada con tigeciclina y doripenem por 14 días.
El paciente continuó hospitalizado hasta que presentó deterioro de su estado general, fiebre y taquicardia, con catéter venoso central eritematoso y respuesta inflamatoria sistémica; se solicitaron policultivos donde se obtuvieron tres hemocultivos positivos y un cultivo de punta de catéter con evidencia de Pseudomonas aeruginosa (productor de la enzima KPC). Se establece el manejo con colistina, en dosis de 10.000.000 UI dividida en dos diarias, y meropenem 2 gr vía intravenosa cada 8 horas (día 1), con vigilancia de pruebas de función renal.
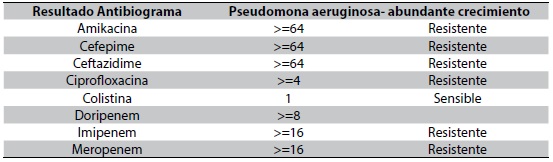
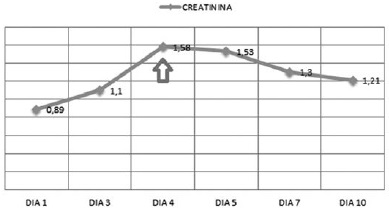
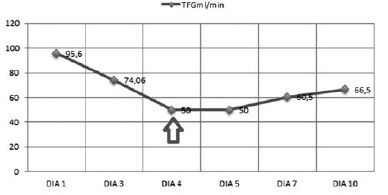
Valorado por el comité de infecciones, quienes revisan el antibiograma de hemocultivos y los cultivos de punta de catéter de P. aeruginosa (Tabla 1) con evidencia de MIC > 16 para meropenem, se realiza un cambio de carbapenémico a doripenem con dosis de 1 gr cada 8 horas, solicitan niveles de colistimetato a la novena dosis, administración concomitante de ácido ascórbico (3 gr intravenoso cada 12 horas) y el retiro de dispositivos médicos invasivos. El paciente presenta una evolución clínica favorable, una mejoría de la respuesta inflamatoria sistémica y afebril, pero con elevación de pruebas de función renal (Figura 1 y 2); por ello, al cuarto día se realizan modificaciones del esquema terapéutico con colistina a dosis de 2.400.000 UI cada 8 horas y control de hemocultivos al quinto, cuyo resultado negativo permite complementar manejo antibiótico por 10 días con respuesta favorable y egreso hospitalario.
DISCUSIÓN
Las infecciones por bacterias gram negativos involucradas en multirresistencia se presentan clínicamente en bacteremias, neumonías asociadas a la ventilación, infecciones del sitio operatorio, infecciones del SNC o drenajes ventriculares. En lo intrahospitalario, hay un aumento de los microorganismos nosocomiales multirresistentes, lo que limita el abordaje terapéutico ante la escasa disponibilidad de nuevas alternativas, como lo es el caso de la colistina, disminuyendo su uso por presentar reacciones adversas al medicamento como nefrotoxicidad y neurotoxicidad, pero ante el aumento de la resistencia de las bacterias gram negativas se contempla su uso nuevamente a escala mundial1,2.
La colistina es un antibiótico bactericida de la familia de las polimixinas, un polipéptido cíclico que como compuesto catiónico actúa como detergente de la membrana bacteriana y produce daño, causando liberación de sustancias intracelulares y muerte celular. Se ha descrito que su objetivo principal son los lipopolisacáridos (LPS) de la membrana externa de las bacterias gram negativas, produciendo una interacción electrostática debido a sus grupos amina, cargados positivamente contra las cargas negativas de fosfato y los grupos de carboxilo del lípido A de los LPS, lo que altera la permeabilidad de la membrana3,4.
Existen dos formulaciones comerciales: colistina sulfato y colistimetato sódico, este último es un profármaco que se hidroliza a colistina y es de uso intravenoso, siendo menos potente y menos tóxico que el colistina sulfato1,3,5. En cuanto a su farmacocinética, incluye presentaciones de uso por vía intravenosa, nebulizaciones, intratecal o tópica. Tiene una distribución amplia, excepto a nivel sinovial, pleural y pericárdico, con un volumen que varía de acuerdo a individuos sanos (1,24 L/kg) y críticamente enfermos (0,72 L/Kg). Presenta moderada unión a proteínas en un 50 %, con metabolismo de hidrólisis de colistimetato a la forma activa de colistina en < 30 %, con un tiempo de vida media de eliminación de 2-3 horas a través de filtración glomerular3,6.
Su amplio espectro de acción conlleva a ejercer actividad con bacterias gram negativas como P. aeruginosa, Klebsiella pneumoniae y Acinetobacter baumannii, sin embargo, se recomienda tener en cuenta los niveles de la concentración mínima inhibitoria (MIC) para el inicio del tratamiento con colistina, siendo estas definidas como < 2 mg/dl para A. baumannii y enterobacterias y, < 2 mg/dl o < 4 mg/L para P aeruginosa7.
Existe un problema en cuanto a su dosificación, debido a la variedad de unidades de administración de acuerdo a determinadas zonas geográficas como en Europa, Reino Unido e India donde el colistimetato se expresa en unidades internacionales (UI), mientras que en América, Asia y Australia se habla de la cantidad en miligramos de colistina. Siendo así, la equivalencia de 1 MUI corresponde a 30 mg de colistina, y estos aproximadamente a 80 mg de colistimetato, de tal forma que una determinada dosis de colistina corresponderá a 2,7 veces el número de miligramos de colistimetato5,7,8.
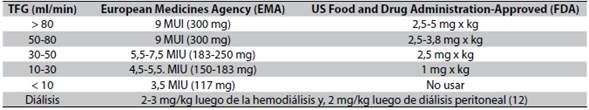
En el caso presentado, el paciente se inició con la dosis recomendada por la FDA (Federation and Drugs Administration), adicionalmente según las recomendaciones se le administró dosis de carga ante la conversión lenta de colistimetato a colistina, lo que permitió alcanzar el estado estacionario para que el fármaco se encuentre en ventana terapéutica de forma más temprana5,7. Se debe tener en cuenta que en el ámbito mundial, los esquemas varían dependiendo de la región geográfica, las unidades empleadas y la tasa de filtración glomerular del paciente (Tabla 2)9-12.
Ya que el caso trataba de una bacteria multirresistente, se describe en la literatura iniciar dosis altas de colistina (dosis de carga de 9 MUI y continuar 9 MUI/ día) al relacionarse con desenlaces favorables como mejoría clínica y curación microbiológica, basados en estudios farmacocinéticos y farmacodinámicos, aunque, se pueden asociar a mayor riesgo de convulsiones y de nefrotoxicidad, como fue el caso del paciente descrito. Para prevenir estos efectos adversos se deben medir los niveles plasmáticos de colistina, especialmente en aquellos con falla renal que permitan ajustar la dosis12,13-15.
No obstante, no se han descrito niveles plasmáticos óptimos que estén en relación con un desenlace clínico favorable en pacientes con bacterias multirresistentes, debido a que las dosis mayores tienen un alto riesgo de presentar nefrotoxicidad, mayor mortalidad y falla terapéutica en mayor proporción, lo que podría considerarse un nuevo campo de investigación en cuanto a este medicamento16,17.
Dentro de los efectos adversos, de acuerdo a como los presentó el paciente del caso clínico, está la nefrotoxicidad, producto de una necrosis tubular aguda por su forma de eliminación y el aumento en la permeabilidad de la membrana de las células tubulares renales, que aumenta con factores de riesgo como la edad (mayores de 65 años) y alto puntaje de APACHE II, uso prolongado, altas dosis de colistina y uso concomitante con otros medicamentos neurotóxicos; varios factores identificados en el paciente actual. La recomendación es emplear una terapia paralela con otros antibióticos cuando se aísla microorganismos con MIC > 1 mg/L, adicionalmente al tener crecimiento abundante o infección en regiones profundas. Se puede realizar medición de niveles terapéuticos como gestión de riesgo y prevención de la nefrotoxicidad documentada con concentraciones plasmáticas de colistina > 2,5-3 mg/L7,18-20. De ahí que, esta nefrotoxicidad sea reversible, con mejora al descontinuar el tratamiento o disminuir la dosis instaurada21,22.
Adicionalmente, como gestión de riesgo para evitar la nefrotoxicidad se ha estudiado la coadministración de ácido ascórbico como efecto protector al romper radicales libres producidos en el daño renal que se desencadena, con dosis de 2-4 gr/día, administrados 20 minutos antes de la dosis de colistina, se ha relacionado con un descenso de hasta 4 veces de producir una falla renal aguda23-26.
Otro efecto adverso es la neurotoxicidad, que se manifiesta con debilidad, vértigo, confusión, ataxia, parestesia facial o periférica y bloqueo neuromuscular que puede llevar a falla respiratoria.27.
Con el caso presentado, previamente, se realiza una terapia en combinación con otros antibióticos para aprovechar el efecto sinérgico que pueden llegar a tener al adicionar rifampicina, sulbactam, tigeciclina, imipenem y meropenem. Con el efecto benéfico de presentar menos efectos adversos en el tratamiento de P. aeruginosa multirresistente22,28,29.
CONCLUSIONES
La colistina representa un antibiótico con espectro de acción para bacterias gram negativas y función bactericida apropiada para manejar infecciones multirresistentes, el presente caso pretende demostrar su eficacia como bactericida, la seguridad del medicamento y establecer un modelo basado en la dosificación adecuada del mismo, con la importancia de medición de niveles terapéuticos, para lograr desenlaces favorables en el tratamiento de estas infecciones que impactan en la morbimortalidad de los pacientes y demandan altos costos al sistema de salud.