INTRODUCCIÓN
Cada año en Estados Unidos se diagnostican con cáncer aproximadamente 16.400 pacientes menores de 20 años, 12.000 entre 0-14 años y 4.400 entre 15-19 años. El cáncer es la principal causa de muerte relacionada con enfermedad en los niños entre 1-14 años y cerca de 1.300 muertes en menores de 15 años ocurrieron durante el 2010 en Estados Unidos 1-2. La leucemia es la neoplasia más común en niños, constituye el 25 % de todos los tumores y la leucemia linfoide aguda (LLA) corresponde al 72 %. de las leucemias agudas. Anualmente se diagnostican de 3 a 4 casos nuevos por cada 100.000 habitantes, con un pico de incidencia entre los 2-5 años de edad 3-4. El síndrome de Bloom, de Li Fraumeni, de Nijmegen y la anemia de Fanconi 1,3-6, pueden predisponer a su aparición en asociación, posiblemente, con un factor desencadenante del medio ambiente. Esto lleva a la mutación en los puntos claves del control en la proliferación, diferenciación y apoptosis de los precursores linfoides que llevan al desarrollo de la enfermedad 5. Los resultados del tratamiento de esta enfermedad han pasado de una supervivencia de 0 en 1950 a una supervivencia libre de evento del 75 al 85 % en la actualidad, gracias al desarrollo de agentes de quimioterapia, a la optimización de dosis, combinaciones e intensidad en el tratamiento, profilaxis al sistema nervioso central con quimioterapia intratecal y terapia dirigida al riesgo de la enfermedad, entre otros. 1-3,5,7-11. En Colombia se diagnostican cerca de 500 casos nuevos de LLA en menores de 18 años cada año, con una incidencia aproximada de 2 a 5 casos por 100.000 por año, en menores de 15 años 12-14, con un pico de incidencia entre los 2 a 5 años. La supervivencia global y libre de la enfermedad es menor de 50 % por múltiples razones: altas tasas de abandono, toxicidad del tratamiento, falta de intensidad de quimioterapia y falla de tratamiento 2,7,14-17. Los resultados del tratamiento para LLA en Colombia, según el Registro Poblacional de Cáncer de Cali, mostraron supervivencia global entre 1992-1996, a 5 años, de 25 %, entre 1997 a 2001 de 38 % y entre 2002 a 2006 de 52 % 2. Otros desenlaces informados fueron la muerte en la inducción 7,8 %, recaída 44 % y abandono del tratamiento 35 % 8,12-13,15. Como problema de salud pública la enfermedad ha tenido cambios en el país. Desde 2008 debe hacerse una notificación obligatoria de los casos de leucemia y esta es considerada una enfermedad trazadora de la calidad de atención del sistema de salud. Actualmente, dentro del plan decenal de cáncer del país 2012-2021, está como objetivo aumentar la supervivencia de los niños con LLA 18. En el servicio de oncología de la Fundación HOMI Hospital de la Misericordia, centro de referencia para el tratamiento de cáncer infantil, se diagnostican en promedio 180 casos nuevos al año y el 25 % son casos de leucemia linfoide aguda. Durante el periodo de marzo de 2007 a noviembre de 2012, los pacientes diagnosticados con LLA fueron tratados con la estrategia BFMIntercontinental 2002, modificada para Colombia, llamado protocolo ACHOP 2006. El objetivo principal de este trabajo fue determinar la supervivencia global y libre de eventos de los pacientes pediátricos con el diagnóstico de LLA, tratados con el Protocolo ACHOP 2006 en la Fundación HOMI, durante el período de marzo de 2007 a noviembre de 2012. Los objetivos secundarios fueron describir la mortalidad en inducción y en remisión completa, el abandono, la recaída y sus características y las complicaciones más frecuentes relacionadas con el tratamiento.
METODOLOGÍA
Se realizó un estudio descriptivo y retrospectivo con seguimiento de una cohorte de pacientes que recibieron tratamiento en la Fundación HOMI desde el 2007 hasta el 2012.
CRITERIOS DE INCLUSIÓN
Pacientes menores de 14 años con diagnóstico nuevo y confirmado de LLA en la Fundación HOMI. Haber recibido, al menos, el primer mes de tratamiento en la Institución. Tener la autorización de parte de los padres o cuidadores para iniciar el tratamiento.
CRITERIOS DE EXCLUSIÓN
Pacientes con LLA como segunda neoplasia
El protocolo de tratamiento ACHOP 2006, está basado en el protocolo BFM-Intercontinental 2002, fue adaptado para nuestro país con el acompañamiento de un grupo de expertos que integran el Comité del Protocolo BFM. En esta estrategia de tratamiento está considerada la estratificación de los pacientes según dos categorías de riesgo: estándar y alto. Esta estratificación de riesgo definió el tratamiento que recibió cada paciente (Tabla 1).
Tabla 1 Clasificación del riesgo

Evaluación del día 15 y 33, se hace con el recuento de blastos expresado en médula ósea en porcentaje: M1 menos de 5 %, M2 entre 5 % y menos del 25 % y, M3 como 25 % o más blastos. Fuente: elaboración propia.
Se definió el compromiso de sistema nervioso central (SNC) de la siguiente manera:
SNC 1: no hay evidencia clínica de enfermedad, ni compromiso de pares craneanos que pueda ser atribuible a leucemia, no hay imágenes (tomografía axial computarizada [TAC] o resonancia magnética [RNM]) con evidencia de anormalidad del SNC atribuible a la leucemia; fondo de ojo normal o líquido cefalorraquídeo (LCR) sin blastos y no hay otra evidencia de leucemia del SNC.
SNC 2: células blásticas claramente identificables en un centrifugado de LCR con recuento < 5/uL y una relación en el LCR de glóbulos rojos (GR): leucocitos (LEU) ≤ 100:1; con esta relación entre GR y LEU la punción lumbar (PL) se considera no traumática y el LCR no contaminado con sangre. Linfoblastos en un citocentrifugado de LCR y la relación GR: LEU > 100:1; con esta relación entre eritrocitos y leucocitos la PL se considera traumática y el LCR contaminado con sangre o una PL traumática asociada con un recuento de leucocitos inicial > 50000/uL.
SNC 3: masa tumoral en el cerebro y/o meninges detectada por TAC o RNM. Parálisis del nervio craneal. Compromiso de la retina diagnosticado por la evaluación oftalmológica. Recuento de células blásticas en LCR > 5/uL en el citocentrifugado.
DESENLACES
Muerte en la inducción: ocurre en la fase IA (33 primeros días) o hasta una semana después de finalizada. Muerte relacionada con el tratamiento: sucede después de haber alcanzado una remisión completa (RC), sin evidencia de recaída de en la enfermedad. Falla de la inducción: más del 5 % de los blastos en la médula ósea al final de la inducción.
Recaída
Hematológica: aparición de blastos en la médula ósea (más del 25 %) después de haber alcanzado RC al final de la inducción (se tomó la fecha en que se realiza el aspirado de la médula ósea que confirma presencia de blastos). En SNC: aparición de blastos en el LCR (se tomó la fecha en la que se confirman los blastos en el LCR), después de remisión. Testicular: aparición de enfermedad testicular (se tomó la fecha de biopsia que confirma recaída testicular). Traslado: cambio a otro centro de tratamiento por la decisión del asegurador (se tomó la fecha en la que el paciente sale del Hospital de La Misericordia hacia otra institución). Abandono del tratamiento: inasistencia o incumplimiento del tratamiento por 8 semanas continúas a partir de la fecha de la última quimioterapia recibida. Supervivencia libre de evento (SLE): tiempo transcurrido entre la fecha en que se realizó el diagnóstico y el inicio del tratamiento hasta la fecha de presentación de situaciones, como la falla de remisión (fecha del aspirado de la medula en el día 33 con persistencia de blastos), recaída, traslado, abandono de tratamiento, aparición de segunda neoplasia, muerte por cualquier causa o, del último control vivo. Supervivencia global (SG): es el tiempo transcurrido desde la fecha en que se realizó el diagnóstico hasta la fecha de la muerte por cualquier causa o, del último control vivo. En la Tabla 2 se describen las características del tratamiento del protocolo ACHOP 2006. Análisis estadístico: en el estudio descriptivo las variables cualitativas se presentaron con frecuencias absolutas y relativas y las cuantitativas con medidas de tendencia central y de dispersión, de acuerdo con la distribución de los datos. Se realizó un análisis de supervivencia utilizando curvas de Kaplan-Meier para evaluar SG y SLE. Este estudio fue aprobado por el Comité de Ética Institucional.
Tabla 2 Protocolo del tratamiento ACHOP 2006, adaptado para Colombia
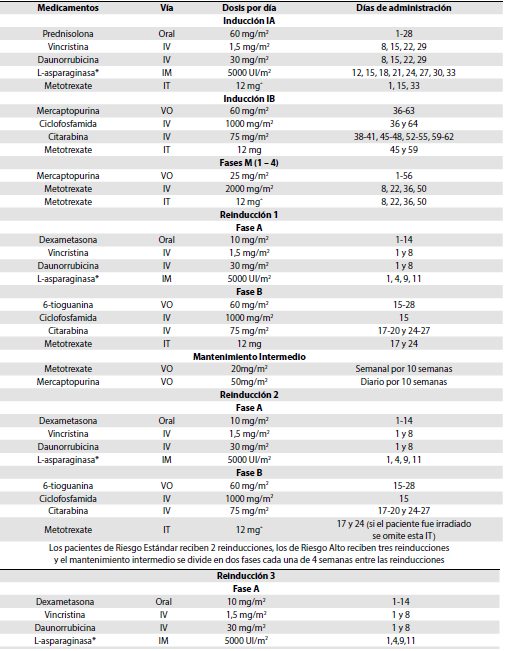
* L-asparaginasa de E. coli. (La dosis de metotrexate IT varía según los grupos de edad: menores de 2 años 8 mg, 2-3 años 10 mg y mayores de 3 años 12 mg. Fuente: elaboración propia VO Via Oral, IV Via endovenosa, IT Terapia Intratecal, IM Intramuscular.
RESULTADOS
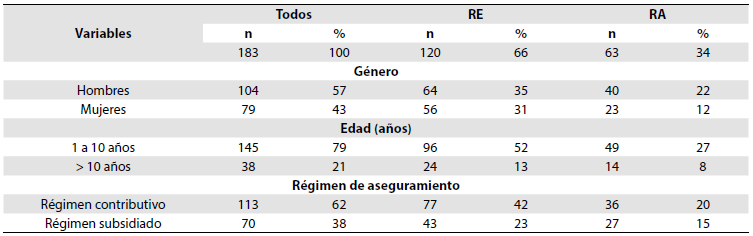
Del total de los 206 pacientes con diagnóstico de LLA en el periodo del estudio, se incluyeron 183 para análisis. De los 23 excluídos, 14 no recibieron la inducción en la Institución y 9 recibieron un protocolo diferente a ACHOP 2006. En las Tablas 3, 4y 5 se presentan las características demográficas, clínicas, de laboratorio y desenlaces de los pacientes que recibieron tratamiento con el protocolo ACHOP 2006.
Tabla 4 Resultados paraclínicos de los pacientes
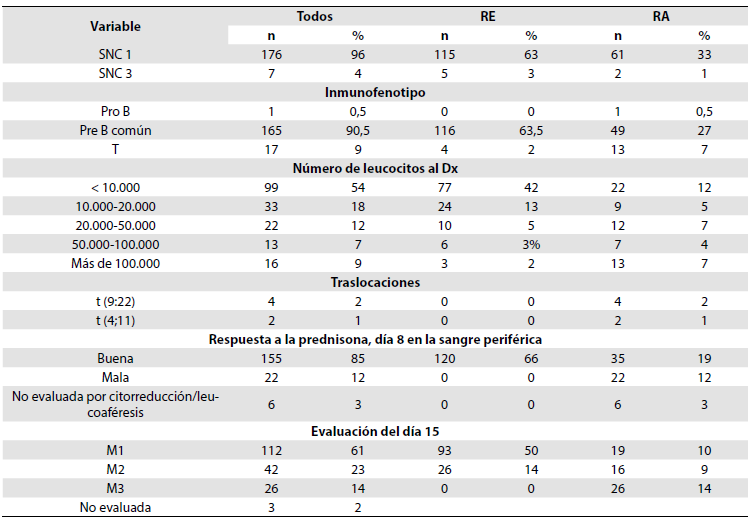
RE: riesgo estándar, RA: riesgo alto. SNC 1: no identificación de células blásticas en LCR, SNC 3: Más de 5 células/uL, la mayoría blastos, compromiso de retina, compromiso de pares craneanos, masa en parénquima cerebral. M1, M2, M3: ver Tabla 1
Tabla 5 Resultados clínicos de los pacientes
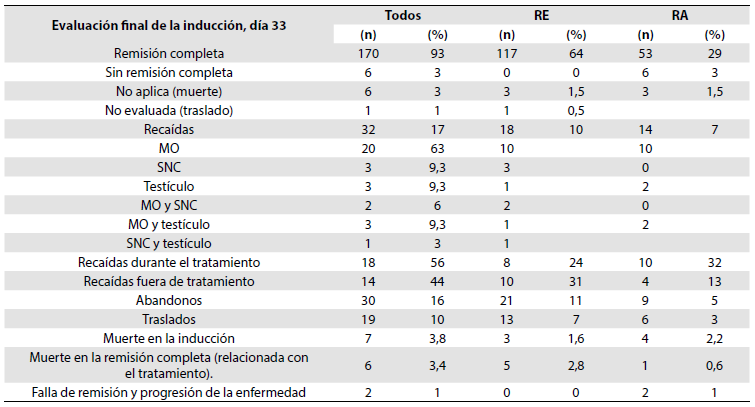
RE: riesgo estándar, RA: riesgo alto. MO: médula ósea. SNC: sistema nervioso central
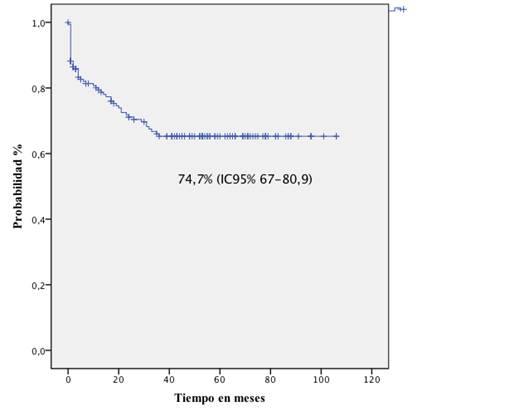
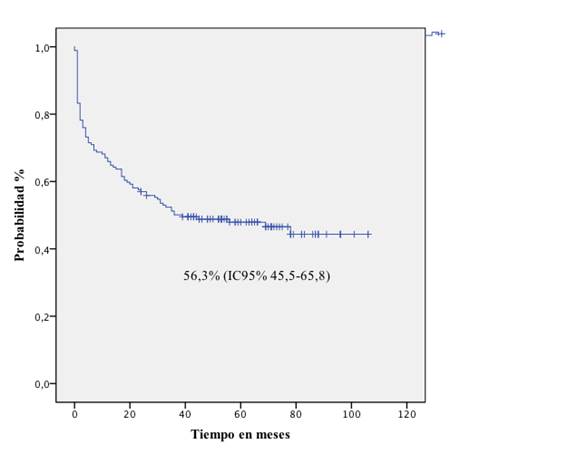
La SG a 2, 3 y 5 años fue de 89 %, 87,3 % y 74,7 % (IC 95 % 67 - 80,9), respectivamente. En el grupo de riesgo estándar (RE) fue de 78,6 % (95 % IC 68,3-85,1) y, para el riesgo alto (RA), de 61,9 % (IC 95 % 50,7 - 73). La SLE fue de 56,3 % (IC 95 % 45,5 - 65,8) a 5 años para toda la población evaluada (Figuras 1 y 2).
Siete pacientes murieron durante la fase de inducción, tres presentaron colitis neutropénica, tres choque séptico por una infección con bacilos gram negativos con los siguientes microorganismos: Escherichia coli, Serratia marcescens, Enterobacter cloacae, y uno falleció por varicela complicada.
Los 6 pacientes que fallecieron posterior a la inducción y que estaban en remisión completa, todos lo hicieron por infecciones graves: dos al finalizar la fase IB, uno durante la fase M, después del primer ciclo de dosis de metotrexate, y tres durante las fases de reinducción. Dos pacientes con enfermedad refractaria fallecieron por progresión de la enfermedad.
Se presentaron 30 abandonos (16,4 %) y 20 sucedieron al terminar la inducción IA, 3 durante la fase M, 2 durante las reinducciones y 5 durante el mantenimiento largo. Todos se encontraban en remisión completa, 50 % pertenecían al grupo de riesgo estándar y 60 % estaban asegurados en el régimen subsidiado.
De los 19 pacientes trasladados, 15 lo hicieron durante la inducción, uno iniciada la fase M y tres durante las reinducciones. Se trasladaron más pacientes del régimen subsidiado (61 %). Treinta y dos pacientes presentaron recaída: 20 fueron recaída hematológica y 56 % de las recaídas fueron durante el tratamiento. Las complicaciones se presentaron con mayor frecuencia durante el período de inducción, neutropenia febril en el 51 % de los pacientes, el 25 % de ellos con soporte en la unidad de cuidado intensivo. Los procesos infecciosos fueron las complicaciones más importantes durante todo el tratamiento, principalmente durante la fase de inducción y durante las reinducciones. De los 10 pacientes con complicaciones hemorrágicas, 8 fueron en el período de inducción IA: una hemorragia intraparenquimatosa, dos hemorragias de vías digestivas altas, una metrorragia y cuatro epistaxis de difícil control. De los 7 pacientes que presentaron episodios trombóticos, cuatro fueron de seno venoso cerebral, uno intraparenquimatoso, uno de vena iliaca externa y femoral común y uno de trombosis de vena axilar, todas durante la fase de inducción. Las complicaciones cardiovasculares se presentaron durante la inducción en protocolo IB, en 11 pacientes relacionadas con medicamentos como la ciclofosfamida, antraciclinas e infecciones principalmente. Las infecciones más frecuentes fueron de la piel y de los tejidos blandos. El período donde se requirió mayor soporte transfusional fue el de la inducción, en el 93 % de los pacientes. El soporte transfusional con crioprecipitados para manejo de la hipofibrinogenemia (menor de 100 mg/dL) relacionada con el uso de L-asparaginasa, fue necesario en el 51 % de los pacientes. Los otros períodos de mayor requerimiento del soporte transfusional fueron la fase IB de la inducción y las reinducciones 1 y 2.
DISCUSIÓN
En la Fundación HOMI, centro de referencia para el manejo de cáncer pediátrico, se diagnostican aproximadamente de 60 a 70 casos de LLA cada año. Durante el período de 2007 a 2012 se usó la estretagia de tratamiento ACHOP 2006, basado en el BFM-Intercontinental 2002 y modificado para Colombia. Tres especialistas integrantes del panel central del protocolo BFM (Giusseppe Massera, George Mann y Helmut Gardner) estuvieron en Colombia en 2006 para acompañar la decisión de cuáles modificaciones hacer al protocolo original, estas estaban dirigidas a disminuir su toxicidad e implementarlo a nivel nacional. La probabilidad de SG a los 5 años fue del 74,7 %, para el riesgo estándar 78,6 % y para el riesgo alto 61,9 %. La SLE a los 5 años, incluyendo el abandono y traslado como evento, fue del 56,3 %. Al excluir el abandono la supervivencia libre de evento fue del 70 %. El Instituto Nacional de Cancerología de Colombia (INC) publicó los resultados de los tratamientos con este mismo protocolo en el 2015, con supervivencia global y libre de evento a 2 años de 80 % y 65 %, respectivamente. Las diferencias de tiempo de seguimiento, 2 años para el INC y 5 para HOMI, deben tenerse en cuenta 7,19. Resultados previos de SG a 3 años de pacientes con LLA en Colombia (70,7 %) fueron publicados por el Registro Poblacional de Cáncer de Cali, del 2007 al 2011 2, y no hay datos de seguimiento a los 5 años de este grupo de pacientes. La muerte en la inducción disminuyó en este protocolo de tratamiento. La estrategia de tratamiento derivada del BFM es el tratamiento de LLA en la Fundación HOMI desde 1996. En la primera cohorte evaluada se evidenció el 9 % por muerte en inducción, en el protocolo ACHOP 2006 fue de 3,8 % y la última evaluación en el 2015 mostró el 1,7 % 20. Los resultados del INC muestran muerte en la inducción del 7 % para el protocolo ACHOP 2006 7 y 7,3 % para un protocolo previo basado en BFM 19. Los 7 pacientes que fallecieron en la inducción fue debido a una infección. Dos pacientes no entraron en remisión y fallecieron por progresión de la enfermedad. La muerte relacionada con el tratamiento fue del 3,4 %, en todos la causa fue infecciosa en etapas intensivas. La muerte en remisión completa para el protocolo ACHOP en INC fue del 3 % y previamente con una estrategia basada en BFM había sido del 14 % 7,19. Los resultados de esta cohorte son similares a los de la última publicación del INC. Igualmente, al revisar los datos de muerte en la inducción y en la remisión completa en Latinoamérica, se hallaron similitudes con la evaluación del tratamiento de AHOPCA 21, la cual tuvo el 3 % de muerte en la inducción y 3,3 % en la remisión completa.
Este protocolo de tratamiento muestra mejores resultados comparado con el primer protocolo basado en BFM que se llevó a cabo en la Fundación HOMI del 1996 al 2000. La muerte en la inducción se redujo de 9 % a 3,8 % y la muerte relacionada con el tratamiento del 10 % a 3,7 %. Atribuimos que la mejoría de algunos desenlaces con este protocolo se debe al uso de un solo tratamiento institucional para los pacientes con leucemia; a la posibilidad de administrar quimioterapia intensiva, especialmente para quienes se consideren están en alto riesgo. Esta institución presta, además, servicios de consulta ambulatoria y de urgencias, cuenta un área hospitalaria dedicada a la oncología pediátrica y tiene un mayor número de especialistas, enfermeras y personal auxiliar entrenado, tanto en complicaciones como en el manejo de profilaxis contra enfermedades oportunistas. Eventos como el abandono y los traslados son factores que hacen que los resultados no sean mejores, esta es una situación única en Colombia. En otros países latinoamericanos está centralizada la atención de los niños con cáncer en pocos centros de tratamiento y el traslado entre centros por razones contractuales o administrativas no se presenta. El abandono es una situación que se presenta en Latinoamérica que, sin embargo, viene en descenso a lo largo de la región; en la evaluación del tratamiento de pacientes con LLA en Centroamérica en el 2014, se encontró una tasa de abandono de 9,6 % 21-23, inferior a nuestra evaluación que fue de 16,4 %. Dentro de la Institución se han tomado medidas para disminuir estos eventos, soporte a las familias con psicología y trabajo social 7,14,16. Al interior de la Fundación HOMI se implementó un gestor interno para acompañar a los pacientes con diagnóstico de cáncer, para de esta manera contribuir a disminuir el abandono y el aplazamiento del tratamiento. La principal fortaleza del estudio es que fue realizado en un hospital exclusivamente pediátrico con una población cautiva, lo que facilita el seguimiento a pesar de los traslados y abandonos que se presentaron. Además, tenemos un tiempo adecuado de seguimiento e incluso los oncólogos del servicio manejaban la información tanto en medios físicos como magnéticos, lo cual permitió confirmar los datos obtenidos. Como limitante, se trató de un estudio retrospectivo, pero podría servir de base para aquellos de tipo prospectivos.
CONCLUSIÓN
El protocolo ACHOP 2006 se constituyó en Colombia como el primero de índole colaborativo nacional para el tratamiento de los niños con LLA. Estratificar según el riesgo lleva a disminuir los efectos secundarios de la quimioterapia para el subgrupo estándar e intensificar la terapia en el grupo de alto riesgo, lo cual conlleva mejores resultados. Se debe continuar con la mejora de las medidas de soporte al paciente para disminuir la muerte en RC y reducir las tasas de abandono, a fin de seguir el trabajo de fortalecer las condiciones del sistema de salud que favorezca al niño con cáncer y lograr en el futuro resultados similares a los de los países desarrollados.