INTRODUCCIÓN
El TW o nefroblastoma es el segundo tumor abdominal más frecuente en la edad pediátrica y responde por más del 90 % de los tumores renales en pediatría 1. En Estados Unidos la incidencia estimada de los tumores renales malignos es de 8 casos por cada millón de niños menores de 15 años, por año 2. La prevalencia es de 1 en 10.000 niños y representa del 6 al 7 % de todas las neoplasias malignas que afectan a pacientes pediátricos 3,4.En países como México se reporta una frecuencia del 4 al 6 % dentro de todas las neoplasias malignas 5. En Colombia los registros del Instituto Nacional de Cancerología reportan una frecuencia de 9,3 % para nefroblastoma y 0,6 % para los otros tipos de cáncer renal en la población infantil 6.
Aproximadamente, el 10 % de los niños con TW tienen condiciones congénitas asociadas como los síndromes de BeckwitWiedemann, Perlman, Sotos, GolabiBehmel, Denys-Drash, Bloom y síndrome WARG (Wilms, aniridia, retraso mental, anomalías genitourinarias) 2,7. La mayoría de los pacientes con TW se presentan con una masa palpable asintomática. Otras manifestaciones clínicas asociadas son la hematuria, hipertensión, fiebre o dolor (20 %) 7,8.
Para la aproximación diagnóstica, el ultrasonido doppler, la tomografía (TC) y la resonancia magnética son útiles tanto para definir la presencia y características del tumor, como también para delimitar la presencia, extensión y localización de los sitios de metástasis a distancia. El TW es el primer ejemplo de tumor maligno en el que se alcanzaron significativas tasas de curación gracias al empleo de quimioterapia multimodal, al desarrollo de técnicas quirúrgicas, al uso de quimioterapia previa a la cirugía y al reconocimiento del papel de la radioterapia, que utilizadas en forma racional tienen un gran impacto en la supervivencia de esta neoplasia que en el pasado fue casi invariablemente fatal. Existen varios protocolos de tratamiento para el TW, los dos más ampliamente utilizados son el del National Wilms Tumor StudyGroup (N.W.T.S.G), que ahora hace parte, junto con otros grupos de trabajo, del Children’s Oncology Group (COG), y el de la Sociedad Internacional de Oncología Pediátrica (S.I.O.P.). Ambos tienen la nefrectomía como el pilar del manejo, pero difieren en otros aspectos. Sus principales diferencias son la utilización o no de quimioterapia prequirúrgica, la estratificación, la clasificación histológica y la duración de los esquemas de quimioterapia. Los dos protocolos han sido tema de debate en diferentes estudios para definir cuál tiene mejores resultados en cuanto a supervivencia libre de enfermedad y supervivencia global, no obstante, ambos resultados son comparables y satisfactorios en estos dos grupos 8,9.
La técnica quirúrgica para el manejo del TW se basa en un abordaje transverso transperitoneal, el cual permite una exposición completa del abdomen. El procedimiento estándar es una nefroureterectomía total con muestreo ganglionar. En los últimos años se ha incrementado el uso de la laparoscopia para el manejo del TW, la cual, sin embargo, genera controversia. Se considera que pueden ser abordados con esta técnica quirúrgica los pacientes con tumores pequeños que no cruzan la línea media, que no tienen extensión venosa, que no están adheridos a órganos adyacentes y que no hay tenido ninguna invasión o ruptura preoperatoria 9,10.
El objetivo del presente estudio es describir la experiencia local del TW y los resultados obtenidos en el manejo de los niños menores de 15 años con dicho diagnóstico en los hospitales San Vicente Fundación (HSVF) y Pablo Tobón Uribe (HPTU), en un período de 12 años, con el fin de obtener datos objetivos de nuestro contexto que nos permitan conocer nuestras cifras y el enfoque actual para mejorarlos resultados de nuestros pacientes.
MATERIALES Y MÉTODOS
Se realizó un estudio de seguimiento a una cohorte retrospectiva en dos centros de atención de cuarto nivel de complejidad, HPTU y HSVF, que incluyó una muestra de 84 pacientes menores de 15 años con el diagnóstico histopatológico de tumor de Wilms, determinado según el protocolo del Colegio Americano de Patólogos, tratados en el servicio de hemato-oncología entre el 1o de enero de 2005 y el 31 de mayo de 2017. Se seleccionaron pacientes por debajo de los 15 años, ya que es la edad límite determinada para la atención de la población pediátrica en los dos hospitales estudiados.
Para la recolección de la información, se revisaron todas las historias clínicas de pacientes seleccionados dentro de las bases de datos aportadas por ambas instituciones, las cuales incluían niños y niñas con diagnóstico de tumor renal con código CIE 10, C64X. Se tuvieron en cuenta los siguientes criterios de inclusión: ser menor de 15 años, tener diagnóstico confirmado de tumor de Wilms mediante resultado de histopatología entre enero de 2005 y mayo de 2017 y haber sido tratado en el HPTU o el HSVF. Se excluyeron los pacientes que padecían tumores renales diferentes al tumor de Wilms.
Adicionalmente, para completar la información pertinente a la supervivencia, se realizaron llamadas telefónicas a los pacientes que no continuaron sus revisiones en los dos hospitales del estudio. El desenlace principal medido en este estudio fue la supervivencia global, definida como los pacientes que viven hasta el último día de dato de seguimiento y como desenlace secundario, se tuvo en cuenta la recaída entendida como la presencia de reaparición tumoral, identificada mediante imágenes y estudios de patología durante el seguimiento.
Para el análisis estadístico se construyó una base de datos con el programa SPSS (Statistical Package of Social Sciences), con las variables seleccionadas para el estudio (autorización del Instituto Tecnológico de Antioquia).
Para el análisis de supervivencia, los datos del tiempo a la recaída o muerte fueron analizados utilizando el cálculo de función de supervivencia por el método Kaplan Meier. Para el cálculo de función de supervivencia libre de recaída y supervivencia global, se definieron los siguientes tiempos: el tiempo de recaída como el transcurrido desde la fecha del diagnóstico y la presencia de reaparición tumoral, y el tiempo de muerte (supervivencia global) como el transcurrido desde la fecha del diagnóstico a la fecha de la muerte.
Las variables cualitativas se presentan con frecuencias absolutas y relativas, las cuantitativas con medidas de tendencia central.
Ética: se solicitó autorización en los comités de investigaciones y de ética de ambas instituciones, las cuales avalaron la investigación. Se firmó por parte del responsable del paciente, el consentimiento informado de ingreso a las dos instituciones. Por ser un estudio observacional retrospectivo no requiere de intervenciones diagnósticas y/o terapéuticas diferentes a las ya empleadas para cada paciente durante su proceso de atención, por lo tanto, no se hace necesario el diligenciamiento de otro tipo de consentimiento. Se garantiza que la identidad y los datos de la historia clínica son confidenciales y no son revelados.
RESULTADOS
Se encontraron 84 pacientes con diagnóstico confirmado de TW que cumplieron con los criterios de inclusión del estudio. En la Tabla1 se presentan los principales datos demográficos de la población en estudio. De los 84 pacientes, 34 eran procedentes del HPTU y 50 del HSVF. El seguimiento completo pudo llevarse a cabo en 69 pacientes, por lo tanto, tuvimos una pérdida de 15 pacientes (17,9 %).
Se encontró que un solo paciente (1,2 %) presentó un síndrome malformativo asociado, el cual correspondía al síndrome de Beckwith Wiedemann, diagnosticado con apoyo del grupo de genética pediátrica. Otras condiciones asociadas se presentaron en dos pacientes: ductus arterioso persistente (1,2 %) y aniridia aislada (1,2 %).
La presentación clínica más frecuente fue masa abdominal en 61 pacientes (72,6 %), la cual pudo estar aislada o acompañada de otra sintomatología (Tabla 1).
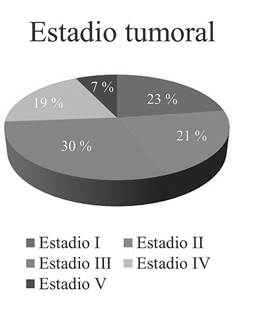
La información respecto al estadio tumoral se presenta en la Figura 1. Según la histología, se encontraron 73 pacientes de histología favorable (HF) (86,9 %) y 7 pacientes de histología desfavorable (HD) (8,3 %). En 4 de las historias revisadas el informe de patología no era claro respecto a este punto.
Tabla 1 Información general
| Variable | (n) | (%) |
|---|---|---|
| Pacientes totales | 84 | 100 |
| Sexo masculino | 43 | 51,2 |
| Sexo femenino | 41 | 48,8 |
| Edad media (meses) | 44,7 | |
| Mediana de edad (meses) | 46,5 | |
| Lateralidad derecha | 35 | 41,7 |
| Lateralidad izquierda | 43 | 51,2 |
| Tumores bilaterales | 6 | 7,1 |
| Presencia de síndromes malformativos | 1 | 1,2 |
| Tipos de presentación del TW: | ||
| Masa abdominal | 30 | 35,7 |
| Masa y dolor abdominal | 14 | 16,7 |
| Masa abdominal e HTA* | 10 | 11,9 |
| Masa, dolor abdominal y fiebre | 6 | 7,1 |
| Dolor abdominal, hematuria y HTA* | 6 | 7,1 |
| Dolor abdominal | 4 | 4,8 |
| Hematuria | 4 | 4,8 |
| Dolor y fiebre | 3 | 3,6 |
| Masa abdominal y hematuria | 2 | 2,4 |
| HTA e infección urinaria | 1 | 1,2 |
| Masa, distensión abdominal y pérdida de peso | 1 | 1,2 |
| Diagnóstico prenatal por imagen | 1 | 1,2 |
* Hipertensión arterial
En nuestros hospitales se sigue el protocolo del COG/NWTS. Treinta y tres pacientes (39,3 %) debieron ser llevados a quimioterapia prequirúrgica, y las principales causas fueron, tamaño tumoral (34 %), presencia de metástasis (27 %), tumor bilateral (18 %) y presencia de trombo tumoral (18 %). A 16 pacientes (19,04 %) se les hizo biopsia previa a la quimioterapia y a la cirugía.
Dos pacientes no fueron llevados a cirugía por fallecimiento, en el resto (82 pacientes) los procedimientos quirúrgicos practicados en orden de frecuencia fueron: nefrectomía unilateral abierta en 75 pacientes (91,5 %), nefrectomía unilateral por laparoscopia (todas posquimioterapia) en 4 pacientes (4,9 %) y nefrectomía unilateral abierta con preservación de nefronas contralateral en 3 pacientes (3,7 %).
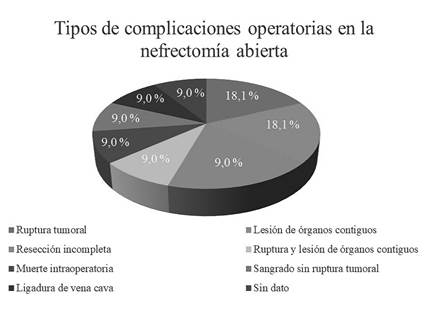
De los 82 pacientes llevados a procedimientos quirúrgicos, 11 sometidos a nefrectomía abierta (13,4 %) presentaron complicaciones, como se muestran discriminadas en la Figura 2. No hubo complicaciones en aquellos a quienes se les realizaron cirugía laparoscópica.
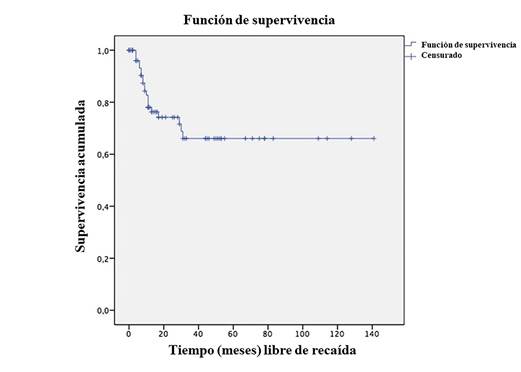
Veinte pacientes presentaron recaída tumoral. De estos, 5 tuvieron recaídas locales (25 %), 12 a distancia (60 %), definida como metástasis presente en pulmón y/o hígado, y 3 tanto local como a distancia (15 %). Según la histología, la recaída se presentó en 17 pacientes de los clasificados como HF y, en 3 pacientes de HD. También se encontró que 13 pacientes fueron sometidos a nefrectomía inicial y los otros 7 fueron llevados a quimioterapia prequirúrgica. Cuando se discriminan las causas de este manejo que no considera cirugía inicial, los resultados fueron: tumor bilateral en 2 pacientes (28,6 %), trombo en 2 pacientes (28,6 %), tamaño tumoral en 2 pacientes (28,6 %) y metástasis en 1 paciente (14,3 %). La recaída según estadio tumoral fue: 4 pacientes en estadio I, 3 en estadio II, 8 en estadio III, 3 en estadio IV y 2 en estadio V. Cuando se revisa la mortalidad de los pacientes que recayeron, se encuentra que 11 fallecieron (55 %), 3 están vivos (15 %) y en 6 (30 %) no se obtuvo dato de la mortalidad. Se encontró que el tiempo promedio de supervivencia libre de recaída en pacientes con tumor de Wilms fue de 97 meses. Después de los 31 meses de diagnóstico, la probabilidad de que un paciente no recaiga es del 66 % (Figura 3).
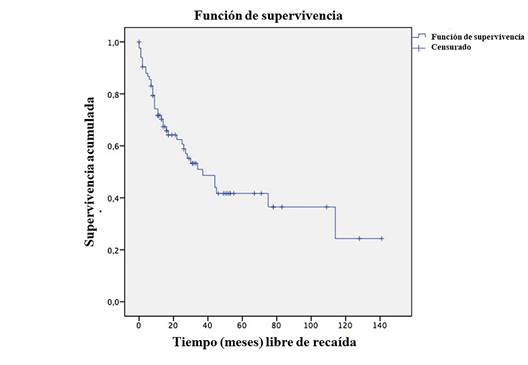
El tiempo promedio de supervivencia libre de muerte en pacientes con tumor de Wilms es de 62 meses (Figura 4). La supervivencia a los 108 meses fue del 71 % y después de los 82 meses de diagnóstico la probabilidad de que un paciente no muera es del 24 %.Los resultados respecto a la quimioterapia y radioterapia se citan en la Tabla 2.
Tabla 2 Pacientes que recibieron quimioterapia y radioterapia
| Variable | (n) | (%) |
|---|---|---|
| Quimioterapia completa* | 66 | 81,5 |
| Quimioterapia incompletas † | 11 | 13,6 |
| Quimioterapia en curso | 4 | 4,9 |
| Total de pacientes que recibieron quimioterapia | 81 | 96,4 |
| Radioterapia abdominal | 10 | 26,3 |
| Radioterapia local | 15 | 39,5 |
| Radioterapia torácica | 1 | 2,6 |
| Radioterapia Abdominal + torácica | 4 | 10,5 |
| Radioterapia Abdominal + local | 4 | 10,5 |
| Sin dato | 4 | 10,5 |
| Total de pacientes que recibieron radioterapia | 38 | 45,2 |
* En el protocolo NWTS/COG se hace referencia a completar 24 semanas. En el protocolo SIOP el tiempo a completar depende de la clasificación histopatológica y de la presencia o no de enfermedad metastásica. Consta de 4 a 6 semanas de quimioterapia previa a la cirugía acompañada de ciclos posoperatorios que pueden ir desde las 4 hasta las 15 semanas. †Suspensión de la terapia por cualquier motivo antes de las semanas totales estipuladas para el tratamiento completo, dependiendo del protocolo utilizado y de la clasificación histopatológica del tumor
De los 33 pacientes a quienes no se les realizó nefrectomía inicial, 24 tuvieron quimioterapia prequirúrgica según el protocolo SIOP (72,72 %) y 9 según el protocolo COG/NWTS (27,27 %). Como se mencionó previamente, de los 20 pacientes con recaída tumoral 7 no fueron sometidos a nefrectomía de entrada y se les ofreció quimioterapia prequirúrgica, 4 de ellos (57,14 %) bajo el protocolo COG/NWTS y los 3 restantes (42,85 %) recibieron quimioterapia inicial según el SIOP. En el protocolo SIOP fallecieron 4 pacientes, 17 sobrevivieron y de 3 no hubo dato de seguimiento. En el protocolo COG/ NWTS, fallecieron 3 pacientes, 4 sobrevivieron y en 2 no hubo dato de seguimiento (Tabla 3).
Tabla 3 Resultados de la quimioterapia prequirúrgica según los protocolos SIOP y COG/NWTS
| Variable | Protocolo COG/NWTS | Protocolo SIOP | |
|---|---|---|---|
| Número de pacientes | 9 | 24 | |
| Porcentaje total de quimioterapia prequirúrgica | 27,3 | 72,7 | |
| Motivos de la neoadyuvancia | |||
| Metástasis | 0 (0 %) | 9 (37,5 %) | |
| Bilateralidad | 4 (44,4 %) | 2 (8,3 %) | |
| Tamaño tumoral | 1 (11,1 %) | 10 (41,7 %) | |
| Trombo tumoral | 4 (44,4 %) | 3 (12,5 %) | |
| Pacientes vivos | 4 (57,1 %) | 17 (80,9 %) | |
| Recaída tumoral | 4 (57,1 %) | 3 (42,9 %) | |
DISCUSIÓN
El TW sigue siendo el tumor renal más frecuente en pacientes pediátricos respondiendo por el 90 % de todos los tumores renales en la infancia 1. La Unión Europea y EE.UU tienen un porcentaje de este tipo de tumor en menores de 15 años de 7 %, porcentaje similar a lo encontrado en nuestra epidemiología local (9,3 %). Los hombres se presentan con más frecuencia a edades más tempranas que las mujeres; pero, en general, el sexo femenino tiene una ligera mayor incidencia que el masculino 11. En nuestra cohorte fue solo un poco más frecuente en el sexo masculino que en el femenino (51,2 % vs. 48,8 %, respectivamente). La edad media de presentación en estos pacientes analizados es muy similar a la reportada en otros estudios, la cual es de 3,5 años 8,11. Los pacientes menores de 2 años tienen un pronóstico más favorable mientras que los mayores de 4 años han presentado resultados más desfavorables 12. La mayoría de los TW son unilaterales y del 5 al 10 % bilaterales 13. En este estudio la bilateralidad fue en 7,1 %, lo cual es semejante a lo descrito en la literatura.
La supervivencia en TW ha mejorado en las últimas décadas de 73 % en 1975 a 93 % en el 2012 14. En nuestro estudio se encuentra una supervivencia de 71 %, más baja que la reportada en la literatura mundial para la actualidad, lo cual podemos explicar porque en el resultado final estamos incluyendo todos los estadios tumorales y todos los tipos de histología, además porque el diagnóstico en muchos pacientes es en estadios avanzados. Los marcadores biológicos y moleculares son un factor determinante en el pronóstico 15, pero no los incluimos ya que no están disponibles de rutina en nuestro medio. Tuvimos en cuenta el estadio tumoral como factor pronóstico y se encontró un mayor número de pacientes en el estadio III, lo que se considera diagnóstico tardío que podría ser explicado por dificultades en el acceso a los servicios de salud en nuestro contexto. Hubo mayor mortalidad en el estadio IV y mayor recidiva en el estadio III.
El TW se presenta con masa abdominal asintomática en la mayor parte de los pacientes, por lo que es fundamental el examen físico abdominal de rutina por los médicos generales y por los pediatras, en todos los niños que se presenten en sus consultas. En esta serie de pacientes la presentación con masa abdominal fue muy predominante, con un 72,6 % y siendo aislada en 35,7 % de los casos. En general, puede acompañarse de fiebre (23 %), dolor abdominal (37 %) y hematuria (20 %), siendo poco común la presentación con signos y síntomas de un cuadro abdominal agudo. La hipertensión puede estar presente en 25 % de los casos 13. En esta serie, la hipertensión y la hematuria estuvieron con frecuencia asociadas a la masa abdominal. La hematuria aislada se presentó solo en el 4,8 % de los pacientes, lo que contrasta con otros estudios en los que dicho síntoma es más frecuente 16, esto podría explicarse porque es un signo poco buscado (microscópica) o no reportado dentro de la historia clínica. Un paciente se presentó con infección urinaria y otro con diagnóstico prenatal que correspondió a un TW neonatal. El sangrado dentro de la cápsula puede producir aumento del tumor, dolor abdominal y fiebre, este último síntoma frecuente en nuestros pacientes (10,7 %). Las secuelas como varicocele, edema de miembros inferiores, hepatomegalia e incluso, falla cardiaca congestiva pueden resultar de la trombosis vascular que compromete hasta la vena renal o la vena cava. La extensión del tumor a la vena cava puede ocurrir del 4 al 10 % de los casos; el 21,2 % de esta serie de pacientes tuvo trombo tumoral asociado. La presencia de trombo tumoral en la aurícula derecha ocurre en cerca del 0,7 % de los pacientes 17-19. En este estudio solo un paciente (1,2 %) tuvo persistencia del trombo que se extendía a la aurícula posquimioterapia y requirió cirugía cardiovascular en bomba de circulación extracorpórea.
En el examen físico se deben buscar aniridia, asimetría facial o de las extremidades, ascitis, anormalidades de los genitales y determinar la localización y tamaño de la masa abdominal 7. Dado que este es un estudio retrospectivo, a pesar de la relación conocida del TW con los síndromes malformativos, en nuestra población predominaron los tumores esporádicos y solo en un paciente se encontró un síndrome malformativo asociado y en otro aniridia aislada. Esto también puede ser explicado porque dichos síndromes no fueron buscados ni diagnosticados oportunamente.
La patología del TW tiene tres componentes inmaduros: blastema, estroma y epitelial. Esta histología está descrita como histología favorable. Si se encuentran células anaplásicas con presencia de nucléolopoliploide gigante, se describe como histología no favorable (anaplásico focal o difuso) 20. El TW con histología desfavorable es poco común, alrededor del 12 %; y en nuestra serie encontramos histología desfavorable en el 8,3 % de los pacientes.
El tratamiento del TW se basa en la nefrectomía, pero difiere en los diferentes grupos colaborativos, siendo cirugía inicial para el COG/NWTS y quimioterapia prequirúrgica en el SIOP. Esto no siempre se aplica en ambos protocolos; el SIOP ha modificado en los últimos años el hecho de que en algunos pacientes se puede realizar nefrectomía inicial, como en los menores de 6 meses con tumores resecables. Así también el COG/ NWTS tiene unas excepciones para la cirugía inicial y aplica en algunos casos la biopsia preoperatoria. En las dos instituciones analizada se sigue el protocolo COG/ NWTS con nefrectomía inicial, sin embargo, y como lo describe dicho protocolo, en algunos casos no fue posible, lo que sucedió en 33 de los pacientes y que se explica en casos de tumores bilaterales que requieren cirugía parcial, irresecables o cuando haya trombo vascular por encima de las venas hepáticas. En estos pacientes analizados,esas también fueron las principales causas de quimioterapia prequirúrgica, sumadas a la presencia de metástasis a distancia (27,3 %). Las biopsias percutáneas o abiertas están indicadas en algunos tumores inoperables. Cuando se toma una biopsia se considera que se produce una diseminación local (estadio III), a no ser que a juicio del cirujano se hubiera contaminado toda la cavidad peritoneal 8. En la seriese encontró que se realizó biopsia preoperatoria en 16 pacientes (19 %) los cuales fueron manejados con quimioterapia previa a la cirugía.
Para los TW unilaterales, la nefrectomía radical transperitoneal con muestreo ganglionar es la cirugía de elección. Dicho procedimiento se realizó en el 91,5 % de los pacientes estudiados. El abordaje mínimamente invasivo en el TW no está ampliamente aceptado, principalmente por la posibilidad de manipulación y ruptura tumoral. Algunos trabajos han investigado sobre la nefrectomía por laparoscopia, la cual es casi exclusiva de pacientes sometidos previamente a quimioterapia 11,21. En las historias revisadas, los 4 pacientes (4,9 %) a quienes se les realizó nefrectomía por laparoscopia recibieron quimioterapia preoperatoria. Respecto a la cirugía preservadora de nefronas, está indicada en casos de riñón único y en pacientes con síndromes asociados por el riesgo de deterioro de la función renal 22. En 3 pacientes (3,7 %) se describe la realización de nefrectomía unilateral y la preservación de nefronas contralateral, la cual estuvo indicada en pacientes con tumor bilateral y que recibieron quimioterapia previa. La Tabla 4 presenta los resultados comparativos con otros estudios y reportes similares.
Tabla 4 Comparación de resultados2 , 8 , 23
| Variable | Revisión local | Literatura mundial |
|---|---|---|
| Incidencia global | 9,3 % | 7 % |
| Edad de presentación | 3 años y 7 meses | 3 años y 5 meses |
| Sexo predominante | Masculino 51,2 % | Femenino 51 % |
| Lateralidad predominante | Izquierdo 51,2 % | Indiferente |
| Bilateralidad | 7,1 % | 5-7 % |
| Presencia de síndromes malformativos | 1,2 % | 10 % |
| Aniridia | 1,2 % | 1,1 % |
| Histología desfavorable | 8,3 % | 5-12 % |
| Estadio predominanteal momento del diagnóstico | Estadio 3 | Estadio 1 |
| Forma de presentación | Masa abdominal 72,6 % | Masa abdominal 60-80 % |
| Complicaciones quirúrgicas | Ruptura tumoral 2,4 % Sangrado 1,2 % | Ruptura tumoral 2,8-9,7 % Hemorragia 1,9 % |
LIMITACIONES DEL ESTUDIO
Consideramos que la pérdida del seguimiento de un porcentaje considerable de pacientes puede estar alterando la proporción de los pacientes vivos y de la recaída tumoral. Representa un sesgo importante para los resultados, sin embargo, se hace un esfuerzo para la recuperación de los datos de todos los pacientes.
CONCLUSIÓN
La media de edad del diagnóstico del tumor de Wilms, en los 84 pacientes incluidos en el estudio, es de 3 años y su presentación principal es masa abdominal. En los dos hospitales analizados el manejo del TW se rige por el protocolo del COG/NWTS con nefrectomía inicial y quimioterapia posterior. Un grupo de pacientes son llevados a quimioterapia prequirúrgica con las mismas indicaciones descritas en el protocolo americano. El diagnóstico de estos pacientes es con mayor frecuencia en estadios avanzados. La supervivencia en esta serie es menor que la reportada en la literatura mundial.