INTRODUCCIÓN
Las rickettsiosis son enfermedades febriles y zoonóticas causadas por bacterias del género Rickettsia, transmitidas por artrópodos tales como las garrapatas, pulgas y los piojos, entre otros. El género Rickettsia se clasifica según características serológicas y moleculares en los grupos tifo, ancestral, transicional y el de Fiebres Manchadas (GFM). El GFM está conformado por más de 20 especies, se distribuye en todos los continentes y puede contener especies patógenas para los humanos. Estas causan enfermedades de importancia considerable como la fiebre botonosa mediterránea, originada por Rickettsia conorii, endémica en la cuenca mediterránea (sur de Europa, sur y este de África, India y Oriente Medio) donde pueden presentar mortalidades del 21 % (1-3).
En América las especies Rickettsia rickettsii y Rickettsia parkeri son de importancia en salud pública, especialmente R. rickettsii, por ser la más virulenta del GFM; es transmitida principalmente por garrapatas duras de los géneros Amblyomma spp., Rhipicephalus spp., y Dermacentor spp. (4). R. rickettsii es el agente etiológico de la Fiebre manchada de las Montañas Rocosas (FMMR), enfermedad que se ha reportado en varios países de América (Estados Unidos, México, Costa Rica, Panamá, Colombia, Brasil y Argentina) (5). La FMMR presenta porcentajes de letalidad variables, entre 2,9 % y 28,4 % para México y Brasil, así como del 0,5 % para Estados Unidos; estos valores pueden ser explicados por las discrepancias en los distintos programas de vigilancia existentes, el tratamiento oportuno y las diferencias en las cepas bacterianas, entre otras causas (6).
La FMMR en humanos tiene un período de incubación de 10 a 14 días. Posteriormente, aparecen síntomas como fiebre, usualmente mayor a 39,5 °C, dolor de cabeza, mialgia generalizada, problemas digestivos como náuseas, vómito, diarrea, anorexia, escalofríos y, en algunos casos, exantema. Estos signos y síntomas no son patognomónicos de la enfermedad y suelen estar presentes en otras patologías, con las cuales se debe hacer diagnóstico diferencial, tales como la malaria, leptospirosis y el dengue, entre otras (7).
En Colombia se describió por primera vez un brote de FMMR en 1937 por el doctor Luis Patiño Camargo, en el municipio de Tobia (Cundinamarca), que presentó una letalidad del 95 % (8). Posteriormente, se ha visto como una enfermedad que reemergió con varios brotes, con letalidades entre el 27 % y 54 % en los municipios de Necoclí (Antioquia, 2006), Los Córdobas (Córdoba, 2007), y Turbo (Antioquia, 2007-2008) (9-11). Además, se ha evidenciado el contacto de la población con la bacteria gracias a estudios serológicos y reportes de casos (12-15).
Pese a que en la región del Urabá antioqueño previamente se reportó la infección y la enfermedad en los municipios de Necoclí y Turbo (9,11), aún hoy, el panorama epidemiológico y clínico no es claro. Este comportamiento se explica, en parte, por el poco estudio de los pacientes febriles y el enmascaramiento de los síntomas y signos con otras enfermedades con curso similar (dengue, malaria, entre otras), lo cual constituye un riesgo cuando los pacientes no reciben el tratamiento oportuno (16).
En relación a lo anterior, este trabajo tuvo como objetivo determinar la frecuencia de infección y enfermedad por Rickettsia spp. del GFM en pacientes febriles del Urabá antioqueño, que asistieron a centros hospitalarios de la región, con el fin de contribuir al conocimiento de la rickettsiosis, así como al diagnóstico diferencial de los síndromes febriles indiferenciados, que alerte a las autoridades de salud de la región para establecer medidas de prevención y control, sumado al suministro de un tratamiento adecuado y oportuno que ayude a evitar las pérdidas humanas y las posibles complicaciones o secuelas.
METODOLOGÍA
Tipo de estudio y participantes
Se realizó un estudio descriptivo con un muestreo por conveniencia de casos incidentes en pacientes con la aparición de una enfermedad febril (temperatura oral mayor o igual a 38 °C, de menos de cuatro días de evolución y con residencia mayor a 10 días en la zona) de origen desconocido (16). Dichos pacientes asistieron a los centros de salud del Urabá antioqueño: Clínica Chinita, Clínica Urabá, Hospital de Necoclí, Hospital de Turbo, Hospital de Apartadó, Clínica Urabá, Serviucis, Clínica Central e IPS Universitaria entre junio de 2013 y noviembre de 2014; en el marco del macroproyecto titulado Aislamiento, caracterización y análisis epidemiológico de un Hantavirus detectado en Necoclí, Colombia (código Colciencias: 111554531578). Se tomó por punción venosa una muestra de sangre a los pacientes en fase aguda (el día de visita al centro médico), y otra durante la fase convaleciente de la enfermedad (aproximadamente dos semanas después).
Se incluyeron pacientes procedentes de áreas rurales y urbanas de Urabá, a quienes se les diligenció un consentimiento informado y una encuesta en el sitio de la consulta. Esta encuesta recogió información sobre variables clínicas y socioepidemiológicas. Se definieron como criterios de exclusión: individuos con muestra de suero pero sin historia clínica o viceversa, que tuvieran diagnóstico de otra enfermedad o que decidieran voluntariamente no participar (autoexclusión). Se incluyeron pacientes negativos por gota gruesa para malaria y que asistieron a los centros médicos de la zona.
Aspectos éticos
Los procedimientos realizados en el presente estudio fueron avalados por el Comité de Bioética de la Universidad de Antioquia mediante el acta n.° 017 del 14 de septiembre de 2017; los datos obtenidos se consolidaron en una base de datos anónima.
Inmunofluorescencia indirecta (IFI)
Se procesaron muestras de suero para la determinación de anticuerpos IgG contra Rickettsia spp. del GFM mediante la técnica de IFI (17-19), descrita por Londoño et al. 2017. Se utilizaron placas sensibilizadas con antígenos crudos de un aislamiento de R. rickettsii, cepa Uramita (cepa aislada y caracterizada en el grupo de investigación Centauro). En cada placa se incluyeron sueros de control positivo y negativo, se adicionaron 10 μL del conjugado (Anti-human IgG marcado con Isotiocianato de Fluoresceína, FITC). Anticuerpo producido en cabra (SIGMA 038K4846), usado a una dilución de 1:3200 en diluyente de muestra (20).
La lectura se realizó en un microscopio de fluorescencia (Nikon EFD-3®) con un objetivo 100X y 450 a 500 nm de longitud de onda. Las muestras se consideraron como positivas o negativas mediante la comparación con los controles. Se consideraron positivas las muestras con reactividad en la dilución 1:64 o mayor, y se realizaron diluciones seriadas dobles de las muestras hasta encontrar su título final. Se establecieron como enfermos aquellos casos donde se presentó seroconversión o serorefuerzo (aquellas que presentaron un alza cuádruple de anticuerpos en la muestra de la fase convaleciente con respecto a los títulos de la fase aguda), e infectados aquellos seropositivos que no hicieron seroconversión o serorefuerzo (21,22).
Análisis estadísticos
Se realizó un análisis descriptivo con las variables sociodemográficas, signos y síntomas de los participantes infectados y enfermos. Los resultados obtenidos se analizaron mediante el software de análisis estadístico SPSS (Statistical Package for the Social Sciences, vers. 24), licenciado por la Universidad de Antioquia.
RESULTADOS
Características sociodemográficas y clínicas de los participantes
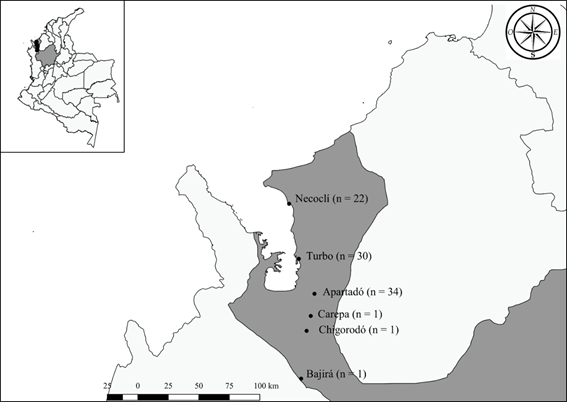
De los 89 pacientes febriles que ingresaron al estudio, el 66,3 % eran hombres, y la edad media de la población estudiada fue de 32,3 años (edad mínima de 9 y máxima de 80 años). Los pacientes residían en diferentes municipios de la región del Urabá, siendo 22 de ellos de Necoclí (24,7 %), 30 de Turbo (33,7 %), 34 de Apartadó (38,2 %) y 1 paciente por cada uno de los municipios de Chigorodó (1,1 %), Carepa (1,1 %) y el corregimiento de Belén de Bajirá (1,1 %) (Figura 1).
Se encontró que los pacientes provenían, en mayor proporción, de zonas rurales (55,7 %). Adicionalmente, un 77,9 % tenían como ocupación actividades en interiores como ama de casa, estudiante, comerciante, estilista, auxiliar de enfermería y electricista, entre otros. Un 22,1 % en exteriores, entre las que se encontraban labores de agricultor, bananero, palero en el río y militar. El 58,4 % de la población indicó que al momento de la encuesta convivían con animales domésticos en la casa, y el 73,3 % reportó haber tenido contacto con ectoparásitos. Sin embargo, en la encuesta no se discriminaron las especies de estos. Las condiciones higiénico-sanitarias para la mayoría de los pacientes eran deficientes, dado que el 56,3 % no poseía acueducto ni alcantarillado, el 79,3 % no contaba con agua potable y el 49,4 % no tenía servicio de recolección de basuras (Tabla 1).
Tabla 1 Descripción de las características sociodemográficas de los participante s
| Variable | n = 89* | % | ||
|---|---|---|---|---|
| Sexo | Femenino | 30 | 33,7 | |
| Masculino | 59 | 66,3 | ||
| Edad (años) | Media ± DE | 32 | 18,6 | |
| Grupos de Edad (años) | 0 a 14 | 11 | 12,4 | |
| 15 a 26 | 36 | 40,4 | ||
| 27 a 59 | 31 | 34,8 | ||
| > 60 | 11 | 12,4 | ||
| Municipio de origen | Apartadó | 34 | 38,2 | |
| Bajirá | 1 | 1,1 | ||
| Carepa | 1 | 1,1 | ||
| Chigorodó | 1 | 1,1 | ||
| Necoclí | 22 | 24,7 | ||
| Turbo | 30 | 33,7 | ||
| Zona | Urbana | 39 | 44,3 | |
| Rural | 49 | 55,7 | ||
| Ocupación | En interiores | 67 | 77,9 | |
| En exteriores | 19 | 22,1 | ||
| Animales domésticos | Sí | 52 | 58,4 | |
| No | 35 | 39,3 | ||
| Contacto con ectoparásitos | Sí | 63 | 73,3 | |
| No | 23 | 26,7 | ||
| Agua potable | Sí | 18 | 20,7 | |
| No | 69 | 79,3 | ||
| Recolección de basura | Sí | 44 | 50,6 | |
| No | 43 | 49,4 | ||
| Acueducto y alcantarillado | Sí | 38 | 43,7 | |
| No | 49 | 56,3 | ||
*Hubo pérdida de datos
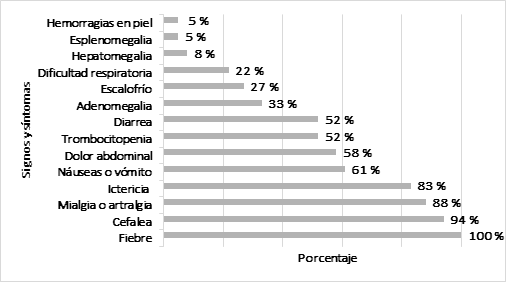
En cuanto a los signos y síntomas más frecuentes presentados por los pacientes se encontraron la fiebre, Figura 2. Porcentaje según los síntomas y signos de los participantes cefalea, ictericia, mialgias, náuseas, dolor abdominal, petequias, trombocitopenia y vómito (Figura 2).
Resultados serológicos
Se procesaron 149 muestras de suero de los 89 pacientes reclutados, de las cuales 89 correspondieron a la fase aguda y 60 a la fase convaleciente. Un 40,4 % (36/89 pacientes) fueron seropositivos, por lo menos, en una de las dos muestras con títulos de IgG entre 64 y 512. De esos pacientes, 30 no presentaron alza cuádruple entre las muestras, lo cual indicó que un 33,7 % tuvieron una infección previa al episodio febril.
De las personas seropositivas, se encontró que la mayoría fueron hombres (70,0 %). El rango de edad estuvo entre 15-77 años y la mediana fue de 28,5 años. En cuanto a la ocupación, el 70,0 % de los pacientes positivos realizaban sus actividades en interiores, principalmente amas de casa. Para el municipio de origen se observó que, de 30 seropositivos, 33,3 % (10/30) provenían de Apartadó, 33,3 % (10/30) de Necoclí y 33,3 % (10/30) de Turbo. Un alto porcentaje de los participantes reportaban tener animales domésticos (perros, aves, equinos, entre otros) (63,3 %) y presencia de ectoparásitos (76,7 %) en su domicilio (Tabla 2).
Tabla 2 Porcentaje de los participantes seropositivos según las variables sociodemográficas
| Variable | n = 30* | % | |||
|---|---|---|---|---|---|
| Sexo | Femenino | 9 | 30,0 | ||
| Masculino | 21 | 70,0 | |||
| Grupos de edad | 15 a 26 | 14 | 46,7 | ||
| 27 a 59 | 12 | 40,0 | |||
| Mayores de 60 | 4 | 13,3 | |||
| Municipio de origen | Apartadó | 10 | 33,3 | ||
| Necoclí | 10 | 33,3 | |||
| Turbo | 10 | 33,3 | |||
| Raza | Afroamericana | 3 | 10,0 | ||
| Mestiza | 25 | 83,3 | |||
| Zona | Urbana | 11 | 36,7 | ||
| Rural | 18 | 60,0 | |||
| Ocupación | En interiores | 21 | 70,0 | ||
| En exteriores | 7 | 23,3 | |||
| Animales domésticos | Sí | 19 | 63,3 | ||
| No | 9 | 30,0 | |||
| Contacto con ectoparásitos | Sí | 23 | 76,7 | ||
| No | 5 | 16,7 | |||
| Agua potable | Sí | 4 | 13,3 | ||
| No | 24 | 80,0 | |||
| Recolección basuras | Sí | 12 | 40,0 | ||
| No | 16 | 53,3 | |||
| Acueducto y alcantarillado | Sí | 12 | 40,0 | ||
| No | 16 | 53,3 | |||
*Hubo pérdida de datos
Enfermedad
Al estudiar y comparar los títulos de los anticuerpos se encontró que seis (16,6 %) de los pacientes con síndrome febril positivos por IFI, presentaron seroconversión o serorefuerzo con un alza cuádruple de anticuerpos entre la muestra de la fase convaleciente y fase aguda. El título más alto encontrado en ellos fue de 128 en la muestra de la fase aguda, y de 512 en la muestra de la fase convaleciente (Tabla 3).
DISCUSIÓN
El presente estudio reveló una seropositividad del 40,4 % en pacientes febriles no maláricos, una frecuencia de infección previa por rickettsias del 33,7 % y rickettsiosis en seis de estos pacientes, provenientes de los municipios de Apartadó, Chigorodó, Necoclí y Turbo. Lo anterior permite evidenciar que la infección y la enfermedad por rickettsias del GFM continúa presentándose en zonas como el Urabá antioqueño, además de no estar limitada únicamente a los municipios de Turbo y Necoclí, donde se han realizado reportes en años anteriores (9,11).
En cuanto al reporte de FMMR en Latinoamérica, Brasil es el país con el mayor número de casos registrados, entre 1995 y 2004 hubo 334 casos confirmados, con una mortalidad del 31 % (23). El Salvador, Honduras y Nicaragua han demostrado evidencia serológica de infección humana y/o animal por los grupos de las fiebres manchadas, con cifras que varían según la endemicidad del área, pero que han permitido identificar zonas de circulación de rickettsias del GFM con metodología similar a la aplicada en nuestro estudio (6,24). Estos datos nos muestran una mayor seropositividad comparada con trabajos previos en la región, como es el caso del estudio de Quintero et al. (2013), donde se encontró una seropositividad del 24 % en pacientes provenientes de los municipios de Apartadó, Necoclí y Turbo (25); y similar a la encontrada por Padmanabha et al. (2008), donde se obtuvo una prevalencia del 29,2 % en una muestra de 642 personas de Necoclí (26). Las diferencias observadas podrían ser explicadas por la desigualdad en los diseños metodológicos, el tipo de muestreo y los períodos de reclutamiento de los pacientes en cada uno de los estudios.
En cuanto a los títulos de los anticuerpos encontrados en los pacientes con la enfermedad, se detectó que fueron bajos, en contraste con la sintomatología presentada y con lo reportado en el trabajo realizado por Quintero et al. (2013), en esta zona del Urabá, donde se observó una reactividad hasta una dilución de 1:131072 en dos de los pacientes sintomáticos de Turbo (25). Los títulos más bajos en el presente estudio pueden deberse a que los pacientes hayan sido infectados por otras especies de rickettsias menos virulentas tales como R. felis o R. parkeri (27). El estudio de Londoño et al., en la región reportó Rickettsia sp. cepa Atlantic rainforest, la cual es considerada como una cepa de R. parkeri, vinculada como agente causal de una rickettsiosis con sintomatología menos grave que la FMMR en Brasil (28). La circulación de esta Rickettsia en la zona puede sugerir que la población en esta región podría estar expuesta a sufrir una enfermedad menos sintomática que pudiera estar pasando desapercibida y subdiagnosticada.
Aunque el ensayo de IFI es el método de referencia para el diagnóstico de rickettsiosis, presenta limitaciones debido a la reacción cruzada que existe entre las diferentes especies del género Rickettsia, por lo cual, estos títulos y la severidad de los síntomas pudieron ser debidos a otras especies diferentes a R. rickettsii (21,22). De acuerdo con lo anterior, para futuros estudios se sugiere explorar los resultados obtenidos con otras especies de Rickettsia a través de IFI, con el fin de identificar el antígeno más probablemente involucrado en una reacción homóloga, identificado por inmunoprecipitación o por otras técnicas alternas.
Reportes recientes de casos de rickettsiosis en Antioquia (14) y Meta (15), indican que la infección por diferentes especies de rickettsias es un evento que se ha estado presentando en diferentes lugares del país, y que el panorama continúa siendo desconocido para el personal de la salud.
Lo anterior, sumado al hecho de que no se cuenta con un diagnóstico en fase aguda y no se puede confiar en la diferenciación clínica, implica un gran impacto en la salud pública por el riesgo potencial de muerte o secuelas permanentes para la población de estas zonas.
Entre las manifestaciones clínicas que presentaron los pacientes con la enfermedad se incluyó la fiebre (temperatura mayor a 38 °C), cefalea, malestar general, mialgias, artralgias, vómito y dolor abdominal, entre otras; las cuales han sido también reportadas en casos de otros países latinoamericanos como México, Costa Rica, Panamá, Brasil y Argentina (29-32). Estas manifestaciones son compartidas con otras entidades infecciosas que se presentan en la zona, tales como el dengue y Leptospira.
Aunque las rickettsiosis no tienen signos patognomónicos, existen síntomas sugestivos como presencia de fiebre, erupción cutánea, linfadenopatía y escaras de inoculación (33). Otro hallazgo común en esta enfermedad son las alteraciones hematológicas como la trombocitopenia. Esta podría deberse en parte a la afinidad de la bacteria por las células endoteliales, lo que generaría un desgaste de las plaquetas al ser estimuladas dentro de la vía de la coagulación en un esfuerzo por contrarrestar el daño generado por las bacterias.
Vale recordar que dicha trombocitopenia se logró observar en cuatro de los pacientes que presentaron la enfermedad (34). No en todos los casos de rickettsiosis se van a presentar estos signos y síntomas, por lo tanto, la rickettsiosis se debe incluir como diagnóstico diferencial en los síndromes febriles en la región.
Un 63,3 % de los pacientes seropositivos para Rickettsia spp., reportaron contacto con animales domésticos tales como perros y equinos, los cuales previamente han sido vinculados como centinelas de la infección en la zona, por ejemplo, en el trabajo de Quintero et al. (2017), se mostró seropositividad de los animales domésticos y la asociación con un indicador del estado serológico de los humanos, donde muestran una seropositividad en humanos de 3,1 veces mayor en las zonas donde los animales tenían una seropositividad mayor del 40 %, comparada con las zonas donde la seropositividad era menor del 20 % (35). De esta forma, se evidencia la importancia de estudiar la seropositividad en los animales domésticos en estudios futuros, los cuales se comportan como centinelas de la enfermedad y hacen parte del ciclo de vida de la garrapata (36,37).
Finalmente, aunque todos los pacientes seropositivos manifestaron ver ectoparásitos en sus viviendas, esta variable no fue útil, ya que no se discriminaron. En caso de haberse diferenciado, sería de importancia verificar la presencia y tipo de garrapatas, ya que estas se incluyen dentro de los principales vectores de la bacteria para cumplir funciones de reservorio y vector, claves para la diseminación de la infección (4).
CONCLUSIÓN
Los síndromes febriles causados por rickettsias, en especial por R. rickettsii, son enfermedades severas que pueden llegar a ser letales. Sin embargo, si se da el tratamiento oportuno (doxiciclina), se puede prevenir este tipo de consecuencias. De aquí la importancia de poder diagnosticar las rickettsias de forma adecuada y oportuna. Además, los hallazgos de este estudio confirman la importancia de Rickettsia del GFM en la región del Urabá antioqueño como causante de la infección y como uno de los agentes relacionados con el síndrome febril en este lugar, dada la baja especificidad de las manifestaciones clínicas de los síndromes febriles, la dificultad para el diagnóstico y el poco conocimiento que tiene el personal médico, acerca de las rickettsiosis. En consecuencia, se hace evidente la necesidad de mejorar la disponibilidad y oportunidad de los recursos para su diagnóstico diferencial, con el fin de aportar a las medidas de control y prevención en la zona, ya que es muy probable que esta infección esté siendo subdiagnosticada.
De igual forma, se hace mandatorio instaurar el tratamiento inmediato, en casos compatibles (sospechosos), para evitar consecuencias trágicas (tales como la muerte o las secuelas permanentes), ocasionadas por infecciones para las que existe una terapia efectiva.