EPIDEMIOLOGÍA
El dengue es una enfermedad infecciosa causada por un virus que recibe el mismo nombre (DENV) (1,2), del cual, se han identificado a la fecha cuatro serotipos: DENV-1, DENV-2, DENV-3 y DENV-4 (3). Recientemente se propuso la existencia del DENV-5 (4); sin embargo, es importante aclarar que todavía se considera un hallazgo controversial. Este virus es transmitido por mosquitos del genero Aedes, principalmente Ae. aegypti y Ae. albopictus (5). La localización geográfica del DENV depende directamente de la ecología y la distribución de sus vectores, siendo las zonas tropicales y subtropicales las más afectadas por esta enfermedad (6).
Según la OMS, el número de casos de dengue ha aumentado hasta 30 veces en los últimos 50 años en el mundo (5), produciendo aproximadamente 96 millones de infecciones anuales (5,7-10). Este incremento en los casos se debe a varios factores, entre ellos al aumento de la temperatura del planeta y a una distribución más amplia de los vectores (6,9). Dentro de las zonas de más alta incidencia del dengue se encuentran las regiones del sudeste de Asia, el Pacífico occidental, el Cono Sur de América, la Región Andina y Centroamérica (5).
Actualmente, el continente americano contribuye con el 14 % de los casos mundiales reportados, que corresponde entre 9 a 18 millones de las infecciones anuales. Esto provoca una alta carga económica sobre los servicios de salud en esta región, cuyos gastos ascienden aproximadamente a 2,1 billones de dólares estadounidenses anuales, superando los costos de otras enfermedades virales (8,10).
Los únicos países que presentan los cuatro serotipos del virus dengue en Suramérica son Colombia, Venezuela y Perú, siendo Colombia quien ha reportado más muertes por esta causa (5).
Según el Instituto Nacional de Salud de Colombia, la incidencia de esta enfermedad ha ido en aumento en la última década (11). El informe epidemiológico realizado a finales del 2017 indicó una incidencia de 92,7 casos por cada 100.000 habitantes, con un total de 26.279 casos reportados para ese año, de los cuales el 1,1 % correspondieron a dengue grave (11).
GENERALIDADES Y REPLICACIÓN DEL VIRUS DENGUE
El dengue es un virus envuelto perteneciente a la familia Flaviviridae, cuyos serotipos varían del 25 al 40 % en su secuencia de aminoácidos y además se divide en genotipos que divergen aproximadamente en el 3 % de su secuencia (12). Los viriones del DENV son estructuras de 50 nm de diámetro que están compuestas por tres proteínas estructurales: cápside (C), premembrana (PrM) o membrana (M) y envoltura (E) (9,12-14). Varias copias de la proteína C encapsulan el genoma (ARN) de polaridad positiva de 10,7 kb, formando una envoltura de simetría icosaédrica, la cual está cubierta por una bicapa lipídica derivada de la célula del hospedero, que contiene aproximadamente 180 copias de las proteínas M y E (13).
Este virus ingresa al ser humano por vía cutánea a través de la picadura de un mosquito hembra infectado, interactuando, inicialmente, con las células residentes de la dermis, especialmente las dendríticas y los macrófagos (15) (Figura 1).
El reconocimiento de las proteínas de la envoltura viral por los receptores presentes en estas células blanco, conlleva a su infección (Figura 1). Entre estos receptores tenemos el del lipopolisacárido (CD14), el de manosa (CD206), la molécula de adhesión de las células dendríticas DC-SIGN (CD209) y las proteínas de choque térmico HSP90/HSP70 ancladas a la membrana plasmática, entre otros (16). Este proceso de reconocimiento lleva principalmente a una endocitosis del virus mediada por clatrina (16). Adicionalmente, se ha descrito una vía de endocitosis que depende de anticuerpos denominada ADE (del inglés antibody-dependent enhancement), mediada por receptores para la fracción cristalizable (Fc) de las IgG (FcγR), la cual se ha asociado con el desarrollo de manifestaciones graves de la enfermedad. Esta vía de ingreso ocurre principalmente en infecciones secundarias con un serotipo distinto al inicial, en las cuales los anticuerpos que se producen y recubren las partículas virales son subneutralizantes (17).
Posterior a la internalización y formación del endosoma, ocurren cambios conformacionales en la proteína viral E por la reducción del pH (18), que conducen a la fusión de la envoltura viral con la membrana endosomal y a la formación de un poro que libera el ARN viral al citoplasma (19). El ARN viral liberado va al retículo endoplasmático, donde ocurre la traducción a poliproteína y una segmentación en tres proteínas estructurales: C, M, E, y otras siete proteínas no estructurales (NS1, NS2a, NS2b, NS3, NS4a, NS4b, NS5).
La proteína E tiene varias funciones como la unión a receptores de lectina tipo C, heparán sulfato y CD14 (12,16,20,21), que permiten la internalización del virus; esta proteína también media la fusión del virión con la membrana del endosoma en células blanco. La proteína M interactúa con la proteína E, permitiendo la estabilidad de esta última y su respectiva interacción con los receptores mencionados (22,23). Las proteínas NS participan en la replicación viral (24) y en la patogénesis de la enfermedad (22); por ejemplo, la NS5 es una metiltransferasa que sirve como ARN polimerasa dependiente de ARN (25-27).
La NS1 se considera un patrón molecular asociado a patógenos (28), que es reconocido por el TLR-4 (del inglés toll like receptor-4); esto último se ha demostrado en estudios in vitro, en los cuales se obervó un aumento en la expresión del ARN mensajero de citoquinas, como IL-6 y el TNF- α en CMSP (células mononucleares de sangre periférica) humanas y macrófagos de ratones expuestos a la proteína NS1, proceso que fue revertido con el uso de un anticuerpo antagonista contra el TLR-4 (28).
El ensamblaje de los viriones ocurre en el retículo endoplásmico por la interacción de las proteínas C con el ARN de polaridad positiva, sintetizado para formar la nucleocápside (24). La maduración del virión se da en la red Trans-Golgi, dependiente del pH y de las proteasas furinas, las cuales escinden el factor Pr de la proteína M, permitiendo su correcta interacción con la proteína E; esto le da la simetría icosaédrica al virus (12). Posterior a esta maduración, se libera el DENV al medio extracelular mediante exocitosis, sin que se altere la integridad celular, al tiempo que permite que la célula infectada continúe produciendo más viriones.
INMUNOPATOLOGÍA DEL DENGUE
Se ha propuesto que el DENV interactúa en la dermis, inicialmente con células residentes como las dendríticas, macrófagos tisulares y mastocitos (29,30) (Figura 1), con las dos primeras como los blancos principales del virus (31,32). Sin embargo, se ha demostrado que posteriormente el virus infecta células que han sido reclutadas a la dermis como monocitos y células dendríticas derivadas de monocitos (moDCs) (33). Las células infectadas, especialmente las dendríticas, migran a los nódulos linfáticos regionales para realizar la presentación antigénica y así activar la respuesta inmune adaptativa (Figura 1); se cree que de esta forma el virus alcanza estos tejidos y una vez allí, los macrófagos y los monocitos reclutados son a su vez infectados por DENV (3). Como resultado de esta primera viremia, la infección se amplifica y el virus se disemina por el sistema linfático, llegando posteriormente a sangre periférica y a distintos órganos, en los cuales infecta células como monocitos (Figura 1), células dendríticas (34), hepatocitos (35), células endoteliales (36), macrófagos esplénicos y células de Kupffer (37,38). Todo esto ocurre durante los tres primeros días del inicio de los síntomas, en los cuales se reportan los picos de la viremia en la sangre periférica (5).
Adicionalmente, los fagocitos mononucleares que entran en contacto con el virus pueden promover una respuesta para eliminar la infección, mediante el reconocimiento del DENV por receptores intracelulares como el TLR-3 que reconoce el ARN viral de doble cadena que se forma cuando DENV está en el proceso de replicación (39); también estarían los TLR-7 y TLR-8 que reconocen ARN de cadena sencilla, y los sensores citoplasmáticos como la proteína inducible por ácido retinoico (RIG-I) y la proteína de diferenciación asociada al melanoma (MDA-5), que también reconocen ARN de doble cadena (12,20,40).
Estos receptores conducen a la activación de los factores reguladores del interferón (IRF) 3 y 7, que inducen la producción de interferones tipo uno (IFN-I) (Figura 1), los cuales tienen una alta actividad antiviral intrínseca (12,20) que se asocia con una resolución de la infección sin manifestaciones graves de la enfermedad (41). Además, se promueve la vía del factor nuclear kappa B (NF-κB) y la producción de citoquinas proinflamatorias como el TNF-α e IL-6, y de quimioquinas como CCL5 y CXCL12 (40). Estos factores solubles permiten la activación de otras células, como las endoteliales y mastocitos, las cuales amplifican la respuesta mediante la liberación de más mediadores solubles, mencionados previamente, al igual que otros promotores de inflamación como los derivados lipídicos (42).
Las infecciones por DENV generalmente se autoresuelven rápidamente. Estas se manifiestan con fiebre, mialgia, dolor muscular generalizado, vómito, dolor retroocular, entre otros síntomas. Se presentan entre los 4-10 días posteriores a la inoculación del virus. Sin embargo, menos del 5 % de los casos pasan a ser dengue grave, caracterizado por un aumento en la permeabilidad vascular que lleva a la pérdida de plasma sanguíneo y la hemoconcentración. Generalmente está acompañado de una caída en el número de plaquetas y de una acumulación de líquidos en la región pleural o peritoneal, además, se pueden presentar cuadros de hemorragia grave y, en algunos casos, insuficiencia multiorgánica que puede causar la muerte del individuo si no es tratada a tiempo (5).
DENGUE GRAVE
Aún no son claras las causas por las cuales algunas personas desarrollan dengue grave, pero se ha propuesto que gran parte del desarrollo de esas manifestaciones está determinado por la interacción del virus con diversos componentes del sistema inmune del hospedero (9).
Dentro de los elementos del sistema inmune que se han asociado con el desarrollo de gravedad se han propuesto el ADE, basados en la premisa de que la mayoría de los casos de dengue grave ocurren en una infección secundaria tanto de niños como adultos (17). Este fenómeno se ha validado in vitro mediante el uso de sueros en pacientes que cursaron una infección secundaria por DENV en una línea celular de fibroblastos de ratón (BHK-21), que expresaron o no el FcyR.
Se observó que los anticuerpos subneutralizantes existentes en el suero, aumentaron la infección de las células que exprensaban el FcyR al compararse con las células de control (43). Resultados concordantes se han encontrado in vivo en el que ratones AG129 fueron inoculados intraperitonealmente con el suero de ratones sanos o de ratones infectados previamente con DENV-1.
Después de 24 horas los ratones fueron retados con DENV-2, se encontró que los animales expuestos a los sueros de los ratones infectados murieron a causa de la infección, mientras que los animales de control no lo hicieron. Estas y otras evidencias sugieren que el ADE puede estar aportando no solo al aumento de la infección de células blanco, sino también al desarrollo de la gravedad en los pacientes con dengue (44).
Por otro lado, la tormenta de citoquinas es uno de los fenómenos más importantes y ampliamente asociados con la agudización de la enfermedad. Se ha propuesto que se presenta cuando hay una carga viral inicial alta, junto con la activación de un gran número de células como monocitos, macrófagos, mastocitos y los linfocitos T, lo que lleva a un incremento en los niveles circulantes de citoquinas como TNF-α, IL1β, IL-2, IL-6, IL-8, IL-10, IFN-γ, entre otras (45-48) (Figura 1). Este incremento en las citoquinas séricas por DENV se ha evidenciado in vivo (49) y una asociación entre la presencia de estos mediadores y el compromiso tisular se ha desmotrado in vitro. Por ejemplo, se ha observado que el TNF-α o sueros de pacientes infectados tienen un efecto directo sobre las monocapas de las células endoteliales, disminuyendo así la expresión de las proteínas de la unión intercelular como la cadherina-VE (50) y ZO-1 (51), lo que lleva a la pérdida de la integridad endotelial. Además de estos factores, también se ha propuesto que los mediadores lipídicos y las aminas vasoactivas pueden aportar al daño endotelial directo, ya que factores como el activador de plaquetas (PAF) reducen la expresión de ZO-1 en células endoteliales (52), así como inducen el NF-κB, que a su vez conduce a la producción de las citoquinas citadas previamente (53,54).
A pesar de esto, es importante mencionar que existen evidencias contradictorias referentes a las citoquinas plasmáticas y a los niveles de las mismas en los pacientes con dengue (51,55). Aún no existe un consenso sobre los factores inmunológicos y no inmunológicos que están llevando a los pacientes a desarrollar dengue grave.
PAPEL DE LOS MONOCITOS Y SUS SUBPOBLACIONES EN LA INFECCIÓN POR DENV
Los fagocitos mononucleares representan un subgrupo de leucocitos de origen mieloide, son descritos como una población que circula en la sangre en forma de monocitos y que pueden poblar los tejidos como macrófagos (56). Cabe resaltar que la mayoría de los autores también incluyen a las células dendríticas dentro de este sistema celular (56). Los monocitos maduran a partir de células madre mielomonocíticas presentes en la medula ósea, pasan a la circulación sanguínea y de allí a colonizar los tejidos, al parecer, principalmente en respuesta a un estímulo exógeno o durante un proceso inflamatorio (57). Sin embargo, en los últimos años se ha demostrado que en un estado de reposo pueden existir reservas de monocitos en los tejidos del bazo, pulmón y piel, que cumplen funciones de patrullaje, donde posteriormente pueden migrar a nódulos linfáticos y presentar antígenos a los linfocitos T (58,59).
En el contexto de la infección por DENV se ha observado que los monocitos son las células que permiten una mayor infección y replicación viral en la sangre periférica (60-62) (Figura 1). Esto se ha demostrado en modelos in vitro de infección por DENV, en los cuales CMSP infectadas con el serotipo 2 con una multiplicidad de infección (MOI) de cinco, tuvieron un mayor porcentaje de células positivas para la proteína viral E en los monocitos CD14+ (con un 4,34 %), al compararse con los linfocitos CD3+ y CD19+ (del 0,02 % y 0,4 %, respectivamente) (60). Algo análogo se observó en pacientes con dengue durante la etapa febril de la enfermedad, en los cuales se encontró que los monocitos fueron las principales CMSP positivas para el antígeno viral PrM (61).
Un patrón semejante se ha observado ex vivo en niños menores de 14 años infectados con DENV, en los cuales se ha encontrado un mayor porcentaje de células positivas y una intensidad media de fluorescencia aumentada para la proteína viral PrM en los monocitos (63).
Además de ser uno de los principales blancos de la infección, los monocitos también se activan y responden al DENV mediante el reconocimiento del ARN viral por medio de los receptores TLR-7, TLR-8, RIG-1 y MDA-5, previamente mencionados (12,20), lo que lleva a la producción de IFN-I y de citoquinas proinflamatorias como el TNF-α, IL-1β, IL-6 e IL-8, por monocitos humanos infectados in vitro con DENV-2 (64-66) (Figura 1). Este aumento en la producción de citoquinas por parte de los monocitos tambien se ha observado ex vivo en niños infectados con dengue, en los cuales se observó un aumento en el porcentaje de monocitos productores de TNF-α e IL-6 al compararse con los controles sanos (67). Esto podría estar contribuyendo con la tormenta de citoquinas y las alteraciones en la permeabilidad vascular vistas en pacientes infectados con DENV (68).
La activación de monocitos se ha observado en pacientes con dengue, en los cuales se encuentra un aumento en el porcentaje de estos fagocitos que expresan ICAM-1 (molécula de adhesión intercelular), TLR-2 y TLR-4 al ser comparados con controles sanos (69); una inducción similar en la expresión de TLR2 se observa al infectar in vitro monocitos humanos con DENV-2 (69). Otro estudio también reportó un perfil activado (CD32+, CD86+, CD11c+) de los monocitos CD14+ en pacientes con dengue (61). Así mismo, el estado activado de los monocitos durante la infección se ha corroborado por el aumento en la expresión de la enzima óxido nítrico sintetasa inducible (iNOS), tanto en las células circulantes positivas para el virus como en las infectadas in vitro, al compararse con controles sanos y células no infectadas (62).
Se ha evaluado el efecto de los factores solubles producidos por estas células monocíticas activadas sobre las células endoteliales de microvasculatura humana (HMVEC), como por ejemplo las THP-1 infectadas con DENV-2, que redujeron la resistencia eléctrica transendotelial, lo que se interpreta como una menor integridad del endotelio y una mayor permeabilidad endotelial (70). Este daño de las células endoteliales también se ha observado en un sistema transwell en el que se ponen en contacto células HUVEC con sobrenadantes de monocitos primarios infectados con DENV-2 para evaluar el paso de la proteína peroxidasa de rábano picante conjugada con estreptavidina (71). Todo esto sugiere que la infección in vitro e in vivo con DENV induce la activación de los monocitos, con la consecuente producción de mediadores inflamatorios que pueden aportar en gran medida a la tormenta de citoquinas y al compromiso vascular visto en esta enfermedad (Figura 1).
Los monocitos humanos circulantes se pueden dividir en tres subpoblaciones de acuerdo a la expresión del receptor de membrana del lipopolisacarido (LPS) CD14 y del CD16, un FcγR de baja afinidad (FcγRIII), isoforma A. Teniendo en cuenta lo anterior se pueden encontrar los monocitos clásicos (CD14++CD16-), los no clásicos (CD14+CD16++) y los intermedios (CD14++CD16+) (72). En individuos sanos, la subpoblación de monocitos clásicos se encuentra en mayor porcentaje (80-90 %) respecto a los no clásicos (10-15 %) y los intermedios (1-5 %) (73). Los monocitos clásicos e intermedios se caracterizan por la expresión de los receptores de quimioquinas CCR2 y CCR5 con niveles bajos de CX3CR1, que contrastan con los monocitos no clásicos, los cuales tienen menor expresión de CCR2 y de CCR5, pero sí grandes cantidades de CX3CR1 (74). También se ha descrito que los monocitos clásicos al estimularse con LPS producen principalmente IL-10 y pocas cantidades de TNF-α, además de expresar más receptores scavenger (barrenderos o pepenadores) en comparacion con las otras dos supoblaciones. Estas células tienen una mayor interacción con el endotelio de macrovasculatura (56,73-76). Por otra parte, los monocitos no clásicos son los principales productores de TNF-α frente a la estimulación con LPS, poseen una mayor expresión de TLRs comparados con los clásicos, por lo que se consideran los más proinflamatorios. Esto se ha demostrado en algunos modelos de enfermedades infecciosas como la tuberculosis; dichas células, además, son las encargadas de la vigilancia y homeostasis del endotelio de microvasculatura (56,73-76). Los monocitos intermedios producen baja cantidad de IL-10 y de TNF-α frente a la estimulación con LPS en comparacion con los monocitos clásicos y no clásicos, respectivamente, expresan más HLA-DR y al parecer no interactúan con células endoteliales (56,73-76).
Aún se desconoce en gran medida el papel que desempeñan estas subpoblaciones de monocitos dentro de la inmunopatología del dengue y en su gravedad. No obstante, teniendo en cuenta que los monocitos no clásicos son una fuente importante de TNF-α, entre otros factores proinflamatorios (77), además de que son los que interactúan preferiblemente con células endoteliales de microvasculatura (78), es posible proponer que estos fagocitos deben tener un papel importante en la inmunopatología de la enfermedad (Tabla 1 y Figura 1). En el año 2010, Azeredo et al., encontraron una mayor expresión de CD16 en los monocitos de pacientes con dengue durante la fase febril de la enfermedad, así como con la infección in vitro de monocitos de individuos sanos con DENV-2 (69). Adicionalmente, observaron mayores porcentajes de la subpoblación intermedia en los pacientes con las formas moderadas (definido como conteo de plaquetas por encima de 100000/mm3 sin hipotensión, 12 %) y graves (definido como conteo de plaquetas por debajo de 100000/mm3 con hipotensión 8 %) de la enfermedad comparados con los controles sanos (5 %); también se encontró una disminución de la subpoblación clásica en los casos moderados (56 %) y severos (65 %) en contraste con los sanos (77 %) (69) (Tabla 1).
Tabla 1 Subpoblaciones de monocitos en pacientes con dengue y la respuesta de estos fagocitos en DENV
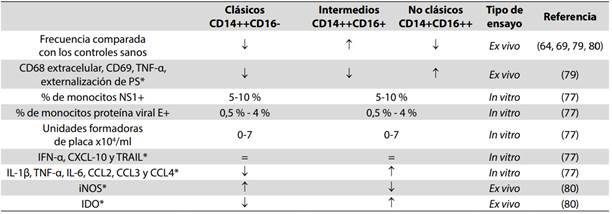
IFN-α: interferon alfa; TRAIL: ligando inductor de apoptosis relacionado con el factor de necrosis tumoral; IL: interleuquina; TNF-α: Factor de necrosis tumoral alfa; PS: Fosfatidilserina; iNOS: sintasa de óxido nítrico inducible; IDO: indolamina 2 3-dioxigenasa. *Resultados comparando entre las subpoblaciones de monocitos.
Mediante la infección in vitro con DENV-2 de las subpoblaciones de monocitos CD14+ (tanto CD16+ como CD16-) obtenidas a partir de sangre periférica de individuos sanos, Wong et al., (77) observaron una susceptibilidad similar a la infección y unos niveles de producción de los factores antivirales IFN-α, CXCL10 y TRAIL, comparables entre ambas subpoblaciones (Figura 1).
Además, se encontró que los monocitos CD16+ secretaron más TNFα, IL-1β, IL-6, y quimioquinas del tipo CCL-2 y CCL-4 en respuesta a la infección (Figura 1). Los autores sugirieron que la subpoblación no clásica, posiblemente, está mediando una actividad más protectora que podría estar asociada, en parte, con un reclutamiento de células hacia el tejido infectado. Teniendo en cuenta estos resultados y que el TNFα y el CCL2 están relacionados con la permeabilidad vascular (50,51), esta subpoblación no clásica podría estar contribuyendo preferencialmente con la tormenta de citoquinas además de estar participando en la alteración del endotelio observada en los pacientes con formas graves de dengue. De hecho, nosotros hemos obervado que son los monocitos no clásicos los que presentan una mayor expresión de marcadores de activación como por ejemplo CD69, CD68 extracelular, un mayor porcentaje de células TNFα+ y que han externalizado la fosfatidilserina (PS+) en pacientes infectados con dengue, al compararlos con las otras subpoblaciones de monocitos y con controles sanos (79) (Tabla 1 y Figura 1).
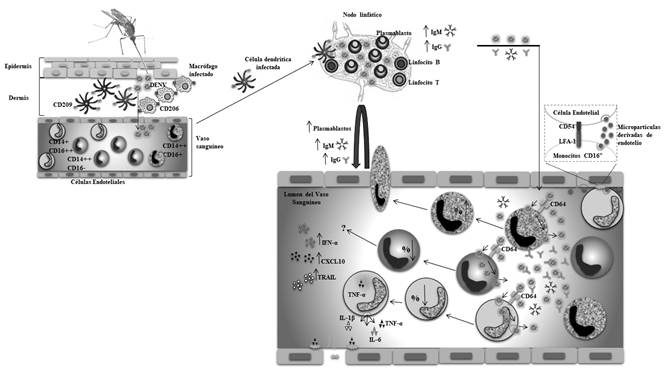
Figura 1 Potencial participación de las subpoblaciones de monocitos en la inmupatología del dengue. El virus ingresa por via cutánea interactuando inicialmente con células residentes de la dermis (29, 31-33); posteriormente se produce la replicación viral y la producción de anticuerpos en los nódulos linfáticos, generando un aumento tanto de los viriones como de los niveles de IgM e IgG en la sangre (81); una vez en el torrente sanguíneo, el virus dengue interactúa principalmente con los monocitos (60, 77), provocando la disminución en el porcentaje de la supoblacion clásica (CD14++CD16-), junto con un aumento de la subpoblación intermedia (CD14++CD16+), la cual esta asociada a una retroalimentación positiva en la producción de plasmablastos y con esto un incremento en los niveles de anticuerpos, pontenciando posibles procesos de ADE (64). Además se produce la disminución de la subpoblación no clásica (CD14+CD16++), que tiene como función basal la vigilancia del endotelio (76), y son las células que contribuyen principalmente con la produccion de citoquinas proinflamatorias asociadas a la disrupción de la integridad endotelial frente al virus dengue (64, 67, 69, 77, 79, 80).
Kwissa et al., (64) observaron por citometría de flujo un aumento estadísticamente significativo del porcentaje de monocitos a expensas de la subpoblación intermedia, en los estadios agudos de la enfermedad en humanos y primates no humanos infectados con DENV-2. En estos últimos, se observó un claro aumento de los monocitos intermedios circulantes en los días 1-3 postinfección y se encontró un número alto de estos monocitos intermedios en los nódulos linfáticos drenantes al tercer día (Tabla 1). Además, mediante un cocultivo observaron que la subpoblación de monocitos intermedios infectados con DENV-2 indujo la diferenciación de células B autólogas a plasmablastos productores de IgM, de forma dependiente de las citoquinas BAFF, APRIL e IL-10; sugiriendo que la infección por DENV produce un aumento de los monocitos intermedios, los cuales promueven la diferenciación de las células B a plasmablastos, lo que podría llevar a un aumento de anticuerpos de baja afinidad contra el virus.
El aumento en plasmablastos y anticuerpos de baja afinidad se ha descrito previamente en pacientes con dengue (80), lo que al parecer podría promover el incremento en la carga viral del individuo por medio de ADE, incluso desde infecciones primarias (64).
Por último, en un estudio realizado recientemente en pacientes infectados con DENV-4 provenientes de Brazil, se encontró que la expresión de la iNOS fue mayor en los monocitos CD16- comparados con los monocitos CD16+, mientras que estos últimos tuvieron mayor expresión de la indolamina 2 y 3-dioxigenasa (IDO) (Tabla 1). Sugiriendo que, si bien ambas clases de monocitos se activan en respuesta a la infección, la presencia de iNOS debe estar ayudando a controlar el virus en los monocitos clásicos, mientras que los bajos niveles de esta enzima en los monocitos CD16+, así como el aumento en IDO, sugieren que estas células podrían estar promoviendo la generación de Linfocitos T reguladores en el contexto de la infección y, posiblemente, promoviendo la diseminación viral (81).
Además, también es poco lo que se conoce del papel de las subpoblaciones de monocitos en otras infecciones virales. Por ejemplo, se ha observado en pacientes con VIH-1 un aumento en la frecuencia de los monocitos intermedios con infección aguda, con un aumento en su expression de HLA-DR al compararse con controles sanos. También se observó una disminución en la frecuencia de los monocitos clásicos en estos pacientes. Los monocitos no clásicos, por su parte, solo se encontraron disminuidos en los pacientes con infección crónica (82). Los monocitos clásicos humanos expuestos a los virus de sarampión y herpes simplex tipo I produjeron altos niveles de IL-6 e IL-8, mientras que los no clásicos secretaron una baja cantidad de estas citoquinas, pero niveles significativamente mayores de TNFα-, IL-1β y CCL3 en respuesta a estos virus, por una vía dependiente de TLR-7, TLR-8 y MyD88 (78).
CONCLUSIONES Y PERSPECTIVAS
Las evidencias recopiladas en esta revisión dejan claro que los monocitos tienen un papel protagónico, pero dual, en la infección por DENV. Participan en el control de la viremia gracias a la produccion de factores antivirales como el IFN-α, pero también tienen un papel importante en el desarrollo de la infección, al ser una de las principales células blanco. Esto, junto con la alta capacidad que tienen estos fagocitos de producir citoquinas proinflamatorias frente a la infeccion por DENV, permite concluir su importancia durante la inmunopatología de la enfermedad y su potencial papel en la tormenta de citoquinas, el aumento en la permeabilidad endotelial y, finalmente, en el desarrollo del dengue grave.
Por otro lado, los pocos estudios que existen sobre las subpoblaciones de monocitos en la inmunopatología del dengue, apuntan a que existe un papel diferencial de cada subpoblación (Tabla 1 y Figura 1). Teniendo en cuenta las diferencias funcionales y fenotípicas que poseen estas células de forma basal, así como en diferentes modelos inflamatorios e infecciosos, es muy probable que cada subpoblación de monocitos tenga una respuesta y un papel contrastante frente a la infección por el DENV (Figura 1). Por ejemplo, la subpoblación no clásica encargada de la vigilancia y mantenimiento de la homeostasis del endotelio, se propone como un elemento crucial en el desarrollo de las manifestaciones graves de la enfermedad, por aportar de forma considerable a la producción de citoquinas proinflamatorias como el TNF-α y la IL-1β en respuesta al DENV (77). Esto resalta la importancia de hacer más estudios en este campo, ya que un mayor entendimiento de la contribución de estas células en la respuesta inmune contra el dengue podría llevar a identificar nuevos y tempranos blancos terapéuticos, que conduzcan a menor desarrollo de signos de alarma y manifestaciones graves de la enfermedad.














