INTRODUCCIÓN
El Síndrome de Brugada (SBr) fue descrito por primera vez en 1992 por Pedro y Josep Brugada (1). Es una enfermedad cardiaca no estructural, causante del 4 al 12 % de todas las muertes súbitas en personas que generalmente no presentan ninguna sintomatología; entre el 20 y el 50 % de estas muertes ocurren en pacientes sin ninguna enfermedad cardíaca estructural demostrable y como consecuencia de una arritmia (2-4).
Las bases genéticas de la enfermedad han demostrado que su origen es de carácter autosómico dominante y se han aislado aproximadamente 20 genes asociados con más de 250 mutaciones (5,6). Sin embargo, existen diagnósticos de novo en los que el cribado de la enfermedad en familiares directos no encuentra antecedentes (7). Los principales síntomas incluyen: taquicardia, síncope, arritmias y muerte súbita como desenlace final (8).
Algunas investigaciones sugieren que los pacientes asintomáticos presentan un mayor riesgo de sufrir muerte súbita debido a la falta de un diagnóstico oportuno (9), otras manifiestan que la presencia de síntomas es un factor de riesgo del síndrome (10,11) y otras, que la evolución es similar tanto en pacientes sintomáticos como en asintomáticos (12). Por lo tanto, se debe catalogar como paciente de alto riesgo a todo aquel que presente patrones electrocardiográficos (ECG) característicos del síndrome (13). Sin embargo, cabe resaltar que el estudio electrofisiológico está altamente cuestionado como método de estratificación de riesgo en el síndrome de Brugada (14,15).
Se han descrito tres patrones electrocardiográficos en el SBr, de los cuales el tipo I es el patrón característico del síndrome (16). Aunque estos patrones son la base para el diagnóstico del SBr, algunos pacientes presentan una forma oculta o intermitente, la cual necesita de otros métodos para su diagnóstico (17).
Se estima que la prevalencia del SBr es de 1 por cada 2.000 individuos en el mundo. Sin embargo, existen diferencias en estas cifras dependiendo de la ubicación geográfica (18); por ejemplo, en países occidentales como España, Italia, Bélgica, Países Bajos, Grecia, Alemania, Austria, Suiza, Polonia, Ucrania y Francia, la prevalencia aproximada es de 1 a 5 casos por cada 10.000 habitantes (19,20), mientras que en los países orientales 1 de cada 2.500 personas presentan el síndrome (21). Algunos de estos casos se han reportado en ciudades como Japón, Tailandia, China, India, Laos, Vietnam, Singapur y Camboya (22).
En el continente americano no se han realizado estudios epidemiológicos en el tema, por lo que se desconoce la cifra exacta de casos, pese a esto, algunos casos han sido reportados en países como Estados Unidos, Canadá, Brasil, Argentina y Uruguay (23-27). En Colombia se han reportado casos en Bogotá (28), Cali (29) y Medellín (18), no obstante, el número de casos para el país podría estar subestimado. En la Ciudad de Popayán, por ejemplo, aunque existen observaciones clínicas que sugieren su presencia, los casos no han sido publicados.
Factores como el género, pueden influir en la presentación clínica de la enfermedad (30,31). Estudios epidemiológicos sugieren que existe una mayor prevalencia en el sexo masculino que en el femenino en una relación de 8:1 (32), probablemente por la acción reguladora de las hormonales sexuales, que permiten una mayor expresión de genes sensibles a hormonas esteroideas, en especial la testosterona (33), la cual favorece una mayor expresión de canales de sodio a nivel cardiaco (34,35).
En este sentido, se ha encontrado que en algunos pacientes con síndrome de Brugada, los altos niveles de testosterona se asocian con la presencia del fenotipo característico del SBr y explican el predominio del síndrome en el sexo masculino (36). Además, dichos pacientes se caracterizan por tener un menor porcentaje de grasa visceral, secundaria a este influjo hormonal por mayores niveles de testosterona (37,38).
Los hombres con síndrome de Brugada presentan un perfil clínico de mayor riesgo que las mujeres y tienen un peor pronóstico (39,40). Otros estudios han descrito que en mujeres se presenta con menor frecuencia el patrón ECG tipo I, signo característico de la enfermedad (41). Pese a lo anterior, la información sobre las diferencias existentes en cuanto al género en el SBr es escasa y no es totalmente clara (42).
En pacientes con algún tipo de infección, ya sea viral, parasitaria o bacteriana, se han encontrado patrones electrocardiográficos característicos del SBr como resultado de la elevación de la temperatura normal, elevación que puede acelerar la inactivación de los canales de sodio, reproduciendo el fenómeno electrocardiográfico de tipo I (43). En la literatura se reportan múltiples casos de pacientes en los cuales, por síntomas como la fiebre causada por enfermedades infecciosas, se logra desenmascarar un SBr oculto (44-48).
FISIOPATOLOGÍA Y PATOGÉNESIS DEL SÍNDROME DE BRUGADA
El corazón es un órgano muscular cuya función principal es proveer sangre a todos los tejidos del cuerpo humano. Electrofisiológicamente se caracteriza por presentar un potencial de acción de aproximadamente -85 mvol en reposo, y logra alcanzar un potencial de membrana aproximado de 20 mvol (despolarización) en cada latido.
La despolarización cardiaca se ha dividido en 5 fases (0 - 4), cada una de las cuales está determinada por la entrada y salida de los iones K+, Na+, Ca+2 (Figura 1. A) (49). La fase 0 se caracteriza por la entrada de Na+ al espacio intracelular a través de canales dependientes de voltaje, y al mismo tiempo ocurre la apertura de canales lentos de Ca+2, esto hace que la célula cardiaca se despolarice y su potencial de membrana aumente hasta alcanzar la espiga o punta (20 mvol), momento en el cual se cierran todos los canales de Na+. Después de la inactivación de los canales de Na+ ocurre la salida de K+ y la entrada de Cl- , lo que define la fase 1 del potencial del miocardio.
Durante esta fase, de corta duración, ocurre una rápida repolarización en la que el potencial de membrana retorna a 0 mvol. La fase 2, también conocida como fase de meseta cardiaca, tarda entre 0,2 y 0,3 segundos y da lugar a la entrada de Ca+2 y Cl-.
Durante la fase 3 se cierran los canales lentos de Na+ y Ca+2 y aumenta la salida de K+, como resultado, ocurre una repolarización rápida que lleva a la célula nuevamente a su potencial negativo (-85 mvol). Finalmente se presenta la fase 4, la cual permite el equilibrio químico de los iones a nivel intra y extra celular, esta restitución electrolítica se logra por acción de la bomba Na-K-ATPasa, la cual expulsa el exceso de Na+ que se encuentra a nivel intracelular e ingresa K+ por transporte activo, conservando el potencial negativo de la célula, asimismo el intercambiador Na+/Ca+2 permite la salida de un ión Ca+2 por la entrada de 3 iones de Na+ (Figura 1. A y D) (50-52).
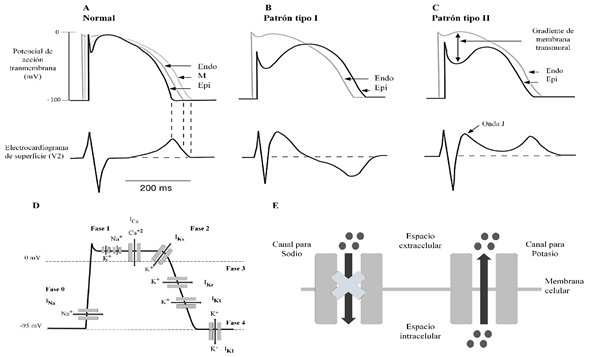
Figura 1 Potenciales de acción asociados a los patrones electrocardiográficos del síndrome de Brugada. A. Potencial de acción normal del corazón. B. Potencial de acción asociado al patrón tipo I. C. Potencial de acción asociado al patrón tipo II. D. Acción normal de los canales durante el potencial de acción. E. Bloqueo del canal de sodio que originan los patrones electrocardiográficos del síndrome de Brugada. Fuente: adaptada de Brugada et al. (2009).
En el SBr, el potencial de acción normal muestra alteraciones y hasta el momento se han descrito dos hipótesis que explican su implicación en la patogénesis. La primera, conocida como deterioro de la repolarización, explica que el desbalance de cargas positivas por alteración de las corrientes iónicas de la fase 1 del potencial conduce a una pérdida de la meseta, acortándola en un 40 a 70 % en el epicardio (Figura 1). B) (53,54). Esto se puede desencadenar como resultado de la disminución de las corrientes de entrada de Ca+2 o de Na+ o, por un aumento de las corrientes de salida transitorias de K+ entre el epicardio derecho y el endocardio, lo que ocasiona una dispersión transmural de la repolarización y la refractariedad, dando lugar al patrón ECG típico (tipo I), donde se presenta la elevación del ST (21,55) observada en derivaciones precordiales derechas (56).
La segunda hipótesis se denomina teoría de la despolarización, esta se presenta secundaria a un retraso de la conducción en la región anterior epicárdica del tracto de salida del ventrículo derecho. Esto se explica por la existencia de algunas zonas con potenciales anormales con un bajo voltaje y duración prolongada, algo que no ocurre a nivel del endocardio anterior del mismo tracto de salida, ni en otras áreas de los ventrículos derecho e izquierdo (Figura 1. C) (57). Las arritmias y la muerte súbita que caracterizan al SBr se deben al desarrollo de un mecanismo de reentrada en la fase 2, como resultado de la heterogeneidad y dispersión de la repolarización, tanto a nivel transmural como epicárdico, con una mayor vulnerabilidad en la aparición de complejos ventriculares prematuros (58). El corazón tiene un actividad eléctrica normal, conocida como ciclo cardiaco, en el cual se despolarizan todas las células del corazón enviándolas a un estado refractario y así evitar una nueva excitación; sin embargo, si un grupo de fibras no se activan oportunamente en el ciclo, ya sea por el retraso o la activación precoz, pueden activar zonas previamente despolarizadas que se recuperaron de la activación inicial, por lo que se genera un segundo potencial, el cual producirá un fenómeno de reentrada y volverá a despolarizar ciertas células del corazón que ya han sido repolarizadas por el primer potencial (59). Todos estos fenómenos se pueden demostrar con la administración de flecainida (60,61), un fármaco antiarrítmico que, junto con la ajmalina son bloqueadores del canal de sodio y, por lo tanto, son medicamentos esenciales para el diagnóstico del SBr (62). El test se considera positivo si durante la perfusión del fármaco en el paciente, el ECG ya sea tipo II o III, se convierte en ECG diagnóstico de tipo I, caracterizado por un ascenso del segmento ST ≥ 2 mm seguido de T negativa en más de una derivación precordial derecha (V1-V3) (63,64).
Factores externos al corazón también pueden influir en la aparición de arritmias, por ejemplo el tono autonómico (65). Algunos autores describen un aumento súbito de la actividad vagal inmediatamente antes de la aparición de fibrilación ventricular, lo cual puede confirmar que una arritmia puede darse por diversos aspectos. Se ha informado de la existencia de una pérdida del balance entre el simpático y el parasimpático en el SBr. Cuando ocurre una reducción en la actividad simpática con predominio del tono parasimpático aumenta el riesgo de arritmias, esta podría ser la razón por la cual la incidencia de arritmias y muerte súbita se presentan en reposo o durante el sueño (donde hay un aumento del parasimpático), cabe resaltar que este fenómeno ocurre en sujetos con SBr y no en otras circunstancias patológicas en las cuales, por el contrario, el aumento del tono simpático es el generador de arritmias (66,67).
BASES GENÉTICAS
El SBr tiene un patrón de transmisión autosómico dominante con penetrancia incompleta (68). Se conoce que el 25 % de los pacientes presentan alguna mutación en el gen (3p21) (5). Este codifica la subunidad α del canal de sodio Nav1.5, que determina la fase 0 del potencial de acción cardíaco (69). Las mutaciones en este gen generan la pérdida de la función del canal de sodio reduciendo la corriente entrante del ion, lo que ocasiona las manifestaciones clínicas y el ECG característico del SBr (70). La subunidad α de este canal de sodio a su vez interactúa con la subunidad β1, anquirina G, caveolina 3 y sintrofina; por lo tanto, las mutaciones en los genes que codifican para estas proteínas también se han asociado al síndrome (71).
Se han encontrado otras mutaciones relacionadas al SBr (72), por ejemplo la mutación en el gen SCN10A, que codifica para el canal de sodio Nav1.8, conduce a una pérdida de su función y disminuye la corriente de Na+ por modulación de la actividad del canal Nav1.5 codificado por SCN5A, alteraciones que prolongan los intervalos PRI y QRS (73,74). Otra mutación relacionada con el SBr es la que ocurre en el gen similar al glicerol-3-fosfato dehidrogenasa-1 (GPD1L), que actúa como modulador de los canales iónicos, aunque el mecanismo exacto es desconocido (75). Por otro lado, la mutación en el gen SCN1B42 evita la apertura del canal Na+ y mutaciones en el gen SCN3B43 causan reducción de la corriente de Na+ por interferencia en el tráfico normal del canal hacia la membrana celular (59). Recientemente, se ha demostrado que las mutaciones dominantes negativas en el gen RANGRF, el cual codifica para la proteína MOG1, perjudican la regulación de la expresión y el tráfico del canal de sodio hacia la membrana, conduciendo a la reducción de las corrientes de sodio y por tanto a las manifestaciones del síndrome (76).
También se han aislado mutaciones en los genes que codifican para las subunidades α-1 (CACNA1C), β-(CACNB2b) y δ1 (CACNA2D1) del canal de Ca+2 cardiaco tipo L, causando una disminución de la corriente de entrada de Ca+2. Esta condición está relacionada con el 10-15 % de los casos de SBr y del síndrome de QT corto (77-80). Las mutaciones en los genes KCNE347 y KCNE5 causan el aumento de la corriente transitoria de salida de K+. Por último, las mutaciones en KCNJ8 bloquean el canal de potasio evitando la salida del ion y dan como resultado la pérdida de la meseta cardiaca (81,82).
MANIFESTACIONES CLÍNICAS Y DIAGNÓSTICO
Los pacientes con SBr no tienen ningún signo de cardiopatía estructural evidente, pero presentan arritmias ventriculares malignas, síncope o muerte súbita cardíaca, que por lo general se suelen dar en el reposo o en el sueño nocturno (83). Además, pueden presentar episodios de taquicardia ventricular polimórfica (TVP) que terminan en fibrilación ventricular (FV). A la aparición de tres o más episodios de taquicardia ventricular o fibrilación ventricular separada, que requieren de terapia con desfibrilador automático implantable (DAI), en un período de 24 h, se le conoce como tormenta eléctrica, fenómeno raro pero potencialmente fatal (84-86). Estos eventos arrítmicos ventriculares se observan con mayor frecuencia en la cuarta década de la vida, aunque se han descrito casos entre los 19 y 56 años (48,87-89), así como en la población pediátrica (90).
Las manifestaciones clínicas del síndrome incluyen historial de síncope, respiraciones agónicas nocturnas durante el sueño, historia familiar de muerte súbita antes de los 45 años, fibrilación ventricular documentada, taquicardia ventricular polimórfica y la presencia del patrón electrocardiográfico tipo I en algún miembro de la familia (82); estas manifestaciones son útiles para direccionar la intervención terapéutica del paciente. Actualmente el diagnóstico del SBr se basa en criterios electrocardiográficos. Según el consenso vigente sobre diagnóstico y manejo de pacientes con síndromes de arritmias heredadas primarias de la Heart Rhythm Society y la European Heart Rhythm Association, se han descrito tres patrones ECG distintos para el SBr, los cuales se caracterizan por la presencia de una morfología semejante a un bloqueo de rama derecha, con la diferencia de que se encuentra una elevación del segmento ST en las derivaciones precordiales del ventrículo derecho (V1, V2), con los electrodos localizados en el 2do, 3ro o 4to espacio intercostal (91,92).
El patrón de tipo I se caracteriza por una elevación convexa y descendente del segmento ST ≥ 2 mm en más de una derivación precordial derecha (V1-V2), con ondas T negativas, elevación que ocurre espontáneamente o después de administrar drogas antiarrítmicas de clase I por vía intravenosa. El patrón de tipo II se caracteriza por la elevación del segmento ST ≥ 2 mm en precordiales derechas seguida de ondas T positivas o isobifásicas (ECG aspecto de silla de montar) y, el patrón de tipo III se define como cualquiera de los dos anteriores pero con elevación del segmento ST ≤ 1 mm (Figura 2) (21,93-95), dado que este patrón muestra una elevación del ST no significativa, no es completamente sugestivo de esta canalopatía (7).
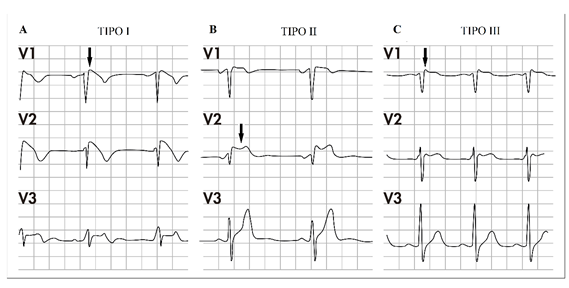
Figura 2 Patrones electrocardiográficos del síndrome de Brugada. A. Patron electrocardiografico tipo I, la flecha muestra la elevacion convexa y descendente del segmento ST ≥ 2 mm ondas T negativas. B. Patron electrocardiografico tipo II, elevacion del segmento ST ≥ 2 mm T positivas o isobifasicas, silla de montar (indicado con una flecha). C. Patrón electrocardiografico tipo III, la flecha indica la elevacion del segmento ST es ≤ 1 mm. Fuente: adaptada de Brugada et al. (2009).
Los dos últimos patrones son diagnosticados mediante test farmacológico con drogas antiarrítmicas clase 1 que inducen la morfología de un ECG tipo I (62,63). Para confirmar el SBr se debe realizar un ECG y evaluar si este corresponde al patrón electrocardiográfico tipo I, el cual es característico del síndrome. Se sugiere que todo paciente con patrón tipo I asintomático debe someterse a un interrogatorio exhaustivo, examen físico y registro de un ECG convencional y con derivaciones modificadas; también se recomienda estudiar a todos los familiares consanguíneos (96). En caso de que se presenten los patrones tipo II o III, se requiere la confirmación del diagnóstico mediante la realización del test de ajmalina, procainamida o flecainida (97).
Es importante resaltar que algunas enfermedades pueden presentar registros electrocardiográficos similares al SBr, por ejemplo el infarto agudo de miocardio, la miocarditis aguda, el infarto del ventrículo derecho, el trombo embolismo pulmonar agudo, la hiperpotasemia, la displasia arritmogénica del ventrículo derecho, los bloqueos de la rama derecha e izquierda, la hipertrofia ventricular izquierda y el aneurisma disecante de la aorta, por lo que se dificulta el diagnóstico diferencial (98).
Algunas condiciones como los episodios febriles pueden desenmascarar formas silentes del SBr y/o conferir un riesgo incrementado (transitorio) de arritmias ventriculares (99), especialmente en la población pediátrica (100), donde la identificación del SBr es poco habitual y la mayoría de los casos reportados se desenmascaran después de episodios febriles (101).
DESENMASCARAMIENTO DEL SÍNDROME DE BRUGADA POR ENFERMEDADES INFECCIOSAS
Varios casos de patrones electrocardiográficos de SBr han sido reportados en pacientes con algún tipo de infección, ya sea viral, parasitaria o bacteriana. Estas infecciones elevan la temperatura normal hasta llegar a la fiebre (temperatura matutina > 37,2 °C o una temperatura vespertina > 37,7 °C) (46,102). Esta elevación de la temperatura puede acelerar la inactivación de los canales de sodio con una recuperación más lenta y ocasionar aparición de la supra desnivelación del segmento ST en las precordiales derechas (43).
A continuación, se describen algunos casos de pacientes con enfermedades infecciosas a quienes se les diagnosticó el síndrome luego de sufrir episodios de fiebre durante los cuadros clínicos de la enfermedad. Se ha reportado el caso de una paciente mujer de 51 años de Badajoz, España, con antecedentes personales de diabetes mellitus tipo II, fumadora de 3 cigarrillos al día y artrosis, que ingresa en el contexto de fiebre y dolor abdominal de 24 horas de evolución, localizado en la fosa ilíaca izquierda, acompañada de náuseas y vómitos alimentarios. En el examen físico se resalta que fue positivo la puño percusión, en el electrocardiograma presenta un patrón de Brugada tipo II durante los episodios febriles de una pielonefritis aguda por Enterobacter aerogenes aislada en hemocultivos y uroanálisis, cabe resaltar que el ECG se normaliza en los periodos afebriles (103).
En infecciones virales, donde se desarrolla un síndrome febril puede ocurrir una elevación del segmento ST con la aparición de algún patrón ECG de SBr, el más común en estos casos es el patrón tipo I, donde la disminución de la fiebre hace desaparecer el patrón (104). Los siguientes casos describen la anterior situación, el primero es un hombre de 49 años, quien fue admitido para investigación de síncopes recurrentes, episodios que habían comenzado tras la infección por el virus H1N1 (pandemia del año 2009) y que continuaron apareciendo durante cuadros febriles de una neumonía pos influenza.
Un electrocardiograma de 12 derivaciones (ECG) (Figura 1), grabado mientras el paciente estaba febril (temperatura 38,3 °C), mostró una elevación del segmento ST en derivaciones V1-V3, consistente con un patrón de tipo I. Tiempo después de que la fiebre se resolvió, el patrón electrocardiográfico desapareció (105). El segundo, es el caso de un hombre de 58 años de edad que se presentó en el hospital con una úlcera en la garganta, tos y fiebre de 38,5 °C; el ECG mostró una elevación del segmento ST en las derivaciones V1 a V3 respecto del electrocardiograma inicial, mientras que las enzimas cardíacas, la radiografía de tórax, la ecocardiografía bidimensional y la arteriografía coronaria fueron normales. Todos estos síntomas se atribuyeron a una enfermedad viral, la elevación del segmento ST se resolvió con la disminución de la fiebre (106). Adicionalmente, se reportan algunos casos de presentación del patrón tipo I en pacientes con malaria, y la desaparición del ECG patológico en el momento de la mejoría del paciente (107,108).
Al tener en cuenta lo anterior, es importante considerar como diagnóstico diferencial el SBr en pacientes que cursen un estado febril, presenten dolor precordial u otras características de infarto, acompañados de hallazgos electrocardiográficos sugestivos de síndrome de Brugada (109), ya que también se han reportado casos de patrón tipo II en el electrocardiograma por pericarditis. Por ejemplo, en un hombre de 27 años, de Perugia, Italia, el cual acudió al médico por fatiga e incomodidad en el pecho; los hallazgos del laboratorio mostraron un aumento del recuento de leucocitos y la proteína C-reactiva. El paciente ingresó con un diagnóstico de pericarditis, sin embargo, en el electrocardiograma se logró evidenciar una elevación del segmento ST de tipo “silla de montar” en la derivación V2, reconocida como patrón de Brugada tipo II. Unos días después del inicio de la terapia antiinflamatoria el ECG se normalizó (110). Se debe tener en cuenta que presentar un patrón de SBr cuando la temperatura está elevada aumenta el riesgo de presentar eventos arrítmicos y padecer un desenlace fatal por muerte súbita (111).
TRATAMIENTO
Cuando se sospecha de este síndrome en el paciente se recomienda evitar algunos factores de riesgo que incrementan la elevación del segmento ST, tales como los fármacos antiarrítmicos (procainamida, propafenona) (112), psicotrópicos (amitriptilina, litio) y anestésicos/analgésicos (procaina y propofol), entre otros (cocaína, alcohol) (113).
Actualmente, el SBr es tratado con ciertos fármacos o con el uso de un desfibrilador automático implantable (DAI) en pacientes sintomáticos (Tabla 1); sin embargo, en pacientes asintomáticos es muy difícil decidir una conducta terapéutica (114-116). Los fármacos disponibles son la quinidina, que ha probado ser útil en el tratamiento de pacientes que desarrollan tormentas eléctricas, así como el isoproterenol, la disopiramida y orciprenalina (117-119).
Tabla 1 Recomendaciones para el uso del DAI durante el tratamiento de un paciente con síndrome de Brugada según la Declaración del consenso sobre el diagnóstico y el tratamiento de pacientes con síndromes de arritmias primarias hereditaria s
| Clase I |
|---|
| Los siguientes cambios de estilo de vida se recomiendan en todos los pacientes con diagnóstico de SBr. |
| Evitar fármacos que pueden inducir o agravar la elevación del segmento ST en derivaciones precordiales derechas. |
| Evitar la ingesta excesiva de alcohol. |
| Tratar la fiebre inmediatamente con medicamentos antipiréticos. |
| El DAI se recomienda en pacientes con diagnóstico de SBr que: |
| Son sobrevivientes de un paro cardíaco y/o, |
| Tienen una TV sostenida espontánea documentada con o sin síncope. |
| Clase IIa |
| El implante de DAI puede ser útil en pacientes con un ECG tipo I de diagnóstico espontáneo que tienen un historial de síncope, probablemente causado por arritmias ventriculares. |
| La quinidina puede ser útil en pacientes con un diagnóstico de SBr e historia de tormentas arrítmicas definidas como más de dos episodios de VT/V en 24 horas. |
| La quinidina puede ser útil en pacientes con un diagnóstico de SBr cuando: |
| El paciente califica para un DAI pero presenta una contraindicación para usarlo o se rehusa y/o, |
| El paciente tiene un historial de arritmias supraventriculares documentadas que requieren tratamiento. |
| La infusión de isoproterenol puede ser útil para suprimir las tormentas arrítmicas en pacientes con SBr. |
| Clase IIb |
| La implantación de DAI se puede considerar en pacientes con un diagnóstico de SBr que desarrollan FV durante la estimulación eléctrica programada. |
| La quinidina se puede considerar en pacientes asintomáticos con un diagnóstico de SBr con un ECG de tipo I espontáneo. |
| La ablación con catéter se puede considerar en pacientes con un diagnóstico de SBr e historia de tormentas arrítmicas o descargas repetidas del DAI. |
| Clase III |
| El implante de DAI no está indicado en pacientes con SBr asintomático con un ECG de tipo I inducido por fármacos, con historial familiar de solo una muerte cardiaca súbita. |
Fuente: adaptado de Priori et al. (2013).
Es importante resaltar que, de acuerdo al consenso vigente, solo la quinidina y el isoproterol están recomendados para el manejo farmacológico del síndrome Brugada (120). Algunos fármacos anestésicos logran mantener frecuencias cardíacas normales en los pacientes con SBr por sus propiedades sobre el sistema nervioso autónomo, su administración está encaminada a evitar la disfunción del canal de sodio cardíaco y a impedir algunas complicaciones como las arritmias (121). Sin embargo, el tratamiento farmacológico para el SBr no es muy efectivo (4). La implantación de un DAI previene la muerte súbita en pacientes sintomáticos con ECG tipo I (122,123), además, si se presentan efectos desfavorables como eventos arrítmicos malignos tipo TV o FV, el DAI termina las anteriores situaciones con estimulación anti-taquicardia o con terapia de desfibrilación, de esta forma evita una parada cardiaca y posterior muerte súbita arrítmica (124).
Para los pacientes con el síndrome de Brugada que han sobrevivido a un paro cardíaco repentino o aquellos con un historial de síncope, que se cree es debido a taquiarritmias ventriculares, se recomienda la implantación de un DAI en lugar de un tratamiento farmacológico antiarrítmico, tal como se muestra en la (Figura 3).
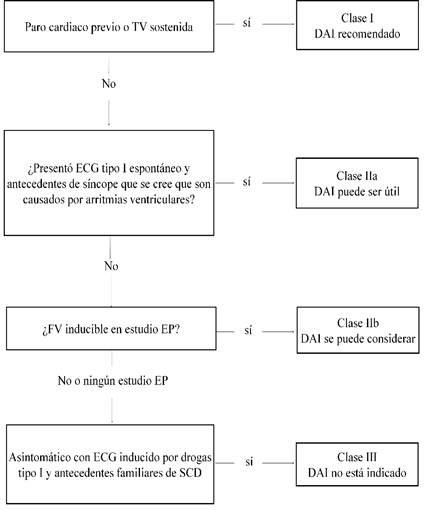
Figura 3 Algoritmo de manejo del DAI y uso de fármacos según la Declaración del consenso sobre el diagnóstico y el tratamiento de pacientes con síndromes de arritmias primarias hereditarias. ECG: electrocardiograma; EP: electrofisiología; DAI: desfibrilador automático inducible; SCD: muerte súbita cardiaca; FV: fibrilación ventricular; TV: taquicardia ventricular.Fuente: adaptado de Priori et al. (2013).
CONCLUSIONES
En el continente americano no se han realizado estudios epidemiológicos sobre el SBr, por lo que se desconoce la cifra exacta de presentación de casos. Se conoce que este síndrome es genéticamente heterogéneo, puesto que las causas genéticas son múltiples al presentarse mutaciones en diversos genes que codifican para los canales iónicos de sodio, potasio y calcio. Por esta razón la utilidad de las pruebas diagnósticas basadas en un solo marcador genético podría ser ambigua.
Se debe tener en cuenta que múltiples factores como el género, la edad, la historia familiar, el tipo y la penetrancia de la mutación pueden influir en el desarrollo del SBr y determinar su sintomatología.
Se han descrito algunos posibles inductores de patrones electrocardiográficos del SBr, por ejemplo, episodios febriles causados por infecciones, ingesta de cocaína o fármacos que bloquean los canales de sodio, los cuales a su vez permiten desenmascarar la enfermedad.
La forma oculta o intermitente del síndrome dificulta el diagnóstico oportuno e incrementa el riesgo de sufrir muerte súbita (17). Se sabe que en reposo o durante el sueño puede ocurrir una disminución en la actividad simpática, lo que lleva a un aumento del tono parasimpático incrementando la posibilidad de sufrir una arritmia que podría conducir a la muerte del paciente.
PERSPECTIVAS Y RECOMENDACIONES
Pese a los esfuerzos de investigación realizados en Colombia los reportes de pacientes con la enfermedad son escasos; es posible que una de las razones de los limitados registros esté relacionada con el reconocimiento de las manifestaciones clínicas del SBr, por lo que el síndrome pasa desapercibido en la mayoría de los casos. Por lo tanto, sería importante instruir al personal médico por parte de especialistas, con el fin de realizar un mejor diagnóstico, brindar el tratamiento adecuado a los pacientes y evitar mayor riesgo de muerte súbita por SBr.
En Colombia no existen reportes sobre la expresión de este síndrome durante el embarazo, por lo que se sugiere la realización de estudios durante esta etapa, de esta manera se lograrían reconocer los síntomas que se presentan en este periodo y sería más comprensible el papel de las hormonas en el síndrome.
Es pertinente complementar estos estudios con investigaciones in vivo usando biomodelos, que permitan no solo comprender mejor los mecanismos por los cuales actúa el síndrome, sino también proponer tratamientos más efectivos para los pacientes.














