INTRODUCCIÓN
La zoonosis generada por larvas de estadio infectivo (L3) de nematodos de la familia Anisakidae se denomina anisakidosis. Esta parasitosis es ocasionada por la ingesta de pescado crudo o poco cocido parasitado con larvas (L3) 1. El término fue introducido en 1960 por Straub y, en el mismo año, Van Thiel et al., documentaron el primer reporte de caso 2.
La larva puede generar múltiples síntomas, aunque la mayoría pueden cursar asintomáticas 3. Se describen tres cuadros clínicos: gastrointestinales, alérgicos y gastroalérgicos, que se explican por dos mecanismos fisiopatológicos: una reacción de hipersensibilidad inmediata y otra inflamatoria 4.
Aunque existen casos de infestaciones múltiples, la infección suele darse por una larva 4. Se han descrito infecciones por las especies Anisakis simplex, Anisakis physeteris, Pseudoterranova decipiens e Hysterothylacium spp. 2,5,6. Además, algunos investigadores reportan que las manifestaciones clínicas del humano frente a los parásitos anisákidos están asociadas con el género al cual pertenece; así, los cuadros gastrointestinales se asocian con parásitos del género Pseudoterranova y los de hipersensibilidad con Anisakis7,8.
La mayoría de los casos se han reportado en España y Japón, en donde se presentan más de 2.000 infecciones anuales que se traducen en un problema de salud pública que ha requerido establecer legislaciones de control y prevención 9. Sin embargo, en el 2018, Gardonete et al., 10 reportó en Italia ocho casos de anisakidosis asociados con Anisakis sp., A. simplex (s.l.) y A. pegreffii como agente etiológico de la enfermedad. En Colombia y en los países de Suramérica en general, esta enfermedad es poco conocida por la población general y el personal de salud. La información reportada para anisákidos en la región corresponde en su mayoría a tesis de pregrado y posgrado 11. Este desconocimiento puede tener como consecuencia un subdiagnóstico de la enfermedad. El objetivo de este trabajo es presentar una revisión descriptiva de la anisakidosis desde los aspectos generales del parásito, los reportes de caso y los hospederos identificados que probablemente estén involucrados en su transmisión en Colombia.
MÉTODOS
Se realizó una revisión de la literatura para identificar los aspectos básicos de los nematodos anisákidos y la información reportada para Colombia: reportes de casos clínicos y las especies de peces registradas como hospederos.
La búsqueda se realizó en cada base de datos consultada hasta mayo del 2019. Se revisaron las bases de datos MEDLINE, Cochrane, Embase, LILACS y Scopus. Se utilizaron los términos MeSH y DeCS: anisákidos, anisakiasis, anisakidosis, Anisakidae, Anisakis, Pseudoterranova y Contracaecum, seguido de la conjunción “AND” y la palabra Colombia.
Como criterios de inclusión, se incorporaron todos los artículos publicados en inglés y español sobre casos de humanos reportados de Colombia con evidencia de larvas L3 de anisákidos. Para los reportes de los hospederos se incluyeron los estudios con peces parasitados por la familia Anisakidae, tanto de aguas continentales como marítimas. Se excluyeron los estudios donde la información para determinar la elegibilidad no estaba disponible.
Se complementó con una búsqueda no estructurada en SciELO y Google Scholar. Además, se consultó con la directora del grupo de investigación TEBLAMI, de la Universidad del Valle quienes han realizado importantes aportes sobre anisákidos, para identificar referencias adicionales como tesis de pregrado y posgrado con resultados inéditos.
RESULTADOS
El ciclo de vida del parásito inicia con la expulsión de huevos a través de las heces de mamíferos marinos que son sus hospederos definitivos. En el agua, favorecidos por temperaturas entre 13 y 18 °C 12,13, los huevos embrionan, eclosionan y liberaran larvas del primer estadio (L1) que, posteriormente, mudan a un segundo estadio larval (L2) 14. Las larvas L2 son ingeridas por crustáceos pequeños 15, que a su vez son consumidos por peces, hospederos intermediarios, donde mudan al tercer estadio larval (L3). Finalmente, los peces parasitados con L3 son ingeridos por mamíferos marinos, sus hospederos definitivos, donde pasan a L4 y a su forma adulta; se reproducen y liberan huevos, iniciando un nuevo ciclo 16.
Se ha encontrado que el hospedero definitivo (mamífero marino), en el caso del género Pseudoterranova, está asociado con los pinnípedos (focas, leones marinos, morsas, etc.); mientras que, Anisakis completa el ciclo en cetáceos (ballenas y delfines) 16. Además, se han hallado aves también como hospederos definitivos de anisákidos del género Contracaecum17. En el ciclo de vida en general participan múltiples hospederos intermediarios, dependiendo de la zona geográfica en donde se desarrolle 18.
Cuando un pez parasitado muere, la larva infectante migra desde las vísceras hasta el músculo 19. El humano que ingiere la carne cruda o semicruda del pescado parasitado con larvas L3 puede resultar infectado, pasando a ser un hospedero accidental donde no se desarrolla el parásito adulto 20. Estos parásitos ocasionan la enfermedad anisakidosis en el ser humano, la cual se asocia con cuadros gástricos, alérgicos y gastroalérgicos 21.
Taxonomía
Los nematodos ascaroideos de la familia Anisakidae (Nematoda) están comprendidos por 24 géneros, los más conocidos Pseudoterranova, Contracaecum y Anisakis22. En la actualidad, están descritas nueve especies de Anisakis 22,23-25, siendo A. simplex el principal responsable de los episodios alérgicos 26. Se estima que Pseudoterranova y Contracaecum son de menor importancia, aunque desde el punto de vista epidemiológico es necesario evaluar su incidencia en la población, especialmente lo asociado con la sensibilización a los alérgenos 27.
Morfología
Los anisákidos tienen un cuerpo vermiforme, no segmentado. Su extremo posterior termina en forma cónica o puntiaguda 13. Poseen una cutícula de 1,50 μm de grosor 12, que en algunas especies presenta estriaciones finas transversales más marcadas hacia la parte posterior del cuerpo 28. El sistema digestivo es completo. El esófago mide de 2,5 a 3,0 mm, con una porción anterior muscular, el proventrículo y una posterior glandular, el ventrículo 29. Poseen un intestino que ocupa la mayor parte de la longitud del nematodo, su extremo posterior es redondeado y termina en un mucrón o espina. Tienen un anillo nervioso en el tercio anterior de su cuerpo 30.
El género Anisakis (Figura 1A) posee un ventrículo largo con una unión ventrículo-intestinal oblicua, cola redondeada, corta con una espina terminal 12. El género Pseudoterranova (Figura 1B) presenta ciego intestinal bien desarrollado, se extiende hacia el extremo anterior, sobrepasa el margen anterior del ventrículo y es reconocido por la ausencia de apéndice esofágico. Presenta una cola postanal corta y cónica, con una espina terminal fina. El extremo anterior tiene un diente pequeño y triangular dirigido hacia afuera. El poro excretor aparece situado justo en posición ventral al diente 12.
Las larvas de Contracaecum (Figura 1C) miden entre 4 y 16 mm. En el extremo anterior posee tres labios, un diente cuticular cónico y ligeramente romo. El poro excretor es continuo al diente. En el tubo digestivo poseen ventrículo pequeño y esférico, apéndice ventricular y un ciego anterior más pequeño que el apéndice ventricular. El extremo posterior es cónico, la cola postanal larga y no presenta mucrón 12.
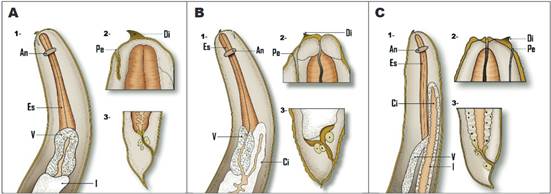
Fuente: creación propia
Figura 1 Características morfológicas de las larvas en L3 de A. Anisakis. B. Pseudoterranova. C. Contracaecum. 1: parte anterior; 2: extremo anterior; 3: extremo posterior; An: anillo nervioso; Es: esófago; V: ventrículo; I: intestino; Di: diente cuticular; Pe: poro excretor.
Anisakidosis
Es la infección causada por los nematodos de la familia Anisakidae. Sin embargo, cuando esta es causada por algunas especies del género Anisakis, se denomina anisakiasis. Este cuadro clínico es frecuente en Asia y Europa asociado con reacciones alérgicas, mientras la causada por Pseudoterranova es conocida como pseudoterranovosis, siendo este el género responsable de la mayoría de casos reportados en el continente americano, principalmente, en Chile 2,23,31-34 y Perú 20,35,36. Existe un reporte de infección por C. osculatum en Japón y cuatro reportes por H. aduncum: dos en Corea del Sur y dos en Japón; no se conocen reportes en América del Sur hasta el momento 37.
En cuanto a las formas de presentación de la anisakidosis, tenemos que, la parasitación en el tracto digestivo humano por las larvas L3 es la de mayor prevalencia. Como formas gastrointestinales se pueden encontrar: 1. La forma luminal no invasiva, en la cual la larva puede ser eliminada a través de la materia fecal o el vómito; 2. La forma gástrica, cuando la larva invade la mucosa gástrica y requiere endoscopia 2,4; 3. Forma intestinal, cuando la larva migra al intestino delgado, cursa con síntomas como el dolor abdominal, diarrea, fiebre, entre otros 2; y, 4. Forma gastrointestinal, cuando las larvas alcanzan la cavidad abdominal y pueden migrar al pulmón, el páncreas e hígado 33.
La sintomatología gastrointestinal depende de la ubicación. Según los reportes, la localización esofágica se presenta en el 0,8 % de los casos 33; la gástrica, en la mayoría 70-95 % 2,4 y, la intestinal, con un 4 % de ellos 2 con una variante ileal terminal y una colónica rara, en el 0,1-0,9 % 38. Existen reportes en los cuales la larva se ubicó en la laringe y lengua 7 o migró al hígado, bazo, páncreas, los pulmones, ovarios o ganglios linfáticos 2,7.
Los cuadros gastrointestinales varían en sintomatología de acuerdo con la presentación y evolución cronológica de cada caso. Sin embargo, la mayoría son autolimitados 4. Cuando la afección es más proximal los síntomas inician tempranamente, 6 a 12 horas después de la ingestión del pescado parasitado; la larva puede desencadenar el reflejo tusígeno que permite la expulsión del parásito con remoción manual 31. Pueden presentarse, además, dolor faríngeo, prurito nasal, náusea y vómito 7,8.
En los cuadros gástricos, la larva se ubica en los pliegues de la curvatura mayor del estómago, pasando desapercibida en el examen endoscópico 39; los pacientes cursan con un dolor epigástrico intenso (pirosis) y repentino, inicia de 12 a 72 horas posteriores a la comida y no mejora con analgésicos 2,4. Asimismo, se puede experimentar dolor torácico de tipo anginoso 40, cólico abdominal, náuseas, sensación de estómago vacío 41, febrícula y distensión abdominal por ascitis 39.
Cuando está comprometido el intestino, los síntomas aparecen tardíamente, incluso semanas después de la infección. En estos casos prevalece la obstrucción intestinal, seguida por una perforación en el intestino que se puede complicar en peritonitis, heces melénicas, dilatación proximal del intestino delgado 7,39 o intususcepción 38. Ocasionalmente, la larva puede ser eliminada en las deposiciones o migrar hasta el ano 2,32.
La infección también puede desencadenar respuestas alérgicas agudas, estas abarcan urticarias, angioedema y shock anafiláctico. Suelen aparecer entre 4 a 24 horas después de la ingesta 2. El sistema inmune reconoce los antígenos excretados/secretados de la larva viva y los de la cutícula en la larva muerta 8. Hasta la fecha, se tienen identificados trece alérgenos de A. simplex; los de mayor relevancia son Ani s 1 y Ani s 7 42,43. Estos alérgenos desencadenan una reacción de hipersensibilidad tipo I, mediada por IgE típica de un perfil linfocítico Th2 39, la cual requiere de una sensibilización previa de las células del sistema inmune, probablemente, por un cuadro intestinal asintomático anterior 3,44.
La reacción inmunológica en el humano puede ser aguda o crónica y está determinada por el tiempo de permanencia de la larva 20. El tipo agudo se caracteriza por eritema e hiperemia en la mucosa 41, acompañado de edema que puede comprometer la submucosa 39. Al aumentar la permanencia de la larva varios días, esta puede migrar hasta la submucosa y generar alteraciones de tipo crónico, con infiltración eosinofílica 4 que termina en la formación de abscesos y granulomas por una reacción de hipersensibilidad tipo IV 7,8.
La larva muere de 8 a 24 semanas después de ser ingerida 2,7. En cuanto a las reacciones alérgicas crónicas, la urticaria es una manifestación común, también se ha asociado con rinitis, dermatitis, conjuntivitis y asma ocupacional (en pescadores) e infantil 2,7,20,45. Se debe aclarar que ambas presentaciones pueden ocurrir en conjunto como un cuadro gastroalérgico 40.
Debido a la naturaleza termoestable de los antígenos como Ani s 4 de A. simplex, se pueden presentar reacciones alérgicas aún con el consumo de pescado bien cocido, situación que constituye un problema para el 27 % de los individuos sensibilizados 21,45.
La identificación de genes que codifican para proteínas con un papel antigénico en los productos de excreción y secreción, ha permitido identificar A.peg-1, una glucoproteína: A.peg-7 y la mioglobina A.peg-13 como posibles proteínas desencadenantes de la respuesta alérgica 46.
Para el diagnóstico de anisakidosis se tiene en cuenta el cuadro clínico del paciente y el antecedente de consumo de pescado. El diagnóstico de un cuadro gastrointestinal exige la identificación de la larva, ya sea in vivo, por medio de endoscopia o, in situ, en una biopsia. La endoscopia temprana es el gold standard para el diagnóstico 4.
Por la similitud en la presentación clínica, se debe hacer un diagnóstico diferencial de los cuadros gastrointestinales como la gastritis, apendicitis aguda, pseudoobstrucción intestinal u otras infecciones parasitarias, infecciones bacterianas, enfermedad de Crohn y neoplasias, principalmente, en los casos crónicos con formación de granulomas que simulan tumores 4,7,8,36.
Para los cuadros alérgicos no es indispensable la observación directa de la larva, ya que los síntomas se atribuyen principalmente a la respuesta inmune del hospedero, por ello se requieren pruebas serológicas. La detección de anticuerpos IgM, IgG e IgE, específicos contra el parásito, son un método sensible 3 o, las pruebas cutáneas como el test de Prick, indican un contacto previo con el nematodo y se usan en investigación 42.
En casos clínicos asociados con larva viva, el tratamiento consiste en la extracción por endoscopia con fórceps, realizando una remoción completa del nematodo para su identificación. Los síntomas suelen desaparecer pocas horas después de la extracción 41.
En casos con granulomas u obstrucciones intestinales, se debe hacer una resección de los segmentos afectados 7. Se han propuesto tratamientos empíricos con antiparasitarios como el albendazol y mebendazol, que buscan erradicar la larva, pero no se conoce su efectividad 39,44.
En las reacciones alérgicas el tratamiento inmediato abarca antihistamínicos, broncodilatadores y vasoconstrictores en los casos más graves 44.
Anisakidosis en el mundo
Las nematodiasis transmitidas por el consumo de alimentos es actualmente un problema de salud pública para países de la Unión Europea 47. La mayoría de los casos están asociados con el consumo de productos crudos o poco cocidos, con la falta de higiene en el procesamiento de alimentos, provocando así enfermedades que pueden ser evitadas. Entre ellas, la más prevalente, asociada con la ingesta de pescado es la anisakidosis, considera un problema de salud pública en Europa y Asia, donde la enfermedad es conocida, diagnosticada y cuenta con una legislación clara para minimizar la aparición de ella. Entre los años 2000 y 2016 se reportaron en Europa 236 casos (únicamente en la literatura científica), todos ellos autóctonos y de diagnóstico definitivo 47.
En 62 pacientes, los autores especificaron explícitamente que la infección fue producida por la ingestión de anchoa (Engraulis encrasicolus); España es el país con el mayor número de casos reportados: 158 48, el segundo fue Italia con 67 10. Como método de diagnóstico es común realizar serología en más del 87 % de los casos. Sin embargo, en el 3 % de los reportes el diagnóstico fue realizado por laparotomía exploratoria o gastroscopia 47.
Perspectiva en Colombia
La ubicación geográfica de Colombia con dos océanos y su relación con hábitats marinos y países como Ecuador, donde han sido reportados peces de consumo humano parasitados por nematodos de la familia Anisakidae 49,50, hacen que la pesca represente no solo una actividad económica importante, sino un factor de riesgo para la infección si esta no es manejada adecuadamente.
En la revisión, se encontraron 17 especies reportadas como hospederos, tanto en peces de agua marítima como continental. En el Océano Pacífico se ha reportado en los puertos de Buenaventura y Tumaco y, en el Atlántico, en Cartagena y la Ciénaga del Totumo 49,51,52. De aguas continentales, los ríos Amazonas, Atrato, Cauca, Magdalena, San Jorge y Sinú 51,53,54.
Se han reportado peces de consumo humano parasitados por Anisakis sp., A. physeteris y P. decipiens en el Océano Pacífico. Los géneros Pseudoterranova y Contracaecum en peces del Atlántico y, Contracaecum, en especies de aguas continentales 10,11,45,51.
En la Tabla 1 se presenta el listado de peces reportados en Colombia como hospederos de nematodos anisákidos y, en la Figura 2, el mapa de su distribución.
Tabla 1 Especies de peces reportados como hospederos intermediarios de parásitos de la familia Anisakidae en Colombia
| Hospedero (pez) | Lugar del estudio | Nematodo identificado | Peces revisados (n) | Prevalencia de la infección (%) | ||||
|---|---|---|---|---|---|---|---|---|
| Nombre científico | Nombre común | |||||||
| Ageneiosus caucanus | Doncella | San Marcos, Sucre | Contracaecum sp. | 60 | 23,3 | |||
| Caquetaia kraussii | Mojarra amarilla | San Marcos, Sucre | Contracaecum sp. | 60 | 95 | |||
| Caranx hippos | Jurel | Cartagena, Bolívar | Familia Anisakidae | 12 | 8,5 | |||
| Centropomus armatus | Róbalo | Buenaventura, Valle del Cauca | Anisakis physeteris | 12 | 42 | |||
| Centropomus undecimalis | Róbalo | Cartagena, Bolívar | Familia Anisakidae | 23 | 4,3 | |||
| Hoplias malabaricus | Moncholo | Cartagena, Bolívar | Contracaecum sp. | 227 | 100 | |||
| San Marcos, Sucre | Contracaecum sp | 60 | 93,3 | |||||
| Rio Sinú y San Jorge, Córdoba | Contracaecum spp. | 45 | 100 | |||||
| Larimus argenteus | Silver drum | Buenaventura, Valle del Cauca | Anisakis physeteris | 2 | 100 | |||
| Merluccius gayi | Merluza | Cartagena, Bolívar y Barranquilla, Atlántico | Familia Anisakidae | 134 | 24,6 | |||
| Mugil cephalus | Lisa | Buenaventura, Valle del Cauca | Anisakis physeteris | 12 | 33 | |||
| Buenaventura, Valle del Cauca | Anisakis sp. | 15 | 33 | |||||
| Lebranche | Cartagena, Bolívar | Familia Anisakidae | 19 | 100 | ||||
| Mugil curema | Lisa | Tumaco, Nariño | Anisakis physeteris | 16 | 94 | |||
| Tumaco, Nariño | Pseudoterranova decipiens | 16 | 94 | |||||
| Mugil incilis | Lisa | Cartagena, Bolívar | Contracaecum spp. | 378 | 100 | |||
| Cartagena, Bolívar | Pseudoterranova spp. | 378 | 80,5 | |||||
| Cartagena, Bolívar | Familia Anisakidae | 355 | 83,9 | |||||
| Mugil spp. | Múgil | Cartagena, Bolívar | Familia Anisakidae | 5 | 100 | |||
| Plagioscion magdalenae | Pacora | San Marcos, Sucre | Contracaecum sp. | 60 | 46,7 | |||
| Pseudoplatystoma magdaleniatum | Bagre pintado | San Marcos, Sucre | Contracaecum sp. | 60 | 95 | |||
| Salminus affinis | Rubio | Rio Sinú y San Jorge, Córdoba | Contracaecum sp. | 45 | 95 | |||
| Sciades herzbergii | Barbul chivo | Cartagena, Bolívar | Familia Anisakidae | 64 | 1,6 | |||
| Sorubim cuspicaudus | Blanquillo | San Marcos, Sucre | Contracaecum sp. | 60 | 100 | |||
Fuente: creación propia, basada en los datos obtenidos a partir de las referencias citadas 11,49,51-55
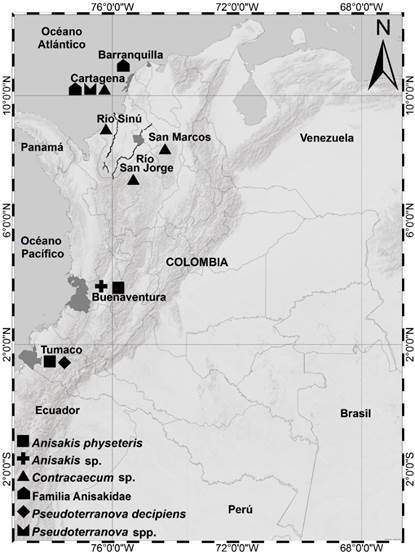
Fuente: adaptación referencias 11,49,51-55
Figura 2 Distribución de nematodos anisákidos reportados en Colombia como hospederos intermediarios de peces para el consumo humano.
Como se observa en la Tabla 1, los peces del grupo de los mugílidos, conocidos como “lisas”, de los cuales las especies Mugil cephalus, M. incilis y M. curema, existen en Colombia, son los que se reportaron con mayor frecuencia como hospederos intermediarios de nematodos anisákidos tipo Anisakis sp., A. physeteris, P decipiens y Contracaecum sp.11,49,51,52,55,56. Los porcentajes de infección en las lisas varía entre el 33 al 100 % 11,49,51-56, este alto porcentaje podría deberse a que estas especies de peces se encuentran tanto en aguas de la Costa Atlántica como en la Pacífica, siendo especies de importancia económica y comercial 10.
En general, los porcentajes de infección por especie de pez se reportan entre un 1,4 a un 100 % 11,49,51-56.
En los estudios realizados en Cartagena, Ciénaga del Totumo y Barranquilla, las especies de peces de consumo Caranx hipos, Centropomus undecimalis, Merluccius gayi, Mugil cephalus, Mugil incilis, Sciades herzbergii, se reportaron como hospederos de nematodos anisákidos 51,55,56. En estos estudios la determinación taxonómica se logró hasta el nivel de familia 51,55,56, probablemente por la complejidad morfológica del estadio larval para su identificación. Por lo tanto, es importante realizar investigaciones que ayuden a la identificación al nivel de la especie, pues existen diferencias clínicas en las manifestaciones de la enfermedad producida por cada una.
En el Pacífico, los reportes indican que los géneros Anisakis 11, Pseudoterranova52, Contracaecum51-54 y, las especies A. physeteris49 y P. decipiens, parasitaron a los peces de consumo Centropomus armatus y Mugil curema, respectivamente, comercializados en Buenaventura y Tumaco 49.
Los reportes de la presencia de Contracaecum sp., están relacionados con peces de aguas continentales. A la fecha no se conocen registros de este género en la región del Pacífico colombiano. Es importante recalcar que el género Contracaecum no cuenta con registros de parasitosis asociadas con humanos y, además, presenta una variación al ciclo de vida, donde este puede involucrar un ave como hospedero intermediario, evento que explica su presencia en peces de agua dulce 47,51.
En la bibliografía consultada solo se encontró un reporte de caso de anisakidosis en Colombia, presentado por Patiño y Olivera (2019). Se definió como de tipo gástrico en una mujer de 52 años, quien posterior a la ingesta de comida típica a base de pescado crudo, desarrolló un cuadro clínico de dos días, consistente en epigastralgia grave, asociada con hiporexia, náuseas, emesis, diarrea y urticaria.
Por hallazgos de dolor a la palpación en la región periumbilical, leucocitosis a expensas de neutrófilos y eosinofilia, se realizó una endoscopia digestiva alta donde se observó la larva alojada en la mucosa antral. Esta fue extraída y fijada en glutaraldehído para un posterior análisis patológico en el que se describió una larva de Anisakis simplex (sensu lato). La paciente presentó remisión de síntomas ulteriores a la extracción del parásito. Además, se le inició manejo con albendazol 400 mg, dosis única 57.
Resaltamos que este reporte fue realizado después de las recientes publicaciones realizadas por Castellanos JA. et al. (2018), donde se describe, por primera vez para Colombia, la presencia de A. physeteris y P. decipiensen peces de consumo comercializados en el puerto de Buenaventura y se hace un llamado a la comunidad científica, el personal de salud y la comunidad en general sobre el riesgo en Colombia de la anisakidosis como una posible enfermedad emergente 49.
En cuanto a la anisakiasis alérgica 3,58,59 en Colombia, se conoce una tesis doctoral donde se documenta en una población de Cali la presencia de anticuerpos dirigidos contra antígenos específicos de A. simplex. La investigación reportó que la población de estudio consumía pescado tres veces al mes y, de un análisis de 150 sueros, se encontró que el 1,3 % de la población presento anticuerpos específicos frente al antígeno recombinante Ani s 7 de A. simplex, siendo este reconocido por el 100 % de las personas que han estado en contacto con el parásito 60.
CONCLUSIONES
Esta revisión permite conocer el panorama actual de la anisakidosis en Colombia respecto a los casos clínicos reportados en humanos, y frente a las especies de peces que se han identificado como hospedadores intermediarios de los nematodos anisákidos en Colombia y demás países vecinos; evidencias que llevan a pensar en esta parasitosis como una enfermedad emergente, zoonosis que por desconocimiento del personal de salud puede estar subdiagnosticada.
Asociado a lo anterior, el aumento de la oferta de preparaciones a base de pescado y mariscos crudos o poco cocidos de origen mediterráneo u oriental, como el sushi y cebiche, obliga a hacer un llamado de atención a las autoridades de salud, con el fin de reforzar la vigilancia de las buenas prácticas de manufactura y elaboración de alimentos, con el objetivo de contrarrestar los peligros que puedan deteriorar la calidad e inocuidad de alimentos derivados del pescado.
En este sentido, consideramos que se requieren estrategias de promoción y prevención, educación médica, implementación de una legislación sobre el manejo del pescado: desde la evisceración temprana posterior a la captura de los peces hasta los procesos de almacenamiento, que requieren congelación a temperaturas estándar (-20 °C), todo esto para tener un control en el número de peces infectados, prevenir el número de casos y combatir el subregistro. No sobra decir que esta medida fue implementada en los Países Bajos donde fue evidente la reducción de los casos.
Finalmente, en Colombia solo se ha reportado un caso de anisakidosis, lo que pone de manifiesto la necesidad de ampliar el estudio de esta parasitosis que se presenta con síntomas poco específicos y diversos que dificultan el diagnóstico.














