INTRODUCCIÓN
La enfermedad pulmonar obstructiva crónica (EPOC), según Polkey MI, et al. (1), se define como: “Una entidad prevenible y tratable, que se caracteriza por una limitación del flujo aéreo persistente, generalmente progresiva, y asociada a una respuesta inflamatoria exagerada de las vías aéreas y del parénquima pulmonar”.
Es actualmente la principal causa de morbilidad crónica alrededor del mundo (2) y la cuarta causa de mortalidad (3); además, se prevé que aumente en las próximas décadas debido a la exposición continua a factores de riesgo y el envejecimiento de la población (4).
La prevalencia de esta enfermedad en el mundo en personas mayores de 40 años es del 10 % (5), mientras que en América Latina alcanza el 12,7 % (6). Para Colombia, el estudio PREPOCOL revela un estimado nacional del 8,9 % y 13,5 % para la ciudad de Medellín (7), la más elevada del país.
Las estimaciones sugieren que la proporción de fumadores mayores de 40 años no diagnosticados es de aproximadamente 1 de cada 5 (8). Este problema crece cuando se considera que la EPOC aumenta como parte de los procesos naturales (por ejemplo, el envejecimiento) o el estilo de vida asociado con otros riesgos cardiovasculares (hipertensión, diabetes mellitus, dislipidemia) (9,10). Actualmente, el subdiagnóstico en países de América Latina llega al 77 % (11) y en Colombia se estimó en el 63 % en el estudio PUMA (12).
La espirometría es la prueba de función pulmonar más frecuentemente empleada para hacer objetiva la medición de la obstrucción del flujo de aire y evaluar el grado en el cual es reversible dicha obstrucción (9). No se recomienda para el tamizaje en individuos sin síntomas respiratorios (13), no es una prueba de primera elección para el diagnóstico temprano y no tiene una relación favorable entre el costo y la efectividad para utilizarla en la población general (14). Entre los problemas de la espirometría están la falta de personal capacitado, de equipos y las recomendaciones necesarias para la aplicación de esta prueba en pacientes con factores de riesgo como el tabaquismo activo o la exposición a combustión de biomasa (15,16).
Existen otros métodos económicos y de alta efectividad para la detección de casos de la EPOC en poblaciones con factores de riesgo (14): los cuestionarios estructurados (17) y los dispositivos electrónicos portátiles diseñados para medir el VEF1 y el volumen espiratorio máximo acumulado en los primeros seis segundos de espiración (VEF6), así como su relación VEF1/VEF6. Estos dispositivos (Piko-6 o Vitalograph COPD- 6) (18,19) son de uso ambulatorio y buscan evitar uno de los defectos más comunes a la hora de realizar las maniobras espirométricas, a saber, la dificultad para obtener una adecuada determinación de la capacidad vital forzada (CVF), parámetro esencial para el diagnóstico de la EPOC por la relación fija (VEF1/CVF < 0,7). Se ha demostrado que el volumen espiratorio forzado en seis segundos (VEF6) es un parámetro más fácil de determinar y un sustituto aceptable de la CVF para el diagnóstico de obstrucción en adultos, lo que permite hacer una aproximación diagnóstica en niveles primarios de atención (20-22).
De acuerdo con lo anterior, este estudio pretende evaluar como estrategia para el diagnóstico temprano de la EPOC el uso del cuestionario de detección de casos de la enfermedad COPD-PS y el dispositivo portátil Vitalograph COPD- 6, en dos unidades de atención primaria de la empresa social del estado (E.S.E): Metrosalud, Medellín-Colombia en 2017.
MATERIALES Y MÉTODOS
Estudio descriptivo de corte transversal, realizado en dos unidades de atención primaria de Metrosalud entre octubre y diciembre de 2017 mediante una búsqueda activa entre personas mayores de 35 años sin diagnóstico previo de la EPOC, o enfermedades respiratorias subyacentes. Se utilizó el cuestionario de tamizaje COPD-PS para identificar personas con factores de riesgo respiratorio, el cuestionario está compuesto por 5 ítems: 2 relacionados con la clínica de la EPOC (falta de aire, tos productiva), un ítem de impacto de la enfermedad (limitación de la actividad debida a problemas respiratorios), otro sobre la historia como fumador y el quinto sobre la edad del participante. Fue desarrollado en EE. UU. (23) y validado recientemente como un instrumento con adecuadas propiedades psicométricas para su uso como herramienta de tamización de la EPOC en la población colombiana, con un alfa de Cronbach del 0,91 y un coeficiente de correlación intraclase de 0,85 (IC95 %: 0,82-0,88, p < 0,001) en el punto de corte de 4 (24). Por lo anterior, se seleccionaron aquellas personas con un puntaje de prueba de COPD-PS ≥ 4, consideradas como en riesgo de sufrir EPOC, a quienes posteriormente se les realizó la prueba de VEF1/VEF6 con el dispositivo Vitalograph COPD-6.
A las personas que realizaron la prueba se les indicó que respirasen lo más profundo posible, luego, que colocasen la boquilla en su boca, sellar los labios firmemente alrededor de ella y soplar fuerte y rápido durante 6 segundos. La maniobra se repite durante tres veces para que el equipo tome el mejor resultado como el definitivo (20).
Este dispositivo electrónico portátil permite obtener los valores de VEF1, VEF 6 y su cociente e incluye además los valores predichos según la ECCS (European Community for Coal and Steel) (25); evaluando simultáneamente el porcentaje del valor obtenido respecto a su teórico para cada parámetro, y si el resultado es anormal permite determinar el índice de obstrucción. La limitación del flujo aéreo de los pacientes se obtuvo del cociente VEF1/VEF6 y el punto de corte para detectar pacientes con potencial diagnóstico de la EPOC se determinó como < 0,75, de acuerdo con la recomendación del estudio de validación del dispositivo (26).
Se obtuvieron dos grupos después de realizar la prueba con el dispositivo Vitalograph COPD-6. El primero tenía VEF1/VEF6 < 0,75, aunque para aquellos que tenían un IMC ≥ 30 kg/m2, se consideró ≤ 0,77 según las recomendaciones de Gonçalves et al., (27). Estos fueron los casos que representaron el grupo de personas con potencial diagnóstico de la EPOC. El segundo grupo fueron quienes mostraron la prueba negativa para la EPOC, VEF1/VEF6 ≥ 0,75. A los pacientes con resultado positivo para la EPOC se les daba la recomendación de realizarse una espirometría, dado que sigue siendo la prueba indicada para el diagnóstico (28).
Para evaluar el impacto de la EPOC en la calidad de vida de las personas que se diagnosticaron se utilizó la prueba de CAT, que muestra una buena correlación con otras pruebas de referencia en la medición de la calidad de vida de los pacientes con la EPOC, como el SGRQ o el mMRC (29-31).
La prueba CAT fue desarrollada por PW Jones et al., en el 2009 (29), a partir de una revisión de la literatura, encuestas a médicos y, principalmente, a través de entrevistas de pacientes con la EPOC en las que se buscaba determinar qué cuestiones relacionadas con la calidad de vida eran importantes para ellos. Mediante el empleo de análisis psicométricos se seleccionaron por criterios clínicos y estadísticos un total de 8 ítems que valoraban diversos aspectos físicos y psicológicos relacionados con el impacto de la EPOC sobre su estado. Ha sido validada en diferentes países y para Colombia los resultados mostraron un alfa de Cronbach del 0,71, siendo considerada como una prueba aceptable (32).
La disnea es el principal síntoma de la enfermedad, por ello es importante estandarizar su medición con la escala indirecta modificada del Medical Researh Council (mMRC) (33), utilizada en los casos seleccionados.
Los análisis estadísticos se calcularon empleando el software SPSS, versión 21. La descripción de las variables cualitativas se realizó por medio de frecuencias relativas y porcentajes. Se utilizó la prueba de Kolmogórov-Smirnov para comprobar la distribución de las variables cuantitativas y se determinó que provenían de una población con distribución normal. Para evaluar si existían diferencias significativas se empleó la prueba de Chi2.
Este estudio contó con la aprobación del Comité de Ética de la Corporación Universitaria Remington, junto con el consentimiento informado de cada participante, estuvo de acuerdo con todos los principios éticos establecidos en la Declaración de Helsinki del 2013, y la Resolución N° 008430 de 1993 del Ministerio Nacional de Salud para la investigación en humanos.
RESULTADOS
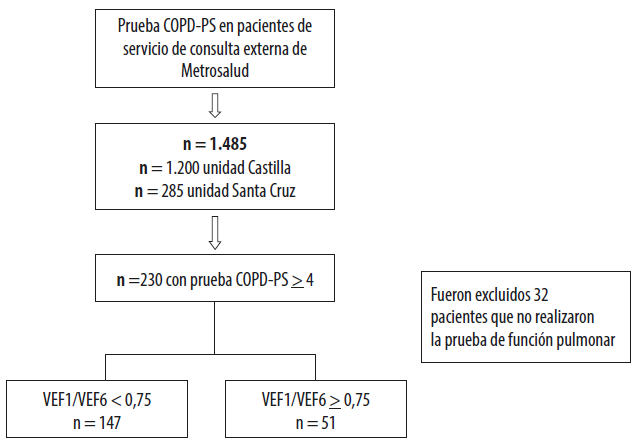
Se realizó la prueba de COPD-PS a 1.485 usuarios de la E.S.E Metrosalud en Medellín: 1.200 en la unidad hospitalaria de Castilla y 285 en la unidad hospitalaria de Santa Cruz. 230 participantes presentaron un puntaje ≥ a 4, estos fueron seleccionados para la aplicación de la prueba VEF1/VEF6. Se excluyeron 32 porque no realizaron la prueba con el Vitalograph COPD-6 o tenían alguna contraindicación para ella, para un total de 198 pacientes para el análisis (Figura 1).
Las características de los participantes con riesgo de tener la EPOC por prueba de COPD-PS ≥ 4 se muestra en la Tabla 1.
Tabla 1 Características sociodemográficas de los pacientes con riesgo de la EPOC
| Variable | n = 198 (%) |
|---|---|
| Sexo | |
| Mujer | 138 (69,7) |
| Hombre | 60 (30,3) |
| Edad (, DS)* | 61,5 (9,2) |
| IMC | |
| Bajo peso | 6 (3,0) |
| Normal | 86 (43,4) |
| Sobrepeso | 68 (34,3) |
| Obesidad | 38 (19,2) |
| Nivel educativo | |
| Ninguno | 40(20,2) |
| Primaria | 103(52,0) |
| Secundaria | 48(24,2) |
| Tecnológica | 7 (3,5) |
| Ocupación | |
| Ama de casa | 87 (43,9) |
| Otros Oficios | 111 (46,1) |
| Apoyo familiar | |
| Sí | 112 (56,6) |
| No | 86 (43,4) |
| IPS cerca de casa | |
| Sí | 96 (48,5) |
| No | 102 (51,5) |
| Hábito tabáquico | |
| Activo | 69 (34,8) |
| Exfumador | 108 (54,5) |
| No fumador | 15 (7,6) |
| Fumador pasivo | 6 (3,0) |
| Espirometría | |
| Sí | 21 (10,6) |
| No | 177 (89,4) |
| Tos | |
| Sí | 71 (35,9) |
| No | 127 (64,1) |
* = promedio, DS= desviación estándar
Fuente: creación propia
Los 198 pacientes a los cuales se les realizó la prueba de VEF1/VEF6 tuvieron una edad media de 61,5 ± 9,2 años, el 69,7 % fueron mujeres (n = 138), el 20,2 % indicó no tener ningún grado de escolarización y en su totalidad pertenecían al régimen subsidiado de salud.
Del total de pacientes con potencial riesgo de la EPOC, 51 (25,8 %) no tuvieron prueba positiva para el dispositivo Vitalograph COPD-6 y 147 (74,2 %) tuvieron una prueba positiva, determinada por un coeficiente de VEF1/VEF6 < 0,75, o ≤ 0,77 para quienes tenían un IMC ≥ 30 kg/m2, que representan los pacientes con un posible diagnóstico de la enfermedad. Las características de los dos grupos se muestran en la Tabla 2.
Tabla 2 Comparación de pacientes con potencial diagnóstico de la EPOC y pacientes sin ella
| Variables | Potencial EPOC n = 147 | No EPOC n = 51 | |||
|---|---|---|---|---|---|
| N | % | N | % | ||
| Sexo | |||||
| Hombre | 46 | 30,3 | 14 | 27,5 | |
| Mujer | 101 | 69,7 | 37 | 72,5 | |
| Edad | |||||
| 35-45 | 12 | 8,2 | 1 | 2,0 | |
| 46-60 | 52 | 35,4 | 20 | 39,2 | |
| > 60 | 83 | 56,5 | 30 | 58,8 | |
| IMC | |||||
| Bajo peso | 5 | 3,4 | 1 | 2,0 | |
| Normal | 67 | 45,6 | 20 | 39,2 | |
| Sobrepeso | 47 | 32,0 | 20 | 39,2 | |
| Obesidad † | 28 | 19,0 | 10 | 19,6 | |
| Síntomas | |||||
| Disnea (mMRC) | |||||
| 0 | 31 | 21,1 | 16 | 31,4 | |
| 1 | 31 | 21,1 | 6 | 11,8 | |
| 2 | 37 | 25,2 | 12 | 23,5 | |
| 3 | 33 | 22,4 | 12 | 23,5 | |
| 4 | 15 | 10,2 | 5 | 9,8 | |
| Comorbilidades | |||||
| ≥ 1 | 83 | 56,5 | 23 | 45,1 | |
| Ninguna | 64 | 43,5 | 28 | 54,9 | |
| *Años totales de consumo | Promedio (DS) | 29,8 (17,0) | 25,2 (17,6) | ||
| Menos de 10 | 27 | 18,4 | 15 | 29,4 | |
| 11-20 | 15 | 10,2 | 10 | 19,6 | |
| 21-30 | 26 | 17,7 | 2 | 3,9 | |
| 31-40 | 40 | 27,2 | 12 | 23,5 | |
| 41-50 | 24 | 16,3 | 11 | 21,6 | |
| > 50 | 15 | 10,2 | 1 | 2,0 | |
| Tos | |||||
| Sí | 50 | 34,0 | 21 | 41,2 | |
| No | 97 | 66,0 | 28 | 58,8 | |
| Hábito tabáquico | |||||
| Fumador | 55 | 37,4 | 14 | 27,5 | |
| Exfumador | 78 | 53,1 | 30 | 58,8 | |
| Pasivo | 4 | 2,7 | 2 | 3,9 | |
| Nunca ha fumado | 10 | 6,8 | 5 | 9,8 | |
| *Apoyo familiar | |||||
| Sí | 76 | 51,7 | 36 | 70,6 | |
| No | 71 | 48,3 | 15 | 29,4 | |
| IPS cerca de casa | |||||
| Sí | 74 | 50,3 | 29 | 56,9 | |
| No | 73 | 49,7 | 22 | 43,1 | |
| Calidad de vida, impacto (CAT) | |||||
| Bajo | 67 | 45,6 | 23 | 45,1 | |
| Medio | 69 | 46,9 | 23 | 45,1 | |
| Alto | 11 | 7,5 | 5 | 9,8 | |
* p < 0,05. † Punto de corte del cociente VEF1/VEF6 ≤ 0,77. Fuente: creación propia
El 34,8 % de los casos potenciales de diagnóstico de la EPOC son fumadores activos y padecen los síntomas comunes de esta enfermedad. Se observa que la disnea en un 42,2 % fue estadio 0-1, (normal o leve), 66,0 % no reportaron tos y una alta proporción (88,4 %) no requirió consultar por urgencias, ni hospitalizaciones en los últimos 12 meses (96,5 %).
El impacto de la enfermedad sobre la calidad de vida de los pacientes con la EPOC, medido con la prueba de CAT, muestra un efecto bajo en el 45,6 %, moderado en el 46,9 % de los pacientes y, en el 7,5 %, alto. La comorbilidad más prevalente fue la hipertensión arterial (31,8 %).
DISCUSIÓN
Se debe tener en cuenta que la EPOC es un problema de salud pública y que un diagnóstico temprano puede cambiar el pronóstico de la enfermedad (34); además, es importante que desde las unidades de atención primaria se implementen estrategias que permitan la detección temprana de personas con factores de riesgo (35).
El principal hallazgo de este estudio fue la detección de posibles casos de la EPOC en un 74,2 % de los pacientes, que resultaron positivos para la prueba con el dispositivo portátil Vitalograph COPD-6, valor que es superior al promedio nacional estimado por el estudio PUMA (11), cuyo hallazgo fue de 62,8 %, pero consistente con la prevalencia de subdiagnóstico para América Latina de 77 %.
Estudios como el de Lamprecht et al. (36), que evaluó el subdiagnóstico en 44 ciudades de 27 países con 30.874 participantes y encontró una prevalencia del 81,4 %, sugieren que esta proporción es diferente en cada lugar, debido a la variación de factores como la edad, el género, la educación y el hábito tabáquico; especialmente en participantes con bajo nivel de estudio y pocos ingresos económicos, características similares a las de la población nuestra, donde solo el 3,5 % supera la educación básica y el 100 % pertenece al régimen subsidiado de salud, lo que podría explicar el aumento con respecto al valor promedio para Colombia.
La espirometría es la forma más indicada para diagnosticar la EPOC (28) pero no es actualmente la más económica para la búsqueda temprana, ya que se deben realizar 11 exámenes para detectar un caso de la EPOC (14,37), lo que conlleva un alto costo para una prueba de tamización.
Las estrategias más efectivas para la detección temprana de pacientes con sospecha de la EPOC son los cuestionarios estructurados y los dispositivos portátiles que miden el cociente VEF1/VEF6 (14), que han demostrado ser las estrategias de menor costo y alta efectividad (38), además, de optimizar la búsqueda activa de pacientes con la EPOC en la población general.
En relación con los síntomas habituales de la enfermedad, como la disnea y demás parámetros que establecen su severidad como las consultas por urgencias u hospitalizaciones en el último año, los resultados indican que un alto porcentaje de pacientes no presentan síntomas evidentes de la EPOC. El grado de disnea medido por la escala mMRC (33) es bajo en la mayoría de los pacientes, lo que apoya la asociación del subdiagnóstico con estadios iniciales poco sintomáticos de obstrucción (GOLD I-II) y sin efectos importantes en la calidad de vida de las personas (39,40).
También se encontró que, a pesar de que los potenciales casos de diagnóstico de la EPOC eran en gran proporción fumadores activos o exfumadores, no reportaron haber tenido solicitudes de espirometría de parte del personal médico, situación que se describe en otros estudios como el de Miguel Díez et al. (16), quien indica que el uso de esta prueba para el diagnóstico de la EPOC se relaciona con el nivel de atención (primaria o especializada). La mayoría de los casos se diagnostican solo en consulta con médico especialista en neumología y tan solo un 26 % se hace en unidades primarias de atención (41).
LIMITACIONES
El estudio puede tener sesgo de selección, debido a que la muestra fue tomada en centros de salud en los cuales se presta atención solo a personas afiliadas al régimen subsidiado del sistema de salud y, a que el 70 % de los participantes fueron mujeres, dado que esta enfermedad se ha descrito con mayor prevalencia en hombres en América Latina (42). Igualmente, la validez externa puede ser afectada debido a que esta población tiene características socioeconómicas particulares.
El cuestionario COPD-PS no tiene en consideración la exposición a biomasa, un factor de riesgo común en nuestro medio en las mujeres adultas mayores, lo que podría causar que personas con esta exposición no fueran tenidas en cuenta para el tamizaje con el Vitalograph COPD-6, según el resultado del cuestionario menor de 4. Además, no se realizó la espirometría, la cual hubiese permitido excluir a aquellos que no tienen el diagnóstico y confirmar el mismo.
CONCLUSIONES
Estos resultados muestran el riesgo de sufrir EPOC como un problema grave en las unidades de atención hospitalarias evaluadas. Podrían representar el panorama general de lo que ocurre en otras unidades de atención de la E.S.E. Metrosalud.
Las estrategias de tamizaje con pruebas escritas y el uso de dispositivos sencillos como el Vitalograph, podrían mejorar el diagnóstico temprano de la EPOC en los centros de atención que no cuentan con el equipo para realizar espirometría de forma habitual. Así mismo, la utilización de un cuestionario de selección de pacientes (23) puede ser efectiva para detectar aquellos con factores de riesgo y aplicarles la prueba de función pulmonar, lo que disminuiría los costos.
Sin embargo, por las limitaciones del estudio, se recomienda seguir desarrollando nuevas investigaciones en el campo para conocer con más exactitud el desempeño de estas estrategias.