INTRODUCCIÓN
El derrame pleural es una entidad frecuente en la práctica clínica (1). Afecta aproximadamente a 1,5 millones de personas en Norte América cada año. Dentro de las causas más frecuentes se destaca la falla cardiaca congestiva, el derrame paraneumónico, la malignidad y la embolia pulmonar (2,3). Esta situación cambia en nuestro continente, donde en algunas series se menciona la tuberculosis, neumonía y la malignidad como las principales causas del derrame pleural (4,5). La mortalidad es alta (10-20 %) si el derrame es de etiología infecciosa, específicamente, el derrame pleural paraneumónico complicado o empiema, donde el diagnóstico y tratamiento precoz (antibiótico según la epidemiología local y los factores de riesgo para la resistencia bacteriana, además del drenaje según el caso y la preferencia del especialista) impactará en el pronóstico y supervivencia de los pacientes (6,7).
La prevalencia estimada de derrame pleural es de 320 casos por cada 100,000 personas en países industrializados, con una distribución de etiologías relacionadas con la prevalencia de enfermedades subyacentes (8).
Esta revisión permite examinar el estado del arte del derrame pleural, dar pautas y claves para permitir al clínico adquirir conocimiento actualizado sobre la fisiopatología, la aproximación clínica y el diagnóstico, con preguntas y respuestas útiles según la evidencia de esta enfermedad.
Fisiopatología
El espacio pleural es una cavidad virtual dentro de la caja torácica entre la pleura parietal y visceral.
Normalmente, se produce una pequeña cantidad fisiológica de líquido pleural: cerca de 0,1-0,26 ml/kg (9,10). Existe un equilibrio en el que hay una tasa aproximadamente igual de formación (“entrada”) y absorción (“salida”) del líquido (11), el cual permite lubricar la superficie de las pleuras y facilitar el movimiento de los pulmones a través de la pared torácica y el diafragma durante la inspiración y la espiración (12).
El derrame pleural es una acumulación anormal de líquido en el espacio pleural (13). Está explicado, principalmente, por el aumento de la producción de líquido con capilares normales por incremento de la presión hidrostática o disminución de la presión oncótica (trasudado), mayor producción de líquido por permeabilidad capilar anormal (exudado), disminución de la eliminación linfática del líquido del espacio pleural (exudado), infección en el espacio pleural (empiema), hemorragia hacia el espacio pleural (hemotórax) y exceso de presión negativa intrapleural, como es el caso de una atelectasia (14-16). La diferenciación es muy importante, ya que en los exudados la pleura está enferma, mientras que en los trasudados la pleura está sana. La enfermedad que la genera suele ser sistémica y la sospecha aumenta con base en sus antecedentes y hallazgos al examen físico (17).
Las principales causas del trasudado y exudado se muestran en la Tabla 1 (18). Los hallazgos celulares normales del líquido pleural corresponden a 1.000-1.500 células, en las cuales predominan los monocitos (30-75 %) y las células mesoteliales, además de linfocitos (has-ta el 25 %), neutrófilos (2 %) y, en condiciones normales, no se encuentran glóbulos rojos (3,19).
Tabla 1 Causas del derrame pleural
| Exudado | Trasudado |
|---|---|
| Infeccioso | Falla cardiaca congestiva |
| Neoplasias | Cirrosis |
| Derrame paraneumónico | Síndrome nefrótico/glomerulonefritis |
| Embolia pulmonar | Diálisis peritoneal. |
| Lupus eritematoso sistémico, artritis reumatoide, síndrome de Sjögren, vasculitis, entre otras. | Hipoalbuminemia (< 1,5 mg/dl) |
| Infarto agudo de miocardio, post baipás coronario. | Atelectasia |
| Medicamentos: nitrofurantoína, dantroleno, dasatinib, amiodarona, metotrexato, clozapina, fenitoína, beta-bloqueadores. Otros: hemotórax, quilotórax, patología abdominal (pancreatitis, absceso intrabdominal). | Obstrucción de la vena cava superior, sarcoidosis, mixedema, urinotórax, embolismo pulmonar, enfermedad pericárdica, hipertensión arterial pulmonar. |
Fuente: adaptación de Feller-Kopman D et al. (18)
Aproximación clínica y diagnóstica
El primer paso para el médico que se enfrenta a un paciente con sospecha de derrame pleural es realizar una historia clínica completa, donde incluya antecedentes personales, historia de las enfermedades respiratorias, cardiopatías, neoplasias, consumo de medicamentos, síntomas constitucionales, exposiciones ocupacionales como el asbesto (si la exposición es de larga data, aumenta el riesgo de mesotelioma maligno) (20), factores de riesgo para la embolia pulmonar, tuberculosis u otras enfermedades como el lupus eritematoso sistémico, hipotiroidismo, amiloidosis, síndrome de uña amarilla, entre otras (21-24). Aunque es poco usual, una serie de medicamentos han sido descritos como los más frecuentes para producir derrame pleural. Entre ellos se destaca al metotrexato, amiodarona, la fenitoína, nitrofurantoína y los beta-bloqueadores (25-27).
Los pacientes con derrame pleural pueden presentarse asintomáticos o consultar con disnea, tos o dolor torácico pleurítico (28).
¿Qué rol y evidencia tiene el examen físico cuando nos enfrentamos a un paciente con derrame pleural?
El examen físico es menos preciso que la ecografía o la tomografía computarizada para detectar un derrame pleural. Sin embargo, la sensibilidad y especificidad de la semiología en estos casos pueden ser comparables con los de la radiografía de tórax convencional (29). En una revisión de Shellenberger et al., recientemente, publicada en la Revista de Medicina de la Clínica de Cleveland (Estados Unidos), se describe que los pacientes que se presentan con tos o disnea deben ser evaluados para derrame pleural o neumonía. Por lo que, recomiendan evaluar la presencia, inicialmente, de la expansión torácica asimétrica con una razón de verosimilitud positiva de 44,1 para neumonía y, de 8,1, para efusión pleural. El segundo signo que describen y aporta para aumentar la probabilidad es la matidez a la percusión de tórax con una razón de verosimilitud positiva de 8,7. (28,30).
Finalmente, la auscultación puede estar disminuida, abolida o incluso normal. No obstante, tener ruidos respiratorios disminuidos puede estar en ambas condiciones ya descritas, pero la resonancia vocal (egofonía o broncofonía) y el frémito táctil no están directamente relacionados con un derrame pleural, contrario a un paciente con derrame paraneumónico o neumonía con empiema concomitante, donde la combinación de estos hallazgos puede estar presente (30). En la Tabla 2 se resumen las razones de verosimilitud positiva y negativa, además de la sensibilidad y especificidad de algunos signos que sugieren derrame pleural (28,31-33).
Tabla 2 Signos del derrame pleural
| Signos | Razón de verosimilitud positiva | Razón de verosimilitud negativa | Sensibilidad | Especificidad |
|---|---|---|---|---|
| Matidez a la percusión | 8,7 | 0,31 | 53-89 % | 71 % |
| Expansión torácica asimétrica | 8,1 | 0,29 | 74 % | 91 % |
| Frémito táctil disminuido | 5,7 | 0,21 | 82 % | 86 % |
| Resonancia vocal disminuida | 6,5 | 0,27 | No reportado | No reportado |
Fuente: adaptación de Shellenberger et al. (30)
¿Qué imágenes debo utilizar para evaluar al paciente con derrame pleural?
En un porcentaje significativo la clínica de los pacientes es inespecífica y, con el fin de evaluar los diagnósticos diferenciales en un paciente que se presenta con dificultad respiratoria o los otros síntomas ya mencionados, los rayos X de tórax con proyección PA y lateral sigue siendo un examen ampliamente disponible y debe ser la primera elección.
Los signos más frecuentes encontrados al evaluar la radiografía son la elevación del hemitórax, el desplazamiento lateral del domo diafragmático y la obliteración del ángulo costofrénico (34). Se necesitan al menos 75 ml para obliterar el surco costo frénico posterior y un mínimo de 175 ml para borrar el surco lateral en una radiografía de tórax vertical. Un derrame pleural de 500 ml borrará el contorno diafragmático en una radiografía de tórax vertical y si el derrame pleural alcanza el nivel de la cuarta costilla anterior, hay cerca de 1.000 ml (35).
Si existe sobreposición de estructuras o duda diagnóstica, se recomienda una proyección adicional en decúbito lateral con rayo horizontal. Útil para derrames subpulmonares o más pequeños (36). Al evaluar una radiografía de tórax, el clínico se puede enfrentar con derrames bilaterales, masivos o loculados. La causa más común del derrame pleural bilateral es la insuficiencia cardiaca congestiva. Otros hallazgos radiológicos que aumentan la probabilidad de que el derrame sea por congestión son la cefalización o vascularización, la redistribución, el edema intersticial o alveolar y la cardiomegalia (37). En este caso, muy probablemente corresponderá con un trasudado y, por tanto, no requiere de estudio, a menos de que el derrame impida una adecuada mecánica respiratoria o tenga hallazgos atípicos (25).
Con derrames pleurales bilaterales y un tamaño cardiaco normal, el diagnóstico diferencial debe incluir malignidad y, con menos frecuencia, pleuritis por lupus y pericarditis constrictiva. Los derrames masivos opacan todo el hemitórax y desplazan estructuras mediastinales contralateralmente, a menos que una neoplasia obstruya el bronquio principal ipsilateral o un mediastino fijo por un tumor invasor (por ejemplo, el mesotelioma) esté presente.
El otro diagnóstico diferencial de opacidad en todo el hemitórax es la atelectasia. Contrario al derrame pleural, esta desplaza las estructuras mediastinales ipsilateralmente. Alrededor del 60 % de los derrames masivos se deben al cáncer, seguidos de los derrames paraneumónicos (20 %) y, en menor medida, la tuberculosis e hidrotórax hepático. Los derrames loculados ocurren en presencia de adherencias entre superficies pleurales contiguas, se observan típicamente en condiciones que causan una importante inflamación pleural como los derrames paraneumónicos, empiemas, hemotórax y tuberculosis (38).
La ultrasonografía cada vez toma más fuerza para el estudio de la disnea a la cabecera del paciente. Es más sensible que la radiografía e, incluso, que la tomografía contrastada para ver septos. Puede confirmar la presencia del líquido y cuantificarlo, además, revelar tabiques y loculaciones. Asimismo, permite guiar el procedimiento de toracentesis, disminuyendo las complicaciones como un neumotórax iatrogénico (39-42).
En caso de que la ecografía demuestre hallazgos complejos como los derrames septados, loculados o, incluso, no diagnóstico, es útil una tomografía de tórax contrastada para descartar la malignidad, diagnósticos diferenciales como las linfadenopatías mediastinales, anormalidades del parénquima pulmonar, compromiso pericárdico, enfermedad subdiafragmática o embolia pulmonar (39,38).
¿Cuándo debo realizar una toracentesis diagnóstica?
Se recomienda realizar una toracentesis si en la placa del tórax en decúbito lateral el grosor del derrame supera 1 o 2 cm, al igual que en una tomografía computarizada o ecografía, y no se cree que el derrame sea secundario a una falla cardiaca congestiva (39). Cabe resaltar que los pacientes que tengan asimetría de su derrame (principalmente izquierdo mayor que derecho), fiebre, síntomas constitucionales sugestivos de neoplasia, un ecocardiograma que no sugiere insuficiencia cardiaca, un gradiente de oxígeno alveolararterial desproporcionadamente alto o la falta de resolución con una terapia diurética eficaz, deben ser candidatos para un estudio de líquido pleural. (43,44).
Las consideraciones de pacientes que son candidatos para toracentesis con coagulopatías reportada en la literatura son contradictorias. En una serie retrospectiva se reporta que la trombocitopenia menor a 50.000 plaquetas/mm3, una razón normalizada internacional (sigla en inglés INR) mayor a 2 o una creatinina sérica mayor a 6 miligramos por decilitro son contraindicaciones absolutas. Sin embargo, varios estudios en los últimos años resaltan la seguridad de la toracentesis con INR aumentado y trombocitopenia, especialmente, cuando es guiada por ecografía y por personal entrenado (45-48). A pesar de ello, todo paciente debe ser individualizado, en caso de que requiera reversión de anticoagulación previa se debe basar en los beneficios y la urgencia de la toracentesis versus la probabilidad del sangrado en el espacio pleural. La infección activa en el sitio de inserción es una contraindicación absoluta (43).
¿Qué exámenes debo solicitar cuando se realiza una toracentesis?
Las pruebas iniciales para realizar en el líquido pleural incluyen recuento y diferencial celular, pH, proteínas, lactato deshidrogenasa (LDH) y glucosa. Se debe extraer al menos 50 mililitros para un correcto análisis. Se deben tener en cuenta los datos de la historia clínica y anamnesis, se solicitarán los estudios como la amilasa, el colesterol, los triglicéridos, péptido natriurético procerebro N-terminal (BNP), creatinina, adenosina desaminasa, tinción de bacilos acidorresistentes (BAAR), cultivo bacteriano, un cultivo de bacterias acidorresistentes (AFB, sigla en inglés) y, bloque celular para los casos que sugieran malignidad. Si la recolección de la muestra fue satisfactoria, al mismo tiempo se debe solicitar en la sangre glucosa, LDH y proteínas totales (18,27,39,49).
¿Es un trasudado o exudado?
Como se había mencionado anteriormente, el estudio del líquido pleural debe ser enfocado al paciente, en el que no se tiene clara la causa del derrame o en aquel en el que la condición o diagnóstico clínico lo indique, como en el caso de los hallazgos atípicos de la falla cardiaca congestiva.
Antes de definir si es un trasudado o exudado, hay hallazgos semiológicos del líquido pleural que vale la pena recordar, pues dan pautas al clínico para orientar el diagnóstico. La presencia de pus indica un empiema; asimismo, el líquido de color negro ha sido descrito en la infección por aspergillus, cuando se detecta en la sangre se debe descartar una causa traumática, por lo que es necesario medir el hematocrito del líquido pleural y, si este es mayor a 50 %, se considerará un hemotórax, si este se descarta, se deberá considerar cáncer o embolia pulmonar (49,50). El olor a pútrido indica empiema por anaerobios y, a amonio, urinotórax (49). En la Tabla 3 se resumen las principales características macroscópicas del líquido pleural que orientan al clínico.
Tabla 3 Características semiológicas del líquido pleural
| Color de líquido | Diagnóstico sugestivo |
|---|---|
| Amarillo pálido | Trasudado |
| Blanco lechoso | Quilotórax |
| Café | Ruptura de absceso hepático amebiano |
| Negro | Aspergillus, melanoma metastásico, fístula pancreatopleural, adenocarcinoma broncogénico, perforación esofágica durante el tratamiento con carbón activado. |
| Amarillo-verdoso | Pleuresía reumática |
| Verde oscuro | Biliotórax |
El análisis del líquido pleural debe ser basado en los criterios de Light, los cuales tienen una sensibilidad que alcanza el 98 %, mientras su especificidad puede variar entre el 73-80 % (44,51). Se considerará un exudado si cumple, únicamente, con uno de los siguientes tres criterios (3):
Proporción de proteínas totales en pleura sobre sérica mayor a 0,5.
Lactato deshidrogenasa pleural sobre sérica mayor a 0,6.
Lactato deshidrogenasa pleural mayor a dos tercios del límite superior de la normalidad sérica.
Sin embargo, dada su baja especificidad, hasta el 25 % de los pacientes con falla cardiaca congestiva son mal clasificados como exudados, por lo que será necesario evaluar, adicionalmente, el gradiente albumina en suero menos albumina en líquido pleural. En caso de que sea mayor a 1,2 gr/L será un trasudado que puede deberse al uso reciente de diuréticos. En caso de que la albumina no esté disponible, un gradiente de proteínas mayor a 3,1 gr/L puede tener utilidad (37). Otra ayuda utilizada, pero a un precio costoso, sobre todo en nuestro país, es el péptido natriurético procerebro N-terminal (NT-proBNP, sigla en inglés); con valores medidos por encima de 1.500 pg/ml, orientan el diagnóstico de trasudado en un paciente con alta probabilidad de tener falla cardiaca o, en caso de que exista duda diagnóstica, con un hidrotórax hepático (37,39).
Otros autores proponen al menos uno de los siguientes criterios para definir un exudado (49):
¿Qué tipo de exudado tiene mi paciente?
Una vez determinado que el líquido pleural es un exudado, se hace necesario determinar la celularidad del líquido para definir si es un exudado neutrofílico, linfocitario o eosinofílico. Cabe señalar que, si el recuento celular es mayor al 50 %, predominantemente de neutrófilos, indica que es un proceso agudo. Mientras que, si es mayor al 50 %, predominantemente de linfocitos, indica que el proceso es crónico (38).
Exudado linfocitario
Cuando el conteo celular es mayor al 50 % es indispensable evaluar la citología del líquido pleural para descartar malignidad. Sin embargo, la prueba tiene una sensibilidad de aproximadamente el 60 %, la cual aumenta en un 15 % con una segunda muestra (49). El bloque celular puede ser de utilidad para las tinciones especiales y los marcadores tumorales en los casos en los que aún no hay diagnóstico. Dentro de las causas más comunes del derrame pleural maligno se destaca las neoplasias pulmonares, incluyendo, el mesotelioma, cáncer de seno y linfoma.
Infortunadamente, la presencia de derrame pleural maligno, independientemente del sitio primario, se traduce en una enfermedad en estado avanzado. El tratamiento requiere de un manejo interdisciplinario y dependerá del pronóstico evaluado con la escala LENT (sigla en inglés, LDH en el líquido pleural, esta-do de rendimiento del Eastern Cooperative Oncology Group [ECOG], relación neutrófilos-linfocitos en el suero y tipo de tumor) (52-54).
En caso de que la citología sea negativa y no haya sospecha de malignidad, se debe sospechar tuberculosis pleural. Según el reporte global de la OMS para el presente año, la tuberculosis es la principal causa de muerte de origen infeccioso (superando al virus de la inmunodeficiencia humana y síndrome de inmunodeficiencia adquirida) (55).
En Colombia la tuberculosis es considerada un evento de interés en salud pública, con una tasa de incidencia para el 2018 de 26 casos por cada 100.000 habitantes. En este sentido, la tuberculosis pleural es la forma más prevalente de tuberculosis extrapulmonar en nuestro país con un 38,3 %, por lo que debe ser para el médico un reto buscar esta condición en pacientes que se presentan con derrame pleural y clínica sugestiva (56). En las primeras fases de la enfermedad puede estar presente un exudado neutrofílico, luego de esto hay una hipersensibilidad mediada por linfocitos T, que genera en conjunto con los macrófagos una respuesta inflamatoria aumentado la permeabilidad capilar y alterando el drenaje linfático, con el consecuente exudado linfocitario (57).
La baciloscopia es positiva en menos del 5 % de los casos de pleuritis tuberculosa, debido a la naturaleza paucibacilar de la enfermedad. El cultivo micobacteriano del líquido pleural también tiene baja sensibilidad (24-58 %) y puede tardar hasta 8 semanas en obtenerse el resultado si se usan medios de cultivo sólidos (58), por lo que es útil para acercarse al diagnóstico recurrir a otras pruebas como lo son la medición de la adenosina desaminasa (ADA), un marcador inflama-torio no especifico, con punto de corte de 32 según las guías del Ministerio de Salud y Protección Social y el Instituto Nacional de Salud (57).
Cuando se encuentran niveles mayores de ADA en el líquido pleural estos predicen mejor el diagnóstico de tuberculosis con una sensibilidad que varía del 90-100 % y una especificidad del 89 al 100 % (58). No obstante, los niveles de ADA pueden estar elevados en otras enfermedades como el empiema o derrame paraneumónico, la brucelosis, los linfomas y la artritis reumatoide (50).
Otro de los métodos diagnósticos que ha reportado la literatura es la reacción en cadena de polimerasa en tiempo real (RT-PCR) de tipo cualitativo, la cual identifica el ADN de la micobacteria, con la posibilidad de detectar resistencia a la rifampicina en el caso de la prueba molecular GeneXpert® MTB/RIF en menos de 48 horas, con una buena especificidad para el diagnóstico de tuberculosis pleural. Sin embargo, debido a que sus valores predictivos no son suficientemente altos (VPP: 75,0 % y VPN: 90,6 %), no debe utilizarse para el diagnóstico definitivo de la enfermedad (59,60). Teniendo en cuenta lo anterior, se ha recomendado utilizar la combinación de varias pruebas, incluyendo la ADA, los cultivos y la tinción de Ziehl-Neelsen (ZN), en último lugar, la biopsia con tinción del tejido pleural para el diagnóstico definitivo (58,61).
La sarcoidosis, el linfoma, quilotórax y pseudoquilotórax son diagnósticos diferenciales para considerar. En el caso del linfoma, la citometría de flujo puede ser útil en la evaluación del compromiso pleural (21).
Exudado neutrofílico
La valoración clínica o diagnóstica previa orientará la causa. Los pacientes con diagnóstico de neumonía o con factores de riesgo para empiema (por ejemplo, aspiración), fiebre persistente o de nueva aparición o, falta de respuesta clínica a pesar de la antibioticoterapia empírica, debería aumentar la sospecha de un derrame paraneumónico. Sumado a esto, una imagen que sugiere una consolidación en la presencia de la efusión pleural ipsilateral definirá el diagnóstico de un derrame paraneumónico (62). De acuerdo con el estudio y análisis del líquido pleural, si se considera que es un derrame paraneumónico complicado o empiema, se precisa de intervenciones adicionales como la toracotomía o el manejo por cirugía de tórax para evaluar si el paciente es candidato quirúrgico por toracoscopia, en los casos de septos, bolsillos o derrames ampliamente loculados. Dependiendo de la condición clínica y preferencia del especialista (neumólogo o cirujano de tórax), la terapia fibrinolítica es otra opción descrita en la literatura (62,63). Cualquiera de los siguientes son hallazgos que indican un empiema (6): aspecto del líquido purulento o turbio, Ph menor a 7,2, LDH en líquido pleural mayor a 1.000 UI/L, glucosa menor a 40 mg/dl, gram y cultivo positivo.
En los casos en que no hay evidencia de neumonía clínica y radiológica con un gram y cultivo negativo, la anamnesis, clínica y factores de riesgo orientarán a una enfermedad autoinmune, los medicamentos descritos anteriormente o embolia pulmonar (21).
Exudado eosinofílico
Se define como un conteo de eosinófilos en el líquido pleural mayor al 10 %. Están asociados a malignidad y a una miscelánea de etiologías benignas como el neumotórax, hemotórax, infarto pulmonar, infecciones parasitarias, fúngicas, virales, fármacos, puentes coronarios, enfermedades autoinmunes y vasculitis, idiopática, entre otras (64).
Otros tipos de derrame pleural
Quilotórax se refiere a la presencia de linfa acumulada en el espacio pleural, generalmente, es lechoso y característicamente tiene unos triglicéridos mayores a 110 mg/dl, en contraste, valores menores a 50 mg/dl lo descarta. La malignidad (linfoma clásico) es la principal causa no traumática, mientras que la lesión quirúrgica inadvertida del conducto torácico es la causa principal traumática (65). Si los triglicéridos son menores a 110 mg/dl con un colesterol en el líquido pleural mayor a 200 mg/dl, se hace el diagnóstico de pseudoquilotórax, comúnmente visto en pacientes con tuberculosis de larga data o pleuresía reumatoide (66).
Finalmente, el hallazgo de amilasa en el líquido pleural mayor a los límites superiores de la normalidad para la sérica, reduce el diagnóstico diferencial de un derrame exudativo a las siguientes posibilidades: pancreatitis aguda, derrame pleural pancreático crónico, ruptura esofágica o malignidad (50). En la Figura 1 se resume el enfoque diagnóstico del derrame pleural.
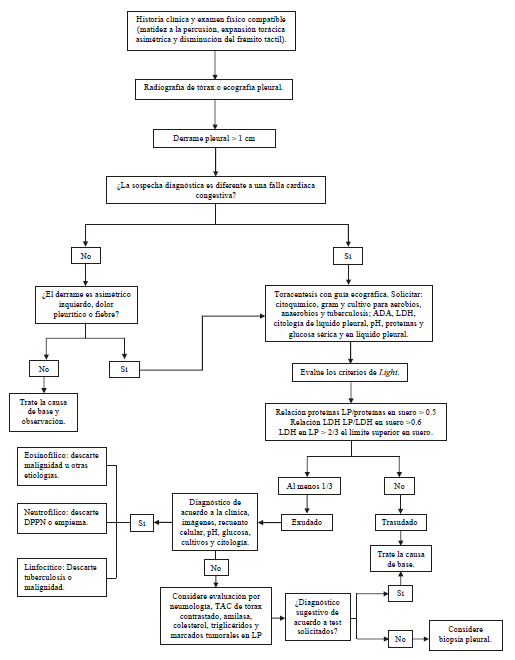
Figura 1 Enfoque diagnóstico del paciente con derrame pleural. LP: líquido pleural; LDH: lactato deshidrogenasa; TAC: tomografía axial computarizada; ADA: adenosina desaminasa; DPPN: derrame pleural paraneumónico. Fuente: adaptado de la referencia (9)
CONCLUSIONES
Los derrames pleurales son una entidad frecuente en la práctica clínica. Dependerá del clínico realizar un enfoque integral, donde se realice una historia clínica completa que incluya factores de riesgo, antecedentes personales, antecedentes farmacológicos, examen físico y ayudas diagnósticas para así tener un diagnóstico oportuno e impactar tempranamente en la salud de los pacientes.
Cada vez es más frecuente el uso de la ecografía al lado de la cama del paciente, que es un procedimiento seguro, fácil, no invasivo y barato que debe ser realizado por personal entrenado para evaluar los pacientes que se presentan con disnea y sospecha del derrame pleural, ya que tiene una mejor precisión diagnóstica para derrames pleurales complicados, además permite guiar el procedimiento de la toracentesis y así disminuir el riesgo de las complicaciones.
Todo paciente con derrame pleural del que no se tenga la causa clara, se debe estudiar. Los criterios de Light siguen siendo una herramienta en el enfoque, con una alta sensibilidad, pero con una especificidad menor, por tanto, otros elementos como el gradiente albumina y el colesterol pueden optimizar el diagnóstico de un exudado.
Si se sospecha de un derrame paraneumónico se debe realizar una aspiración diagnóstica de inmediato para identificar a los pacientes con un derrame complicado que requiere de drenaje por toracostomía o cirugía.
Hasta el 40 % de resultados de la citología en el líquido pleural son falsos negativos en los derrames malignos. En estos casos, la biopsia pleural parietal, guiada por imagen, es el método de diagnóstico de elección, sobre todo, si hay nódulos o engrosamiento pleural mayor a 1 cm.














