INTRODUCCIÓN
La Organización Mundial de la Salud ha declarado la resistencia a los antimicrobianos como un problema de salud pública. En mayo del 2015 este organismo aprobó un plan de acción mundial para contener la resistencia antibiótica, con la finalidad de poder seguir previniendo y tratando enfermedades infecciosas mediante el uso de fármacos eficaces y seguros (1). Lo anterior debido a que la morbilidad, mortalidad y carga económica derivada de las infecciones por gérmenes multidrogorresistente (MDR) son significativamente superiores, en comparación con las mismas infecciones ocasionadas por gérmenes sensibles (2,3).
Las consecuencias de la resistencia bacteriana se extienden a las infecciones del sitio operatorio, dado que el incremento en la frecuencia de colonización por gérmenes resistentes conlleva a una falta de cobertura profiláctica con los antimicrobianos comúnmente usados (4).
La resistencia antibiótica es un fenómeno natural derivado, inevitablemente, del uso terapéutico de los antimicrobianos. Esto explica por qué cada que se introducen nuevos antibióticos en la práctica clínica, situación cada vez menos frecuente, aparecen nuevas formas de resistencia, como la mediada por carbapenemasas. Esto reduce las opciones terapéuticas y la proporción de pacientes intratables o sometidos a medicamentos más tóxicos se incrementa (5). Prueba adicional de lo anterior, es la disminución en la frecuencia de gérmenes resistentes paralela a una disminución en el consumo de antibióticos (6). En con-secuencia, la velocidad de aparición y permanencia de bacterias resistentes está directamente relacionada con las prácticas de consumo de antibióticos en una población, las cuales van desde la automedicación por parte de los usuarios del sistema de salud hasta el uso de este tipo de medicamentos en la industria pecuaria, pasando por la prescripción inadecuada por parte del personal médico (7,8).
La prescripción inadecuada de este grupo de medicamentos hace referencia a la falta de optimización en su formulación, evidenciada por la prescripción del antibiótico no indicado, o indicado, pero no prescrito en una determinada enfermedad; antibiótico prescrito en dosis, frecuencia o duración incorrecta; falta de reducción del espectro una vez se dispone de resultados de cultivos y, finalmente, continuidad de la profilaxis antibiótica más allá de una cirugía.
Se estima que el 30 % de los antibióticos prescritos por médicos generales, en el escenario ambulatorio para infecciones respiratorias altas, no están indicados (9-11). Esta situación también se presenta en el entorno intrahospitalario. En las unidades de cuidados intensivos se ha reportado que hasta el 60 % de los antibióticos prescritos son innecesarios, inadecuados o están ordenados en dosis subóptimas (12).
Por lo anterior, los encargados de recetar antimicrobianos son un blanco lógico de intervención para mejorar la calidad de la prescripción y reducir el consumo inadecuado de antibióticos. Con este objetivo, se han propuesto varias intervenciones sobre los médicos: distribución de material didáctico impreso, reuniones educativas y retroalimentación del análisis de las falencias en el empleo de antimicrobianos (13).
El objetivo primario de este estudio fue describir el impacto de un sistema de auditoria y retroalimentación sobre los médicos generales en el consumo de antibióticos (medido en dosis diaria definida [DDD]) en una clínica de tercer nivel en la ciudad de Medellín. Los objetivos secundarios fueron medir la calidad de la prescripción antibiótica empírica, en términos de proporción de retroalimentaciones necesarias, revisar la frecuencia del diagnóstico de la sepsis, cuantificar el tiempo para el inicio de un antibiótico en el servicio de urgencias para los pacientes que fallecieron durante la hospitalización y describir la frecuencia de aislamientos de Escherichia coli productora de BLEE, durante el periodo del estudio.
MATERIALES Y MÉTODOS
Se realizó un estudio cuasiexperimental con pre y posintervención durante el año 2018, en la sede principal de una institución prestadora de salud de tercer nivel en la ciudad de Medellín. Esta institución cuenta con 130 camas de hospitalización y realiza, en promedio, 5.457 consultas al mes por el servicio de urgencias. Los médicos generales se desempeñan solos o como apoyo de las especialidades. Predomina la consulta urológica, ortopédica y de cirugía general.
La intervención inició en mayo y finalizó en diciembre de ese año.
De enero a mayo se verificó la existencia, actualización, disponibilidad y socialización de las guías y protocolos para el manejo de las enfermedades más frecuentes en la institución, así como una guía para la prescripción empírica de antimicrobianos adaptada a la flora microbiana institucional. Antes de la intervención se recordó a todos los médicos la disponibilidad y accesibilidad a estos documentos. Se incluyó en el estudio las prescripciones antibióticas empíricas de los médicos generales. Los antibióticos seleccionados para la auditoria fueron ceftriaxona, piperacilina tazobactam, cefepime, imipenem, meropenem y vancomicina.
Estos antibióticos fueron escogidos por su potencial para seleccionar gérmenes resistentes y por ser más costosos. Aunque la ciprofloxacina no fue seleccionada por ser un antibiótico mayormente de uso según el antibiograma, se realizó el seguimiento continuo ante el potencial riesgo de disparar su consumo. Salvo para cuantificar el tiempo de inicio de un antibiótico, se excluyeron las prescripciones ordenadas por especialistas y las basadas en resultados microbiológicos. También se descartaron las formulaciones antibióticas de los pacientes que ingresaron por el servicio de urgencias directamente a la unidad de cuidados intensivos y que no tenían nota en la historia clínica del médico general.
Las prescripciones y las correspondientes historias clínicas fueron revisadas tres veces por semana (lunes, miércoles y viernes). Cada caso era evaluado por un especialista en medicina interna, un epidemiólogo y, en casos de duda o desacuerdo, por un especialista en enfermedades infecciosas.
Los criterios para definir una falencia en las prescripciones fueron los siguientes:
Antibiótico fuera de la guía: el médico iniciaba el antibiótico por fuera de la guía institucional y no justificaba en la historia clínica por qué se salía de estas directrices.
Prolongación no justificada: se prolongaba la terapia antibiótica por encima del tiempo establecido en la guía institucional.
No coherencia: el antibiótico prescrito no guardaba coherencia con la impresión diagnóstica anota-da en la historia clínica.
Manejo incompleto: en la prescripción antibiótica faltaba el cubrimiento para gérmenes involucrados en la etiología de la condición según la impresión clínica.
Dosis antibiótica inadecuada: antibióticos subdosificados según el germen a cubrir.
No tomas microbiológicas: el antibiótico se iniciaba sin la previa toma de cultivos cuando estos tenían un rendimiento aceptable para la infección sospechada.
Luego de analizar el caso se informaba al médico prescriptor los resultados de la evaluación y la falencia detectada. Esta retroalimentación se hacía personalmente o a través de correo electrónico. En ningún momento las retroalimentaciones tuvieron un carácter punitivo. Se midieron la proporción de retroalimentaciones realizadas (retroalimentaciones/prescripciones antibióticas); la prevalencia, por métodos fenotípicos, de aislamientos de gérmenes E. coli (BLEE) y el consumo de antibióticos medido en dosis diaria definida (DDD), acorde con la normatividad nacional vigente (14). El laboratorio de microbiología y el área encargada de determinar el consumo de antibióticos no fueron informados de la realización de la intervención. Se determinó la frecuencia de diagnóstico de la sepsis por los médicos generales usando los criterios establecidos en la actualidad (15,16). Adicionalmente, se revisó el tiempo de inicio de cualquier tipo de antibacteriano dentro de las primeras 48 horas en el servicio de urgencias. Para esto se tomó la diferencia entre la hora de la atención en el triaje y la hora de la prescripción del antibiótico registradas en la historia clínica electrónica.
Las variables continuas fueron resumidas con base en la mediana y su rango intercuartílico. Para las variables cualitativas se determinaron las frecuencias absolutas y relativas. Se usó la prueba de tendencia Mann-Kendall para evaluar la tendencia del consumo de antibióticos y la proporción de retroalimentaciones a través del tiempo. Para la comparación de medianas se usó la prueba de Wilcoxon. Se trabajó con un nivel de significancia del 5 %. Para la construcción de la base de datos se usó el programa Excel y para las pruebas de hipótesis el software estadístico R, versión 3.5.1.
Este estudio fue evaluado y aprobado por el Comité técnico-científico institucional, que consideró la investigación como sin riesgo acorde con la resolución 8430 de 1993 del Ministerio de salud y de protección social. Durante el periodo del estudio no existieron cambios en las políticas de aislamiento de los pacientes, higiene de manos y limpieza o desinfección de superficies.
RESULTADOS
Durante el periodo de estudio, se registraron 10.172 prescripciones de los antibióticos seleccionados. De este número, el 30,67 % (3.120), 28,9 % (2.940), 13,72 % (1.396) y 10,2 % (1.038) fueron realizadas por internistas, médicos generales, cirujanos y pediatras, respectivamente. El resto de las formulaciones correspondieron a otras especialidades (16,5 %). La Tabla 1 muestra las proporciones según los antibióticos prescritos por medicina general. Los antibacterianos seleccionados para la auditoria, predominantemente ordenados, fueron piperacilina tazobactam, ceftriaxona y cefepime. Otros como meropenem, vancomicina e imipenem tuvieron una baja frecuencia de prescripción por este grupo de profesionales.
Tabla 1 Frecuencia de prescripción de médicos generales por antibiótico durante el 2018
| Antibiótico | Frecuencia | % |
|---|---|---|
| Piperacilina tazobactam | 1159 | 39,42 |
| Ceftriaxona* | 787 | 26,77 |
| Cefepime | 508 | 17,28 |
| Meropenem† | 251 | 8,54 |
| Vancomicina | 217 | 7,38 |
| Imipenem | 18 | 0,61 |
| Total | 2.940 | 100 |
*El 97 % de las prescripciones fueron para el manejo de infecciones de trasmisión y abuso sexual (dosis única). †Prescripciones correspondientes a pacientes con sospecha de infección por enterobacterias productoras de BLEE. Fuente: creación propia
Luego del inicio de la intervención en mayo, se evidenció una reducción importante en el consumo global de piperacilina tazobactam, ceftriaxona y cefepime, sin evidenciar un incremento del consumo de ciprofloxacina. No se registró una disminución significativa en la prescripción del resto de antibióticos a través de los meses (Figura 1).
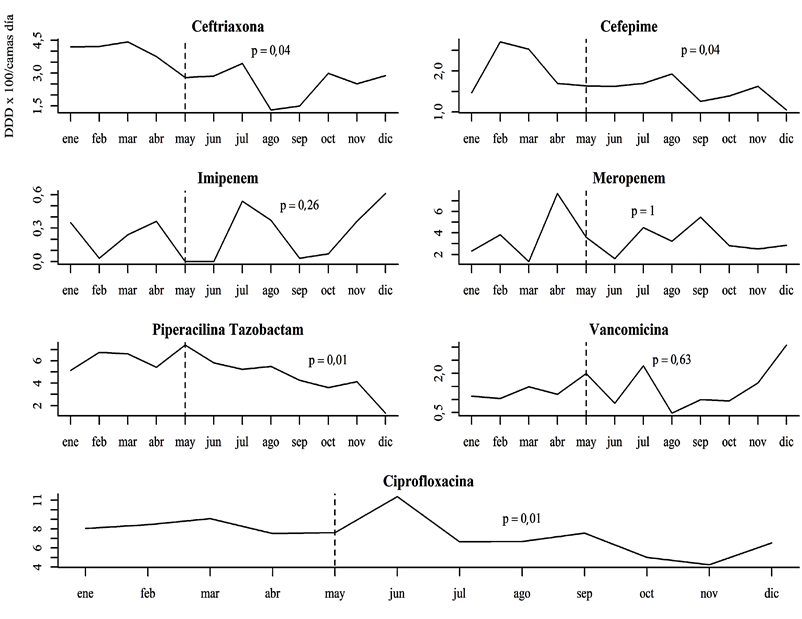
Figura 1 Consumo de antibióticos durante el 2018. Medición en dosis diaria definida (DDD). Fuente: creación propia
Paralela a la disminución en el consumo de estos antibióticos, se observó una reducción sostenida en la necesidad de retroalimentar a los médicos generales. La proporción de retroalimentaciones realizadas por mes descendió progresivamente y de manera significativa, desde un 10,9 %, al inicio de la intervención, hasta un 2 % al finalizar el periodo de estudio (Tabla 2). Los tipos de falencias predominantes fueron la prescripción de antibiótico por fuera de la guía (33 %) y dosis inadecuada (9 %).
Tabla 2 Proporción de las retroalimentaciones realizadas durante el 2018
| Mes | Frecuencia | (%)* |
|---|---|---|
| Enero | - | |
| Febrero | - | |
| Marzo | - | |
| Abril | - | |
| Mayo | 17/156 | 10,9 |
| Junio | 7/125 | 5,6 |
| Julio | 9/124 | 7,26 |
| Agosto | 5/121 | 4,1 |
| Septiembre | 9/86 | 10,4 |
| Octubre | 6/122 | 4,9 |
| Noviembre | 4/147 | 2,7 |
| Diciembre | 3/144 | 2 |
| Global | 60/1.025 | 5,85 |
*p = 0,03. Fuente: creación propia
Durante el 2018 fallecieron 147 pacientes en la institución. El 60,5 % (89) cumplían con los criterios establecidos para sepsis. Todos estos enfermos recibieron antibióticos al ingreso al servicio de urgencias. La frecuencia de este diagnóstico no cambió luego del inicio de la intervención (Tabla 3).
Tabla 3 Prevalencia de la sepsis entre los pacientes fallecidos durante el 2018
| Mes | Frecuencia | (%)* |
|---|---|---|
| Enero | 3/10 | 30 |
| Febrero | 4/6 | 66,6 |
| Marzo | 5/6 | 83,3 |
| Abril | 9/14 | 64,2 |
| Mayo | 7/12 | 58,3 |
| Junio | 8/11 | 72,7 |
| Julio | 7/14 | 50 |
| Agosto | 10/15 | 66,6 |
| Septiembre | 14/19 | 73,6 |
| Octubre | 3/5 | 50 |
| Noviembre | 7/17 | 41,1 |
| Diciembre | 12/18 | 66,6 |
| Global | 89/147 | 60,5 |
* p = 0,9. Fuente: creación propia
Las medianas del tiempo, en minutos, entre el ingreso del paciente al servicio de urgencias y el inicio de cualquier antibiótico antes y después de la intervención fueron respectivamente: 341,5, IQR [562,5] y 172, IQR [321], p = 0.31.
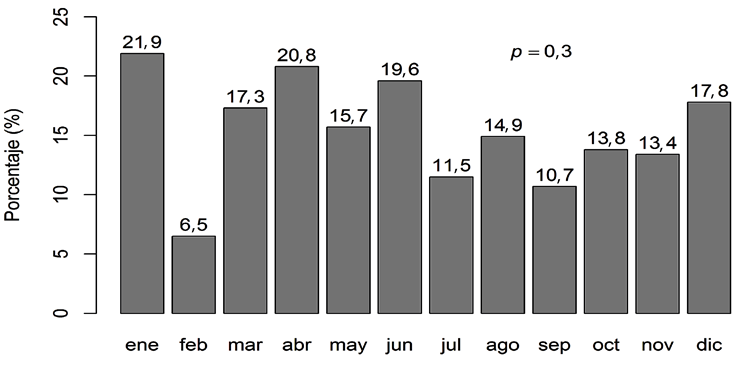
Finalmente, se encontró una tendencia a la disminución de la prevalencia de E. coli productora de BLEE durante el periodo de estudio: pasando del 21,9 en ene-ro al 17,8 % en diciembre, aunque sin alcanzar una diferencia estadísticamente significativa (p = 0,3) (Figura 2).
DISCUSIÓN
El diseño y la disponibilidad de las guías de práctica clínica no es suficiente para impactar en el uso adecuado y consumo de antibióticos porque, globalmente, la adherencia a estos documentos es baja (17-19). Esta situación cambia cuando, adicionalmente, se desarrolla una estrategia constante de seguimiento y retroalimentación a los médicos, relacionada con la calidad de la prescripción antimicrobiana.
En este estudio se realizó una intervención personalizada y sin carácter punitivo a los médicos generales, lográndose reducir el consumo de antibióticos a través del tiempo, sin ocasionar un retraso en el inicio de los antimicrobianos en los pacientes con sepsis; en los cuales el inicio tardío del tratamiento incrementa la mortalidad (20). Por el contrario, se nota una reducción y mayor homogeneidad en el tiempo de inicio del antibiótico en el periodo posterior a la intervención, aunque sin alcanzar una diferencia estadísticamente significativa. A pesar de evidenciar un incremento en el consumo de imipenem, vancomicina y meropenem (Figura 1), especialmente al final del periodo de intervención, es poco probable que los médicos generales hayan sido los responsables, ya que la frecuencia de prescripción de estos antibióticos por estos profesionales fue muy baja (Tabla 1).
Para este estudio se seleccionó a los médicos generales, porque en muchos casos son los encargados del abordaje inicial del paciente en el servicio de urgencias (en concordancia con la normatividad nacional) (21), son quienes, frecuentemente, prescriben los primeros antibióticos empíricos en las instituciones de salud.
Los resultados de esta intervención evidencian que hay una cantidad importante de antibióticos ordenados no indicados y que esta estrategia de educación, no punitiva, mejora la calidad de la prescripción. Por ello, debe ser contemplada junto a otras acciones para promover el uso racional de los antimicrobianos (22). Estrategias agrupadas dentro de los programas de optimización de uso intrahospitalario de antimicrobianos (PROA). La implementación de estos programas ha demostrado, además de la reducción en el consumo de los antibióticos, la disminución de los costos de la atención sanitaria, estancia hospitalaria, prevalencia de gérmenes MDR y, probablemente, el descenso de la mortalidad sin producir un incremento en los desenlaces adversos. Estos beneficios parecen ser mayores en las unidades de cuidados intensivos (23-24).
El exceso de antibióticos prescritos no indicados posiblemente está relacionado con varios factores: percepción errónea de una mayor calidad de la atención si se prescribe un antibiótico de amplio espectro, falta de conciencia en cuanto a la generación de resistencia bacteriana, presión ante la demanda de antibióticos del paciente, familiares, colegas, etc. Una encuesta realizada a médicos colombianos (31 % facultativos generales) reveló que el 25 % de los entrevistados pensaban que prescribir un antibiótico de amplio espectro era mejor. Adicionalmente, entre el 29,2 y el 67,42 % tenían conocimientos equivocados en lo relacionado con la prescripción antibiótica (25). En otra encuesta, solo un 22 % de los profesionales percibía la resistencia antimicrobiana como un problema en su práctica diaria, a pesar de que el 70 % reconocía que este era un problema mundial (26).
El impacto en la reducción del consumo de antibióticos fue mayor para la ceftriaxona, la piperacilina tazobactam y el cefepime, ya que fueron los antimicrobianos predominantemente prescritos. Es llamativo que la disminución fue sostenida para la ciprofloxacina (antibiótico no incluido en las prescripciones para retroalimentar), el cual tiene un espectro similar al de la piperacilina tazobactam y cefepime. Esto indica que la reducción de los antibacterianos fue global después de la intervención y no un cambio en las prescripciones de un grupo a otro. De particular importancia es el seguimiento en el consumo de las quinolonas, dado el impacto que tienen en la selección de gérmenes resistentes gram negativos y gram positivos (27-28).
La optimización en el uso de antimicrobianos, al disminuir la presión selectiva, ocasiona una reducción en la prevalencia de gérmenes multirresistentes y, con esto, un ahorro en los costos de atención en salud (29-30). En el caso de la ceftriaxona, una reducción en su consumo no indicado puede bajar la prevalencia de enterobacterias productoras de BLEE, porque el uso de cefalosporinas de tercera generación es uno de los factores de riesgo más fuertemente asociados con este tipo de resistencia y este es uno de los antibióticos para restringir durante los brotes de infecciones por este tipo de bacterias (31-32). Durante esta intervención se evidenció una tendencia a la reducción en la prevalencia de E. coli productora de BLEE. Es posible que la magnitud de la baja en el consumo de ceftriaxona (13 %) o el tiempo de seguimiento, no hayan sido suficiente para alcanzar una diferencia esta-dísticamente significativa.
Este estudio tuvo varias limitaciones. En primer lugar, no se midieron las consecuencias de esta intervención sobre otros antibióticos considerados de menor espectro: penicilina cristalina, ampicilina sulbactam, cefazolina, metronidazol, etc. La intervención se concentró solo en los antibióticos de mayor espectro, porque estos tienen un mayor potencial para la selección de organismos MDR. En segundo lugar, no se determinó el impacto de la intervención en la población pediátrica, al no poder aplicar en esta población el indicador de la OMS (DDD) (33). Aunque es posible que también haya tenido un efecto favorable, ya que desde el principio las guías de la práctica clínica pediátricas fueron revisadas y actualizadas para su aplicación por los mismos médicos generales, objeto del seguimiento. Tercero, al ser un estudio cuasiexperimental no se puede separar el papel de la retroalimentación sola, del de las guías práctica clínica institucionales. Sin embargo, consideramos que esto no es necesario, debido a que las guías son el soporte que orienta la calidad de la prescripción y son el paso previo antes de la ejecución de cualquier sistema de pedagogía.
En conclusión, en este trabajo se encontró que la implementación de guías institucionales junto a una retroalimentación continua y de carácter no punitivo a los médicos generales, en lo referente a la calidad de la prescripción antibiótica, reduce el consumo institucional de antibacterianos a expensas de los medicamentos no indicados, sin ocasionar un retraso en el inicio del tratamiento en los pacientes con sepsis y puede impactar favorablemente en el perfil de resistencia de la flora microbiana institucional.