INTRODUCCIÓN
La toxoplasmosis es la infección producida por el Toxoplasma gondii, un protozoario de vida intracelular obligada. Los gatos y otros felinos son los huéspedes definitivos y el hombre es uno de los posibles hospederos intermediarios. Pertenece al supergrupo Chromalveolata, primer rango Alveolata y, segundo grado Apicomplexa. Posee características morfológicas únicas como el apicoplasto. Este parece ser esencial para su supervivencia (1).
La toxoplasmosis es una infección de alta prevalencia en el territorio colombiano, con tasas en la población general entre el 44 y 61 %, según estudios realizados en los últimos años en diversos departamentos del país (2). Una de las consecuencias de mayor impacto es la forma congénita, la cual representa un problema importante para la salud pública nacional, pues cada año aparecen de 2 a 10 casos por cada 1.000 recién nacidos (3,4). Se estima que entre el 0,7 y el 2 % del total de las mujeres gestantes adquieren toxoplasmosis con el riesgo de la transmisión al feto (5). En el primer estudio multicéntrico, realizado en diferentes hospitales y centros asistenciales de 5 ciudades del territorio nacional, se encontró que la letalidad en los niños que no recibieron el trata-miento durante el embarazo fue del 25 % (6).
Existe variabilidad en la presentación clínica en los recién nacidos, que puede generar alteraciones neurológicas como hidrocefalia, microcefalia, calcificaciones y retardo en el desarrollo psicomotor; oculares como microftalmia, coriorretinitis, estrabismo, neuritis óptica, cataratas, necrosis de retina y ceguera; hematológicas como anemia, trombocitopenia; viscerales como hepatoesplenomegalia e ictericia, entre otras (7). Sin embargo, el 75 % de los niños pueden ser asintomáticos al nacer (8). Entre los esquemas de tratamiento actuales para la toxoplasmosis congénita se incluyen la espiramicina para prevenir la transmisión maternofetal, junto con la pirimetamina/sulfadoxina y el ácido folínico para tratar al feto infectado (9).
El seguimiento es importante para garantizar la adecuada adherencia y efectividad del tratamiento en el recién nacido. Los anticuerpos IgG específicos para el Toxoplasma corresponden al método de seguimiento de elección en el recién nacido, esto se basa en la hipótesis de que los niveles de IgG se correlacionan con la reactivación del parásito. En efecto, se han observado bajos niveles séricos de este anticuerpo durante el tratamiento y un aumento de los mismos al descontinuarlo, lo cual se ha denominado rebote inmunológico (10). Sin embargo, existen limitaciones para la IgG como método de seguimiento, pues otros mecanismos podrían estar involucrados con el aumento de las concentraciones de este anticuerpo, diferentes a la reactivación, tales como las infecciones concomitantes (10).
Debido a esto, surge la necesidad de encontrar otros métodos para el seguimiento de la evolución de la enfermedad. Una alternativa es medir la avidez funcional del antígeno y el anticuerpo que se utiliza, en general, para estimar el tiempo de adquisición del patógeno (11). La prueba de anticuerpos IgG de avidez se basa en la distinta fuerza o afinidad que existe en la unión antígeno-anticuerpo. La técnica que mide la avidez de IgG anti-Toxoplasma permite diferenciar una enfermedad aguda o primaria de una crónica (12). En los primeros meses de la infección el hospedero responde con la producción de anticuerpos de la clase IgG de baja afinidad, la cual aumenta a medida que transcurre el tiempo. (13). Se observa que esta prueba se afecta por el tratamiento cuando se mide en las pacientes embarazadas (14). En recién nacidos solo se ha hecho un estudio en Europa, y no se cono-ce cómo se comporta en Suramérica, donde existen cepas diferentes y el daño es mayor (15,16). El objetivo de este estudio fue determinar la utilidad de la avidez en el seguimiento de los pacientes diagnosticados con toxoplasmosis congénita, basándonos en datos obtenidos y registrados en la historia clínica sobre su comportamiento en el tiempo y su correlación con variables clínicas y terapéuticas.
METODOLOGÍA
Diseño del estudio
Se hizo un análisis retrospectivo de datos a partir de historias clínicas de niños que tuvieron una confirmación diagnóstica y el tratamiento para toxoplasmosis congénita.
Sitio y periodo del estudio
El sitio lo constituyó la consulta de toxoplasmosis del centro de salud de la Universidad del Quindío, en Armenia (Quindío). Se analizaron historias clínicas de pacientes atendidos durante un periodo de 16 años: del 30 de octubre del 2002 hasta el 21 del mismo mes del 2018.
Población
Analizamos los datos de un grupo de 168 pacientes con diagnóstico de toxoplasmosis congénita. Los casos se consideraron como confirmados por la aparición de una prueba IgM anti-Toxoplasma por ELISA o IgA específica positiva por ELISA en la muestra de sangre del niño, tomada luego del décimo día de vida o por la persistencia de IgG anti-Toxoplasma luego de cumplir 1 año, de acuerdo con los criterios de la red europea de toxoplasmosis congénita (17).
Métodos de recolección de la información y variables analizadas
Los datos se recolectaron de las historias clínicas de los pacientes con diagnóstico de toxoplasmosis congénita del centro de salud de la Universidad del Quindío. Se tomaron datos epidemiológicos (edad, procedencia), clínicos (antecedentes prenatales, signos, síntomas, datos antropométricos y resultados de oftalmoscopia) y de tratamiento (si recibió o no el tratamiento prenatal: fármacos y sus respectivas dosis del tratamiento). Se tuvo en cuenta la fecha de inicio y de suspensión del tratamiento posnatal y los resultados de laboratorio (niveles de IgG, IgM, IgG de avidez y hemograma). Todos los datos se digitaron en una hoja electrónica de Excel para su análisis. Los criterios de inclusión de los casos fueron: tener diagnóstico confirmado, haber recibido tratamiento después de nacer y tener, al menos, tres mediciones de avidez e IgG anti-Toxoplasma en el tiempo.
Análisis estadístico
Se hizo un análisis descriptivo de los datos de la población estudiada. Para ello, primero se hizo un estudio general reuniendo todos los datos de la población estudiada y se calculó la mediana y el rango para la avidez en cada mes del primer año de vida. Además, se hizo un análisis de correlación aplicando la prueba de Spearman para establecer si existía una asociación entre los meses de vida y el porcentaje de avidez, y este último y los niveles de IgG anti-Toxoplasma, para el conjunto de los datos.
Posteriormente se analizaron las curvas de evolución de los porcentajes de avidez de cada paciente, buscando una correlación con el tiempo, es decir a medida que pasaban los meses de vida y con los niveles de IgG anti-Toxoplasma, buscando con estos últimos si existía una correlación negativa o positiva entre ambas pruebas. Finalmente, se examinó si las correlaciones tenían significado estadístico aplicando la prueba de Pearson.
Todos los datos fueron analizados con el programa Epi Info, versión 7.0 (CDC, Atlanta, USA).
RESULTADOS
Características de la población estudiada
Luego de revisar 168 historias de niños vistos en la consulta de parasitología de la Universidad del Quindío, se encontraron 39 pacientes a los que se realizó alguna prueba de avidez luego del nacimiento. Entre ellos, 22 la tuvieron en el primer mes y 21 en el seguimiento posnatal, con al menos tres pruebas en el primer año de vida.
Esquema del tratamiento
El esquema del tratamiento utilizado fue la combinación fija pirimetamina/sulfadoxina (única combinación de estos medicamentos disponible en Colombia) calculando la dosificación en función de la pirimetamina con una carga de 2 mg/kg, seguida de una dosis semanal de 1 mg/kg. En algunos casos, se pudo prescribir la preparación magistral de suspensión de pirimetamina a 1 mg/kg una vez al día, acompañada con sulfadiazina 25 mg/kg dos veces al día por vía oral. En todos los casos se prescribió ácido folínico de 7,5 mg de manera interdiaria hasta el año 2010, de ahí en adelante diariamente.
Correlación entre la avidez en el primer mes con el tratamiento prenatal
Cuando se analizaron los datos de avidez en el primer mes de vida de los niños con el tratamiento prenatal (Tabla 1) la media fue de 36 %, mientras que en aquellos que no tuvieron tratamiento fue de 41 %, una diferencia que no fue estadísticamente significativa (p = 0,479). Tampoco influyeron el trimestre en el que se infectó el niño (p = 0,56) o si el tratamiento duró más de tres meses (p = 0,51) en el porcentaje de avidez del niño en el primer mes.
Tabla 1 Media y rango del porcentaje de avidez en el primer mes de vida en los niños con toxoplasmosis congénita que tuvieron o no tratamiento prenatal
| Tratamiento prenatal | Media del porcentaje de avidez durante el primer mes de vida | Máximo | Mínimo |
|---|---|---|---|
| No (n = 6) | 41 | 27 | 83 |
| Sí (n = 16) | 36 | 10 | 80 |
| Total (n = 22) | 37 | 10 | 83 |
Fuente: creación propia
Correlación entre las pruebas de avidez y el tratamiento posnatal
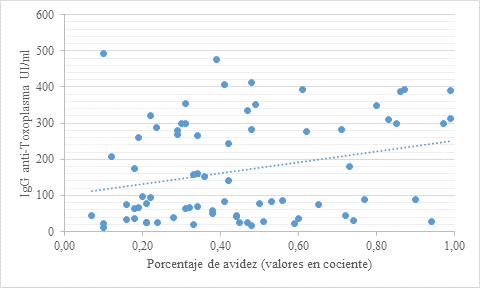
Todos los niños incluidos recibieron tratamiento posnatal sin interrupción. Al calcular el r2 entre los meses de vida y el porcentaje de avidez, el resultado fue de 0,3 (Figura 1). Adicionalmente, el r2 calculado entre este último y los niveles de IgG durante el seguimiento fue de 0,26 (Figura 2). Por tal motivo, ambos valores representan una asociación de baja fuerza. Con lo anterior, se puede interpretar que menos del 30% de los porcentajes de avidez se correlacionan con los meses de vida o los valores de IgG anti-Toxoplasma.
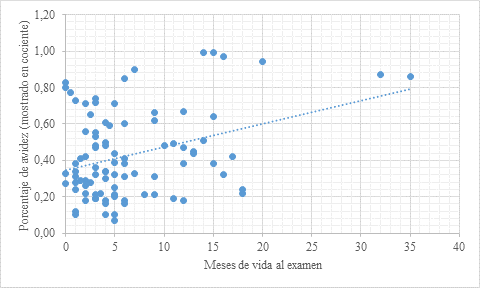
Figura 1 Diagrama de dispersión para mostrar la correlación entre el porcentaje de avidez y el mes de vida en 20 niños con toxoplasmosis congénita. Se muestran 92 valores tomados durante diferentes meses del seguimiento. Fuente: creación propia
Correlación entre las pruebas de avidez y los meses de vida
Al evaluar la tendencia de las curvas entre el porcentaje de avidez y la edad en meses de manera individual, se observó que el 40 % de los pacientes presentan una tendencia positiva y el 60 % una negativa. Estos resultados corresponden a un comportamiento de amplia variabilidad individual, que no permite definir una tendencia general. Al realizar los cálculos se encontró que son variables que no están asociadas y presentan un comportamiento independiente, por lo que se infiere que no hay una influencia de una sobre la otra.
Correlación entre los niveles de IgG anti-Toxoplasma y los meses de vida
En cuanto a la IgG anti-Toxoplasma, se observa que el 73 % de las curvas tiene una tendencia negativa con respecto a la edad en meses. En seis pacientes hubo un r2 mayor de 0,75 de reducción en los niveles de IgG a medida que aumentaban los meses de vida. Solo hubo dos pacientes en los cuales existió una correlación entre la avidez y la IgG, pero uno era un caso de seguimiento hasta el mes 32 en el que la asociación fue hacia arriba y otro solo hasta el mes 5 que fue hacia abajo, por lo que no son comparables.
Tres de los siete casos tuvieron un rebote inmunológico, el cual consiste en la elevación de IgG luego de un descenso progresivo. Uno de los casos presentó una reducción en la avidez en el sexto mes, relacionado con los bajos niveles de medicamento en la sangre; otro en el mismo mes sin causa conocida; otro en el quinto mes, relacionado con diarrea que requirió hospitalización y un último en el mes 18, que coincidió con la suspensión del tratamiento luego de completar el año bajo un régimen antiparasitario.
Correlación entre la avidez y la edad
Al revisar las curvas realizadas se observó que luego de los 4 meses de vida, existía una tendencia a un comportamiento de correlación entre la avidez y los niveles de IgG (aumento de avidez y aumento en los niveles de IgG anti-Toxoplasma). Por tal motivo, se decidió evaluar por separado la significancia estadística entre estas dos variables: un grupo con valores del primer al cuarto mes y otro con los del quinto en adelante. Esto se hizo con la finalidad de identificar si la edad en meses influía en la aplicabilidad de la avidez como prueba de seguimiento. Cuando se evaluó el grupo de los prime-ros cuatro meses de vida no hubo correlación entre los niveles de IgG y la avidez (p = 0,208). En contraste, se encontró que a partir del quinto mes en adelante hubo una correlación estadísticamente significativa entre el aumento de los niveles de IgG anti-Toxoplasma y un mayor porcentaje de avidez (p = 0,01).
DISCUSIÓN
En el presente estudio, los valores de avidez recolectados no se correlacionaron con la respuesta clínica o los niveles de anticuerpos IgG. Esto contrasta con el descenso de los niveles de IgG medidos en UI/ml, los cuales se asocian con el tratamiento eficaz, tal como se ha reportado en la literatura (10). Adicionalmente, se observa, al revisar cada caso de manera aislada, variaciones individuales importantes. Por lo tanto, los resultados del análisis en la presente serie de casos no lograron aportar evidencia de la utilidad de la avidez para el seguimiento de los pacientes diagnosticados con toxoplasmosis congénita. Estos resultados son similares a los encontrados por el grupo de la doctora Buffolano en Italia y publicados en el año 2004 (15). Este estudio demostró que no existían diferencias entre los niveles de avidez de los anticuerpos de tipo IgG con respecto al tratamiento prenatal, severidad del cuadro clínico, edad o tratamiento posnatal (15). Sin embargo, al analizar los datos del presente estudio y el comportamiento de estos en el tiempo se advierte un comportamiento que es diferente a partir del quinto mes en el cual se encuentra una correlación estadísticamente significativa entre la IgG y la avidez. Este hallazgo sugiere que la prueba podría ser útil en el seguimiento de los niños a partir de esta edad, probablemente explicado por la disminución de los anticuerpos maternos en el niño. Estos inician su descenso y se negativizan totalmente en los casos de niños no infectados al sexto mes, en general, aunque en algunos casos pueden permanecer hasta el décimo mes de vida. Por lo anterior, un criterio de infección congénita es que la IgG anti-Toxoplasma permanezca detectable luego del mes 10 de vida, según los criterios del grupo de trabajo europeo en toxoplasmosis congénita (17).
La presencia simultánea de anticuerpos maternos y aquellos creados por el producto de la gestación, explica la dificultad del uso de esta prueba para el diagnóstico de toxoplasmosis congénita (18). Por esta misma razón, la correlación entre dicho porcentaje y los niveles altos de IgG después del quinto mes, refleja el comportamiento de la inmunoglobulina G ya formada, lo que corresponden a los anticuerpos de una respuesta de memoria inmunológica.
Es interesante mencionar el comportamiento de cuatro casos de nuestro estudio, tres que se encontraban en el rango de edad de 5 y 6 meses y uno en el mes 18. Se observa en ellos anticuerpos de baja avidez, lo que revela la presencia de neoanticuerpos en estos niños. Por tanto, esto podría indicar que, en algunos casos muy específicos, la respuesta de memoria inmunológica no genera anticuerpos con alto porcentaje de avidez. La asociación significativa entre mayor IgG y mayor avidez con los meses de vida se explica, principalmente, porque estos incluyeron los casos que tuvieron mayor seguimiento. Es bien conocido que posterior a suspender el tratamiento los niveles de IgG se elevan de manera significativa, y estos anticuerpos corresponden a los de memoria inmunológica, que se espera tengan una mayor avidez (10).
Por lo tanto, es importante recalcar que, si bien no se ha logrado encontrar evidencia significativa que soporte la avidez como prueba de seguimiento alternativa a la IgG, sería interesante definir en futuros estudios lo que ocurre con esta en el seguimiento de niños mayores de 4 meses, correlacionando con variables clínicas como la aparición de lesiones de retinocoroiditis nuevas (10).
Una limitación del presente estudio es que al ser observacional y retrospectivo basado en datos de historias clínicas, el número de muestras por caso fue variable, así como el tiempo de seguimiento, lo cual puede explicar la dificultad para encontrar una relación entre el porcentaje de avidez y las variables clínicas. Se observa que, en general, la avidez tiene el comportamiento esperado; es decir, aumenta en el tiempo especialmente después del quinto mes. En algunos casos de rebote inmunológico temprano se evidencia la formación de anticuerpos de baja avidez. Esta observación no fue constante para todos los casos, lo que no permite darle valor a la misma. La fortaleza de este estudio radica en que es una descripción de casos (algunos por largo tiempo) sobre las variaciones en los porcentajes de avidez que evidencia su poca utilidad para el seguimiento de los pacientes. En base a estos resultados, no recomendamos utilizarla en la práctica rutinaria para el seguimiento de niños con toxoplasmosis congénita.