INTRODUCCIÓN
La amiloidosis cardíaca es una causa infrecuente de falla cardíaca y está asociada con pobre pronóstico. Tiene manifestaciones clínicas y electrocardiográficas variables, incluyendo un bajo voltaje con alternancia eléctrica y patrón QS en la cara anterior. El ecocardiograma transtorácico (ECOTT) y la resonancia magnética (RM) cardíaca son herramientas útiles para su enfoque diagnóstico. Se presentan 3 casos clínicos con distintas manifestaciones y desenlace.
CASOS
Caso 1
Hombre con 62 años, sin antecedentes, quien consulta por disnea progresiva, edema periférico de predominio vespertino y episodios sincopales. En el examen físico presentaba macroglosia y edemas en miembros inferiores grado III, con fóvea. Laboratorio con creatinina 1,55 mg/dl, BUN 32,3 mg/dl, sin proteinuria en el uroanálisis, hemograma sin alteraciones. Ecografía renal y de vías urinarias con riñones de tamaño y apariencia normal. Electrocardiograma (EKG): Figura 1.
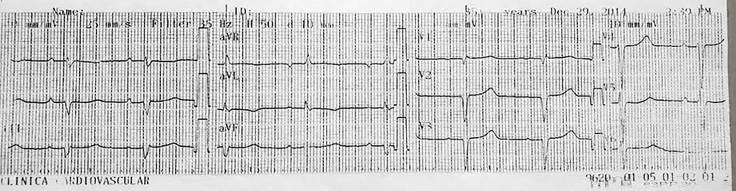
Figura 1 Bradicardia sinusal (FC 54 lpm). Eje del QRS desviado a la izquierda y trastornos inespecíficos de la repolarización, con latidos ventriculares prematuros ocasionales y bajo voltaje en derivadas de extremidades (aVR, aVL y aVF), predominantemente. Fuente: Archivo institucional, Clínica CardioVID. Medellín, Colombia. (publicada con debida autorización)
Holter: aumento del automatismo ventricular multifocal.
Ecocardiograma: miocardiopatía hipertrófica simétrica sin obstrucción intracavitaria, disminución leve de la motilidad global de VI, fracción de eyección del ventrículo izquierdo (FEVI): 50 %, derrame pericárdico leve. Ventrículo derecho: tamaño normal, función sistólica disminuida (TAPSE: 12 mm).
La asociación de hipertrofia ventricular simétrica, derrame pericárdico y compromiso de la función renal con los riñones de tamaño normal orientaron a una patología infiltrativa. Estudios posteriores con inmunofijación positiva en suero y orina documentaron el componente monoclonal de cadenas ligeras tipo lambda.
La resonancia cardíaca reportó el engrosamiento de la pared biauricular (principalmente septum interatrial), realce tardío difuso en todas las cámaras, derrame pericárdico severo, sin repercusión hemodinámica. Se confirmó la amiloidosis AL (AAL) con compromiso cardíaco y renal. Se inició esquema Cy-BorD (ciclosporina, bortezomib y dexametasona) por el riesgo intermedio alto, con requerimiento posterior de la terapia de reemplazo renal.
Caso 2
Mujer con 64 años, monorrena izquierda congénita, con cuadro de 3 meses de episodios presincopales. Estudios ambulatorios con holter que mostraba salvas de taquicardia ventricular (TV) monomórfica de menos de 3 segundos y bloqueo auriculoventricular (AV) de primer grado (PR 235 mseg). Ecocardiograma con hipertrofia ventricular izquierda, FEVI 35 %, patrón restrictivo de flujo transmitral. Perfusión miocárdica sin isquemia y coronariografía sin lesiones en las arterias epicárdicas. Se sospechó posible cardiopatía restrictiva o infiltrativa, por lo que se solicitó resonancia cardíaca.
Consultó a la institución por síncope. En el examen físico presentaba equimosis periorbitaria bilateral, hepatomegalia y edemas en miembros inferiores grado II, con fóvea. EKG del ingreso (Figura 2).
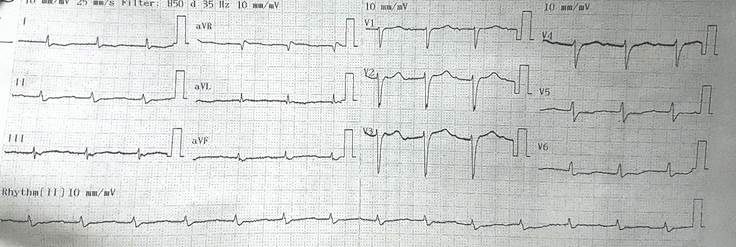
Figura 2 Bloqueo AV de primer grado. Imagen de pseudoinfarto anterior y bajo voltaje en las extremidades. Fuente: Archivo institucional, Clínica CardioVID. Medellín, Colombia. (publicada con debida autorización)
Laboratorio con creatinina 1,6 mg/dl, Hb 10 g/dL, uroanálisis con microhematuria y proteinuria subnefrótica en 24 horas (1,4 g/día). Resonancia cardíaca: engrosamiento de paredes de VI, FEVI 45 %, zonas de realce tardío heterogéneo. Durante monitoreo Holter, nuevo síncope asociado con el bloqueo AV de segundo grado Mobitz II, requiriendo de un implante de marcapasos bicameral.
Biopsia de grasa abdominal negativa. Electroforesis de proteínas: pico monoclonal gamma. Inmunofijación en suero y orina: componente monoclonal IgG lambda. Biopsia endomiocárdica: depósito extracelular de fibrillas anormales insolubles compuestas por diferentes subunidades de bajo peso molecular (entre 5 y 25 kda), compatible con AAL.
Posteriormente, con bajo gasto, requiriendo de soporte inotrópico y vasopresor; presentó episodio de fibrilación ventricular que fue revertido, pero con persistencia de inestabilidad hemodinámica y posterior deceso.
Caso 3
Hombre con 68 años, sin antecedentes, con cuadro de 6 meses de disnea de esfuerzos, edema progresivo, ortopnea y disnea paroxística nocturna. Al ingreso presentó signos de falla cardíaca aguda con sobrecarga central y periférica, hepatomegalia dolorosa y edema grado III de miembros inferiores, con fóvea. EKG: Figura 3.
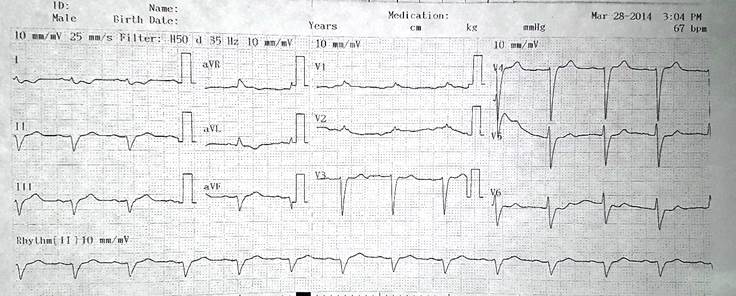
Figura 3 Bloqueo de rama derecha. Hemibloqueo del fascículo anterosuperior y bajo voltaje en las derivaciones de las extremidades. Funete: Archivo institucional, Clínica CardioVID. Medellín, Colombia. (publicada con debida autorización)
Ecocardiograma: hipertrofia concéntrica severa, hiperrefringencia de paredes ventriculares, FEVI 25 %, dilatación de aurícula izquierda. Ventrículo derecho de tamaño normal con función sistólica disminuida (TAPSE: 10 mm).
Laboratorio con creatinina 1,3 mg/dl, BUN 56 mg/dl, proteinuria ocasional: 300 mg/dl; proteínas 840 mg/24 horas. Ante un paciente con falla cardíaca de novo, hipertrofia ventricular e hiperrefringencia de pared miocárdica, asociada a proteinuria subnefrótica, se consideró patología infiltrativa.
La electroforesis de proteínas fue normal, con proteína de Bence-Jones negativa. La inmunofijación en suero y orina reportó cadenas ligeras monoclonales lambda. Biopsia de grasa periumbilical negativa para tejido amiloide.
Resonancia cardíaca: miocardiopatía dilatada de origen no isquémico, hipertrofia concéntrica biventricular, dilatación de todas las cavidades. Alteración en la intensidad de la señal del miocardio biventricular en las series de realce tardío. FEVI 32 %.
El paciente tuvo evolución clínica tórpida, resistencia a diuréticos y posterior choque cardiogénico, falleciendo al corto plazo.
DISCUSIÓN
El término amiloidosis fue acuñado en el 1838 por Mathias Schleiden para describir un constituyente natural de las plantas (1). Fue retomado por Rudolf Virchow en el 1854 para describir los depósitos extracelulares de tejido que, al teñirse con yodo, semejaban en apariencia a la celulosa; “amiloide”, que significa almidón (del latín Amylum), se adaptó dada esta particularidad descrita por el autor en mención. Son enfermedades causadas por cambios conformacionales y la suma de proteínas autólogas que se depositan como fibrillas en los tejidos.
Existen 27 proteínas precursoras de amiloide, entre ellas está la cadena liviana de inmunoglobulina y transtiretina, responsables de la amiloidosis AL (AAL) y senil (ATTR), respectivamente, con mayor compromiso cardíaco. AAL es la forma más común y grave de la amiloidosis en EE. UU., con incidencia de 2.000 a 2.500 casos por año (2). Afecta predominantemente a pacientes entre los 50-80 años, sin diferencias entre ambos sexos (3).
Las fibrillas amiloides son fragmentos de cadenas ligeras de inmunoglobulinas (kappa o lambda), producto de un plegamiento proteico anormal dado por los defectos genéticos clonales de las células plasmáticas de la médula ósea (5-10 % de población). La relación kappa: lambda menor a 0,26 sugiere la presencia de una población clonal de células plasmáticas productora de cadenas lambda (mayor a 1,65 indica una producción clonal de cadenas kappa en el 70 % de los casos) (3,4). Sin tratamiento, el promedio de supervivencia global es de 13 meses. La amiloidosis se asocia con el mieloma múltiple en el 10-15 %, asociándose a un peor pronóstico (5); este diagnóstico no estuvo presente en ninguno de los 3 casos presentados.
El compromiso cardíaco se presenta hasta en la mitad de los casos y es más común en AAL (3/3 casos presentados), en la cual el alto grado de infiltración tisular ocurre en más del 50% (agregados nodulares con ramificaciones que envuelven y aíslan los miocitos), y el compromiso microvascular no epicárdico en el 90 % (6,7). Esto causa isquemia y fibrosis miocárdica, rigidez de las paredes ventriculares y disfunción diastólica ventricular.
Las manifestaciones clínicas son inespecíficas. Usualmente el paciente consulta de forma tardía por síntomas de falla cardíaca y edema refractario a diurético; el síncope indica mal pronóstico, sugiriendo miocardiopatía restrictiva grave (2/3 de nuestros casos). La macroglosia y púrpura periorbitaria son manifestaciones poco sensibles (10-20 %), pero orientadoras, como ocurrió en los casos 1 y 2 descritos (8,9).
Los hallazgos electrocardiográficos más frecuentes son el bajo voltaje (46 %), el patrón de pseudoinfarto (QS) en la cara anterior (47 %), bloqueos sinoatriales (30 %), AV avanzados (3 %) y BRDHH (9 %); (10) algunos aparecen descritos en los 3 casos reportados.
La ecocardiografía es fundamental para el diagnóstico del compromiso cardíaco por amiloidosis, describiéndose signos sugestivos de cardiomiopatía restrictiva (8,9):
Aumento en el grosor de la pared ventricular izquierda mayor o igual a 12 mm más miocardio de apariencia moteada (granular) brillante (26 %).
FEVI preservada en los estadios iniciales más ondas S y E reducidas al nivel basal, septal o lateral.
Disminución de la velocidad de flujo a través de la válvula mitral en la fase inicial de la diástole (caída de la onda E) y aumento en la fase tardía (aumento de la onda A). Una inversión de la relación E:A es signo precoz de afección.
Dilatación biauricular y de la vena cava más el engrosamiento del septum interatrial.
Derrame pericárdico (hasta en 50 % de casos).
Existe una asociación entre los hallazgos ecocardiográficos y el pronóstico (6,7): un grosor de las paredes septal y posterior menor o igual a 12 mm implica un promedio de vida de 2,4 años. Grosor entre 12-15 mm, un promedio de vida de 1,3 años; 35 % con disfunción sistólica. Grosor de paredes mayor o igual a 15 mm, un promedio de vida de 0,4 años; 70 % con disfunción sistólica.
La aspiración de grasa abdominal a través de aguja fina y biopsia de glándulas salivares menores tienen una sensibilidad del 75 %. En caso de no lograrse el diagnóstico, se recomienda hacer una biopsia específica del órgano involucrado (casos 1 y 2).
La resonancia cardíaca tiene una alta sensibilidad para la cardiomiopatía infiltrativa (11). Se observa un patrón de realce tardío, global, de gadolinio (este hallazgo estuvo presente en los 3 casos mencionados). Estos hallazgos por imagen se correlacionan con la biopsia endomiocárdica (S: 88 %, E: 95 %), que es estándar para el diagnóstico (S: 95-98 %) (12,13).
En caso de AAL, se debe confirmar la presencia de cadenas ligeras kappa o lambda mediante electroforesis o inmunofijación en suero y orina (S: 90 %). Se observan células plasmocitoides en la médula ósea hasta en el 50 % de casos.
La terapia diurética es el eje del tratamiento de la falla cardíaca secundaria a la amiloidosis (14). Se debe ser cauto con el uso de betabloqueadores y calcioantagonistas no dihidropiridínicos, por su efecto inotrópico negativo. No se recomienda el uso de digoxina.
La quimioterapia está dirigida a linfocitos B clonales (14,15). Melfalán y dexametasona tienen beneficio limitado en AAL cardíaca. El trasplante de células madre autólogo y la quimioterapia con bortezomib o lenalidomida en dosis elevadas han mejorado el pronóstico (16). Se ha considerado el trasplante cardíaco como una opción terapéutica, seguido de la quimio-terapia de 6-12 meses, con buenos resultados sin recidiva tras los 3-5 años (15,16).
Los casos presentados ejemplifican las manifestaciones y hallazgos clínicos, electrocardiográficos e imagenológicos del compromiso cardíaco por amiloidosis, reflejando la importancia de un abordaje integral en los pacientes con falla cardíaca y síncope en el ser-vicio de urgencias, que incluya esta entidad dentro de los diagnósticos a considerar. Se debe prestar especial atención a los hallazgos sugestivos de una patología infiltrativa como la amiloidosis dentro de las causas de miocardiopatía restrictiva.
CONCLUSIÓN
El compromiso cardíaco por amiloidosis debe considerarse en los pacientes con falla cardíaca de novo y episodios sincopales recurrentes, en contexto de trastornos de conducción cardíacas y bajo voltaje eléctrico, sin otra causa aparente. El ecocardiograma constituye una herramienta fundamental para el enfoque inicial y la resonancia cardíaca permite un estudio detallado con los hallazgos que se correlacionan altamente con la biopsia endomiocárdica. Es fundamental el reconocimiento temprano y el descarte del mieloma múltiple subyacente, dadas sus implicaciones pronósticas.














