INTRODUCCIÓN
El coma mixedematoso (CM) es una forma grave y potencialmente mortal de hipotiroidismo descompensado, secundario al déficit grave y prolongado de las hormonas tiroideas. Presenta una baja incidencia que varía entre 0,22 a 1 caso por millón de habitantes/año y corresponde a una emergencia endocrina con alta mortalidad (20-50 %) (1-3).
Es un reto diagnóstico debido a que no hay manifestaciones específicas del CM y a la ausencia de un biomarcador que discrimine entre un hipotiroidismo profundo y el CM. Los reportes publicados al momento son escasos, lo cual genera que las recomendaciones diagnósticas y terapéuticas se basen en una evidencia tipo III. El 80 % de los casos corresponde a mujeres ancianas, pero hay reportes en la población pediátrica y gestantes (2,4-7).
Por lo anterior, el objetivo de este artículo es presentar el caso de un hombre con CM sin diagnóstico previo de hipotiroidismo que cursó con manifestaciones clínicas infrecuentes.
DESCRIPCIÓN DEL CASO
Hombre de 63 años, agricultor, exfumador. Consultó en una institución de primer nivel por episodio convulsivo tónico clónico generalizado con un mes de tos húmeda, rinorrea y disnea. Se sospechó de una neumonía, por lo que se remitió a una institución de mayor nivel de complejidad donde ingresa en mal estado general, hipotenso y con alteración del sensorio (Glasgow 8/15). Se decide asegurar la vía aérea y se solicitan paraclínicos iniciales que documentan sodio: 111 mEq/L y concentración de la hormona estimulante de tiroides (TSH, sigla en inglés) 40 UI/L, se administra solución salina hipertónica, soporte vasopresor, hidrocortisona, levotiroxina y lo remiten a nuestra institución.
En el ingreso se encontró hipotenso (84/42 mmHg), bradicárdico (52 latidos por minuto) y con hipotermia (temperatura: 35,9 °C). Tenía facies abotagadas (Figura 1A) y estaba en anasarca, la tiroides no era palpable, presentaba ruidos cardiacos alejados, crépitos generalizados, pseudohipertrofia de los músculos gastrocnemios y enlentecimiento de la fase de relajación del reflejo aquiliano. Un electrocardiograma evidenció bradicardia sinusal, bloqueo auriculoventricular de primer grado, bajo voltaje y anormalidad de la repolarización ventricular (Figura 2).
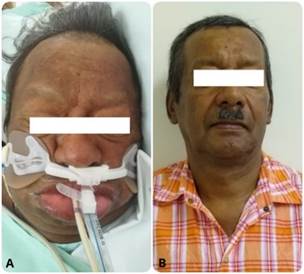
Figura 1 Hallazgos del examen físico previos y posteriores al tratamiento con levotiroxina. A. Facies abotagadas, madarosis y pérdida difusa del cabello en la región frontoparietal. B. Franca recuperación del estado físico a los 60 días. Fuente: elaboración propia, con el consentimiento del paciente
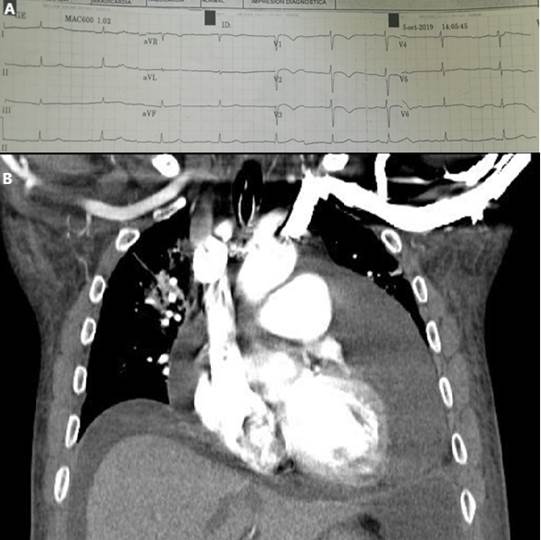
Figura 2 Demostración de alteraciones paraclínicas secundarias al derrame pericárdico y la ascitis. A. Electrocardiograma de superficie. B. Tomografía de tórax y abdomen superior (corte coronal) destaca el importante derrame pericárdico y ascitis. Fuente: creación propia
En la Tabla 1 se muestran los resultados de laboratorio iniciales. Destaca la presencia de neutrofilia, anemia leve normocítica, hiponatremia grave, hipercapnia, elevación significativa de la creatinina-fosfocinasa (CPK, sigla en inglés), TSH alta con concentración de hormona tiroxina libre baja (T4L): 0,25 (0-89-1,76 ng/dL) y triyodotironina total (T3T) indetectable. La tomografía toracoabdominal evidenció signos de consolidación alveolar, edema pulmonar en fase alveolar, derrame pericárdico y ascitis (Figura 2: Inferior). El ecocardiograma reveló un ventrículo izquierdo con fracción de eyección del 48 % y derrame pericárdico grave. Todos los estudios microbiológicos en la sangre y de lavado bronco-alveolar fueron negativos. Se realizó un estudio del líquido pericárdico con proteínas en 4,2 gr/dL, glucosa: 104 mg/dL, la baciloscopia, la concentración de adenosín deaminasa y la reacción de cadena de polimerasa para tuberculosis fueron negativas. Se consideró el debut de un hipotiroidismo profundo con CM, síndrome convulsivo secundario a hiponatremia grave, rabdomiólisis moderada, insuficiencia respiratoria mixta, neumonía grave y choque mixto. La escala APACHE-II predijo una mortalidad aproximada del 75 %; se continuó el manejo farmacológico con levotiroxina oral a 300 mcg/día durante los primeros 3 días y luego se incrementó a 400 mcg/día, junto con hidrocortisona intravenosa. A pesar de la ausencia de aislamiento microbiológico, se completó el manejo antimicrobiano empírico con ampicilina/sulbactam y claritromicina. Durante su estancia estuvo bradicárdico a pesar del choque y soporte vasopresor y la temperatura durante la primera semana se mantuvo entre 35-36 °C. Posteriormente, hubo una evidente mejoría clínica, resolución del choque y recuperación el estado de alerta; no presentó compromiso renal por pigmentos. Luego de 12 días se dio egreso con levotiroxina, ulterior a la normalización en la concentración de T4. Fue valorado en consulta externa por nuestro servicio con ostensible mejoría del aspecto físico y de la función tiroidea tomando 100 ug día de levotiroxina (Figura 1). El paciente y sus familiares dieron consentimiento informado para tomar los datos de la historia clínica y el uso de fotografías con el fin de la publicación científica, también se contó con el aval del Comité de ética del Hospital San Vicente Fundación.
Tabla 1 Resultados del laboratorio
| Laboratorio | Resultado |
|---|---|
| Leucocitos | 10 600 cel/Ul |
| Neutrófilos | 9 700 cel/Ul |
| Linfocitos | 500 cel/Ul |
| Hemoglobina - hematocrito | 11,9 gr/dL - 34 % |
| Plaquetas | 235 00 cel/Ul |
| Nitrógeno ureico - creatinina | 9 mg/dL - 0,72 mg/Dl |
| Proteína C reactiva | 8,81 mg/Dl |
| Gases arteriales | pH: 7,27 CO2: 65 mmHg PaO2: 59 mmHg HCO3: 24 meq/L |
| Glucosa | 71 mg/dL. |
| Lactato | 1,5 mg/Dl |
| Sodio | 114 meq/L |
| Cloro | 80 meq/L |
| Potasio | 3,2 meq/L |
| CPK (32 y 294 U/L) | 5078 U/L |
| ALT - AST | 39 - 140 mg/Dl |
| TSH (0,55-4,78 UI/mL) | 31 |
| T4L (0-89-1,76 ng/dL) | 0,25 |
| T3T (VR: 0,58-1,59 pg/dL) | < 0,40 |
| Anticuerpos antimicrosomales | 10,8 (0-12 UI/mL) |
| Anticuerpos antitiroglobulina | 18,02 (< 100 UI/mL) |
| Cortisol | 38,9 ug/Dl |
| FSH | 10,96 (1,5-12 ng/dL) |
| LH | 5,57 (1,7 - 8,6 ng/dL) |
| IGF-1 | 60,90 ng/mL (43-220) |
| Prolactina | 8,35 ng/Ml |
| Testosterona total | 26 ng/dL (348-1.197) |
VR: valor de referencia. Fuente: creación propia
DISCUSIÓN
Es inusual el debut de un hipotiroidismo con CM, así como la presencia de rabdomiólisis, derrame pericárdico y convulsiones. La alteración del sensorio o el trastorno del procesamiento sensorial (TPS) (no necesariamente coma) es una condición sine qua non para establecer el diagnóstico. Lo usual es el desarrollo de la entidad en “dos golpes”: inicialmente hay un cuadro de semanas a meses de los síntomas del hipotiroidismo per se inespecíficos y, tras un precipitante, se desarrolla el CM. La hipotermia está ausente en el 25% de los casos (especialmente, si el precipitante es una infección); la presencia de choque con bradicardia y la identificación de un precipitante soportan el diagnóstico. De forma clásica, se describen signos de hipotiroidismo como el abotagamiento facial con edema periorbitario, macroglosia, edema sin fóvea, xerodermia, cabello tosco y el enlentecimiento en la fase de relajación de los reflejos (signo de Woltman) (1,8).
Las manifestaciones cardiovasculares incluyen insuficiencia cardiaca, derrame pericárdico rico en mucopolisacáridos y/o lípidos, bradicardia, bloqueo auriculoventricular, intervalo QT prolongado, cambios en la onda T y bajo voltaje. La regulación a la baja de receptores de catecolaminas puede generar un estado de choque refractario. En ocasiones, se encuentra un derrame pleural de tipo trasudado. Hay tendencia al sangrado debido al déficit adquirido del factor de von Willebrand y de los FVIII, FIX y FXI, además del aumento de la actividad fibrinolítica, del plasminógeno y la disminución del inhibidor del activador del plasminógeno (9). Dentro de las alteraciones de laboratorio se incluyen la anemia de volúmenes variables, hiponatremia hipoosmolar euvolémica o hipervolémica debido a la secreción inadecuada de la hormona antidiurética y disminución del filtrado glomerular, respectivamente (10,11).
En casos graves puede acompañarse de hipoglucemia e hipercapnia. Se ha descrito un espectro de lesiones bajo el concepto de miopatía hipotiroidea, usualmente indolora. La CPK puede alcanzar niveles muy altos, pero es raro que curse con una lesión renal por pigmento. Ocurre mixedema y, en casos graves en ausencia de tratamiento, puede presentarse pseudohipertrofia muscular, principalmente en los músculos gastrocnemios (síndrome de Hoffman) como en este caso (8).
El 90 % de los casos son secundarios a hipotiroidismo primario y el 80 % corresponde a pacientes con diagnóstico conocido que abandonan el tratamiento. Como se mencionó previamente, es raro el debut clínico de hipotiroidismo con CM. En ausencia de historia clínica se debe estar atento a la presencia de una cicatriz de tiroidectomía, exoftalmos de una posible enfermedad previa de Graves-Basedow tratada con yodo radioactivo, signos de hipotiroidismo franco o de hipopituitarismo. Los niveles de TSH usualmente están muy elevados, aunque pueden no estarlo en caso de una administración previa de esteroides, vasopresores o inotrópicos y/o en el desarrollo del síndrome eutiroideo enfermo. Si bien el grado de elevación de la TSH o del descenso en la concentración de T4 o T3 no predice CM ni desenlaces adversos, es más probable encontrar en los pacientes con CM concentraciones de TSH > 30 UI/mL. En aproximadamente el 10 % el origen es central, lo que debe sospecharse en caso de una concentración de TSH < 10 UI/mL en presencia de valores muy bajos de T4 libre o una deficiencia hormonal de otros ejes (12). El diagnóstico se establece por clínica, se han diseñado hasta la fecha dos escalas con este fin: las propuestas por Popoveniuc et al. y Chiong et al. fueron diseñadas en 14 y 11 pacientes respectivamente, se requiere validación de estas en nuestra población (13,14). El paciente cumplía con los criterios para ambas escalas.
Es usual que requieran de soporte vasopresor o ventilatorio, este último en ocasiones prolongado. Pueden tener insuficiencia adrenal (IA), primaria, en ocasiones asociada con un hipotiroidismo primario autoinmune (síndrome de Schmidt); o IA secundaria, con mayor frecuencia asociada con hipotiroidismo central, que pueden pasar inadvertidas. La administración de levotiroxina acelera el metabolismo hepático del cortisol y por esta razón, previo a la administración de la hormona tiroidea, se debe asegurar el inicio de glucocorticoides sistémicos para evitar el riesgo de desencadenar una crisis adrenal aguda. Lo ideal es hacer una medición de cortisol sin que esto retrase el inicio de la hidrocortisona. La dosis recomendada son 100 mg (intravenosa) cada 8 horas y se debe mantener de 7-10 días según la evaluación del eje hipófisisadrenal (15).
Es crucial la identificación del desencadenante: infección, exposición a ambientes fríos, sangrado gastrointestinal, infarto del miocardio o cerebral, medicamentos, etc. Hasta el 50 % de los pacientes fallecen debido a sepsis, es por esta razón que algunos autores recomiendan la administración de antibióticos empíricos cuando no se documenta otro precipitante (7). Es debatido el tipo de hormona (T4 vs. T3 o, ambas), la dosis (muy altas vs. altas) y la ruta de administración (intravenosa vs. oral). Algunos autores prefieren usar T3 debido a que es biológicamente activa, tiene un inicio de acción rápido y no depende de la conversión por las desyodinasas a nivel tisular, adicionalmente cruza la barrera hematoencefálica. Sin embargo, el rápido inicio de acción puede empeorar la inestabilidad cardiovascular por el aumento abrupto de las demandas metabólicas y arritmias, por lo que en la actualidad se prefiere usar T4 (precursor de T3), la cual cuenta con un adecuado perfil de eficacia/seguridad y disponibilidad. Deben evitarse dosis muy altas de levotiroxina (> 500 mcg/día), especialmente en ancianos. Se prefiere la administración intravenosa, ya que la absorción oral es impredecible debido al edema de asas por infiltración de mucopolisacáridos y el hipoperistaltismo. Sin embargo, la biodisponibilidad de esta presentación es muy limitada, por lo que se utilizan rápidamente dosis de 200-400 mcg por vía oral o a través de una sonda nasogástrica durante los primeros días (3-7 días), con una ulterior titulación para alcanzar concentraciones normales de T4L.
La hiponatremia grave debe corregirse con precaución, ya que se debe asumir como crónica por el mecanismo que la produce. Dentro de los predictores de mal pronóstico se encuentran las convulsiones, el APACHE II y la necesidad del soporte ventilatorio o vasopresor. En el presente caso, aunque se presentaron todas estas condiciones, afortunadamente el desenlace fue satisfactorio (16-18).
CONCLUSIONES
Presentamos un caso con un conjunto de manifestaciones infrecuentes asociadas a CM como debut de hipotiroidismo en un hombre. A pesar de tener predictores de mal pronóstico durante su evolución, y gracias a un manejo multidisciplinario, se logró resolver la condición de forma favorable. No existen escalas diagnosticas ni biomarcadores que permitan diferenciar un hipotiroidismo profundo de un CM y los niveles de TSH no son predictores de la gravedad en casos de coma. El inicio de la levotiroxina por vía oral es seguro y efectivo junto con la previa iniciación de los glucocorticoides, dado el potencial riesgo de desarrollar una crisis adrenal aguda. El abordaje integral y oportuno permite lograr un curso clínico favorable de los pacientes con CM.














