INTRODUCCIÓN
La parálisis completa del nervio facial fue descrita en el 1829 por el Dr. Charles Bell como parte de un síndrome secundario a una lesión del foramen estilomastoideo. Actualmente se describe como una parálisis idiopática aguda, tipo motoneurona inferior (1).
La parálisis de Bell está bien documentada en la población pediátrica (2), con una menor información sobre la población neonatal (3-6). Se ha reportado una prevalencia del 0,23 al 1,8 % en recién nacidos vivos (1). La ocurrencia de la parálisis facial periférica en los recién nacidos se ha asociado, principalmente, con el parto traumático. Sin embargo, existen otras causas de origen infeccioso, inflamatorio, neoplásico y en asocio con dimorfismos craneofaciales (5).
El objetivo de este artículo es reportar que el tratamiento de la parálisis facial periférica idiopática en un recién nacido con aciclovir y terapia física, puede presentar un desenlace favorable prescindiendo del uso de esteroides.
CASO CLÍNICO
Paciente masculino con 22 días de vida, previamente sano, ingresa por cuadro clínico de 3 días consistente en parálisis facial derecha. Madre niega historia de fiebre, otalgia u otorrea, lesiones vesiculares en la cara o algún tipo de trauma.
Madre primigestante, parto vaginal institucional a término, no instrumentalizado, sin complicaciones, obteniendo un recién nacido con Apgar 9/10, con un adecuado peso al nacer, cultivo recto-vaginal y urocultivos previos negativos, sin otros antecedentes obstétricos relevantes. TSH neonatal normal. Paciente alimentado con lactancia materna exclusiva.
En el examen físico el paciente está alerta, reactivo, con un buen estado nutricional y parálisis de los músculos de la mímica facial de la hemicara derecha (periorales y frontales). Lagoftalmos derecho, pupilas reactivas con movimientos oculares conservados (Figura 1A). Otoscopia bilateral normal, sin signos de síndrome de Ramsay-Hunt. Desviación de la comisura labial hacia la izquierda, con control oromotor alterado en el lado derecho, presión intraoral disminuida y lingual incompleta, más escaso derrame de alimento por la comisura labial derecha. Examen neurológico sin alteración en otros pares craneales, tono normal, reflejos primitivos presentes, movilidad y estado de conciencia sin alteraciones.
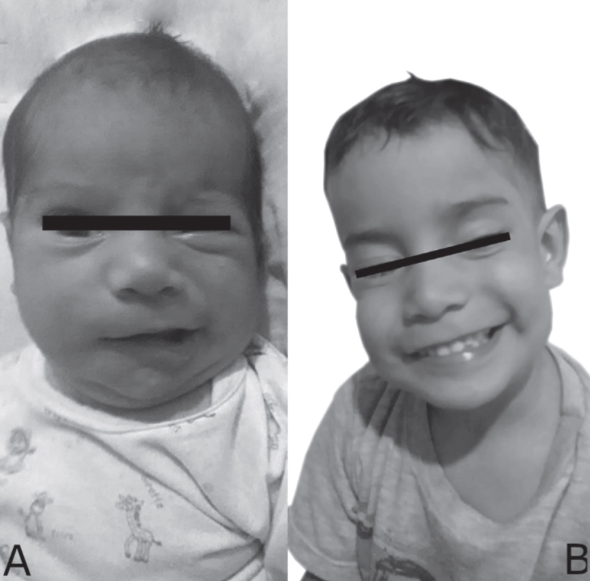
Fuente: para la publicación fotografías se contó con el consentimiento informado de la madre
Figura 1 Admisión y seguimiento de paciente con parálisis de Bell. A) Paciente con asimetría facial, parálisis facial periférica derecha al día 22 de vida. B) Paciente con resolución completa de la parálisis facial periférica, con simetría facial a los 3 años de vida.
Se documentó en hemograma, leucocitosis leve (22.305 células/μL, 2DS = 19.500 células/μL) sin bandas, con proteína C reactiva (CRP) en 55,6 mg/L (positivo > 5 mg/L), hemocultivo negativo. Punción lumbar con análisis del líquido cefalorraquídeo (LCR) sin alteraciones, con gram y cultivos negativos. No se realizó reacción en cadena de polimerasa para el virus herpes por no disponibilidad, no se documentó contacto epidemiológico posnatal. Resonancia magnética nuclear (RMN) cerebral simple y contrastada donde no se identificaron alteraciones.
El paciente recibió una dosis de ampicilina (100 mg/ Kg) y gentamicina (4 mg/Kg). Este esquema se suspendió por el reporte preliminar de hemocultivo negativo y ausencia de síntomas de respuesta inflamatoria sistémica. Además, recibió carboximetilcelulosa sódica 5 mg (1 %) 4 veces al día en el ojo derecho y aciclovir (dosis 60 mg/kg/día) endovenoso cada 8 horas por 5 días. No se documentaron efectos adversos. Asimismo, se realizó terapia física con electroestimulación en la musculatura orofacial, terapia ocupacional y por fonoaudiología, con educación en técnicas de alimentación.
Se dio egreso al séptimo día con leve mejoría de la parálisis facial, se descartó etiología bacteriana, traumática y anormalidades estructurales craneofaciales, se consideró una probable etiología viral por el virus herpes o idiopática.
Se realizó electromiografía con hallazgos compatibles con lesión axonal severa del nervio facial derecho. Posterior evolución favorable con remisión parcial a los 12 meses de edad y remisión completa a los 3 años (Figura 1B).
DISCUSIÓN
En el recién nacido el nervio facial presentaba una posición más superficial durante su emergencia por el foramen estilomastoideo, siendo más susceptible a compresiones o lesiones al pasar por el canal del parto o secundario al uso de fórceps (7).
Dentro de las etiologías de la parálisis facial congénita se deben descartar las causas traumáticas como el parto instrumentado, sindromáticas (Moebious, Goldenhar, síndrome cardiofacial de Cayler, Poland, CHARGE, entre otros) (8,9) y no sindromáticas debidas a los fallos aislados de la formación del séptimo par, con aplasia o hipoplasia (10). También se debe considerar la agenesia o hipoplasia del músculo depresor del ángulo de la boca o del músculo depresor del labio inferior, evidentes durante el llanto con deformidad limitada al tercio inferior de la cara, respetando el surco nasogeniano (11).
Se han descrito causas adquiridas por infecciones agudas como la otitis media aguda (12), infecciones crónicas como la toxoplasmosis (10), y alteraciones endocrinas como hipovitaminosis A (13). Según la presentación clínica, se deben también excluir infartos cerebrales (14) o neoplasias en la fosa posterior.
Pandita et al. reportaron en una serie de casos de tres neonatos con parálisis facial periférica: todos los pacientes presentaban comorbilidades, 2 de ellos eran pretérmino y sus madres con diversas morbilidades (hipotiroidismo, colestasis intrahepática), con parto por cesárea secundaria a estados fetales no satisfactorios y manejo final con ventilación por presión positiva continua (CPAP).
Los autores proponen que la aplicación de CPAP genera una estrecha interfase, que puede llegar a comprimir el nervio facial en su salida por el foramen estilo mastoideo (4). En nuestro caso, se trata de un recién nacido previamente sano, en quien no se documentó el requerimiento del soporte ventilatorio.
Otros autores han reportado la presencia de síntomas respiratorios previos a la parálisis facial periférica en un neonato a término, con parto vaginal espontáneo, que a las cuatro semanas de vida desarrolló parálisis facial derecha tipo motoneurona inferior, con RMN cerebral normal (3).
En el caso que reportamos, la parálisis no estuvo precedida por síntomas respiratorios ni fiebre. Aunque sí se evidenció leucocitosis y CRP elevada, en ausencia de sintomatología clínica y hemocultivo negativo, se consideraron hallazgos inespecíficos.
Gupta et al. documentan el caso de un recién nacido masculino con asimetría facial y dificultad para succionar desde el nacimiento, con el antecedente de parto vaginal asistido con expulsivo difícil y RMN cerebral normal (6). Más recientemente, Khair & Ibrahim describen el caso de un paciente con 15 días de vida, parto espontáneo a término, con cuadro de asimetría facial de dos días de evolución, sin repercusiones en la lactancia, compatible con parálisis facial izquierda tipo motoneurona inferior, con RMN cerebral normal y estudios de LCR sin alteraciones (5).
En nuestro caso, el debut de los síntomas inició a los 22 días de vida, temporalidad que hace poco plausible su asociación con el trauma obstétrico, y no se documentaron alteraciones en el LCR.
La parálisis de Bell es un diagnóstico de exclusión en el recién nacido que supone la realización de neuroimagen, posterior a descartarse trauma obstétrico y neuroinfección.
Existen ciertas hipótesis sobre su etiología. Chen et al. reportan que, en 29 niños con parálisis de Bell, aproximadamente el 60 % presentaba historia de síntomas respiratorios altos, sospechando de etiología viral, con aislamiento del virus del herpes simple y varicela-
zóster en pacientes afectados (15). Esta hipótesis se ve respaldada por el caso de Saini et al. (3).
Murakami et al. identificaron el DNA viral del virus del herpes simple en el fluido endoneural posquirúrgico en pacientes adultos con parálisis facial (16). Existe evidencia que sugiere que lo anterior es secundario a una reactivación y replicación del virus herpes en los ganglios geniculados, con posterior inflamación y atrapamiento del nervio facial dentro del canal óseo donde surca, seguido de isquemia, neuropraxia y degeneración, traduciéndose en parálisis facial periférica (17-19). Se ha propuesto el uso de antirretrovirales en la parálisis de Bell, siendo el aciclovir a dosis de 60 mg/Kg/día seguro en neonatos (20).
En cuanto al pronóstico, la mayoría de infantes mejorará con o sin tratamiento (1,6) y sin mayores secuelas (7). Pese a esto, se ha encontrado evidencia sobre un posible beneficio del uso de esteroides solos o en conjunto con aciclovir, aunque esta no ha sido concluyente en la población pediátrica (21,22). En los casos reportados por Khair & Ibrahim y Saini et al., ambos neonatos recibieron cursos de esteroides orales por 7 días con resolución completa del cuadro a las 2 semanas, y por 6 semanas con evolución satisfactoria, respectivamente y sin complicaciones (3,5).
Se reconocen múltiples efectos adversos de los esteroides, tanto agudos (hipertensión arterial, hiperglicemia, hemorragia o perforación gastrointestinal), como tardíos (hemorragia intraventricular, disminución del volumen de la sustancia gris, anormalidades neurosensoriales y encefalográficas) (23,24).
Dado que no hay consensos sobre la seguridad de su uso, sobre todo a largo plazo, se deben reservar para neonatos que no tengan otra opción y minimizar su duración y dosis (25). En nuestro caso, se prefirió un manejo con antirretroviral endovenoso por 5 días, fisioterapia y terapia ocupacional durante 1 año.
CONCLUSIONES
El diagnostico de parálisis de Bell en neonatos debe establecerse posterior a la exclusión de causas traumáticas, infecciosas y alteraciones anatómicas. En la parálisis de Bell neonatal, la terapia antirretroviral y un programa de rehabilitación física adherente constituyen una alternativa terapéutica, al tiempo que se prescinde del uso de esteroides. Existen vacíos en el conocimiento acerca del rol de la terapia esteroidea y antirretroviral en la parálisis de Bell neonatal.














