Introducción
El año 2020 estuvo marcado por una pandemia causada por el virus respiratorio nuevo coronavirus (SARS-CoV-2), diseminado a más de 50 países al mes de su identificación en China (1). Al igual que sus predecesores, el SARS-CoV y MERS-CoV, la diseminación de este coronavirus no se produce en forma homogénea (lo que supone que dentro de una población todos los individuos susceptibles tienen las mismas posibilidades de infectarse), sino que ocurre de forma heterogénea. Lo anterior ha sido explicado por estudios observacionales y de modelación a través del Principio de Pareto, donde se cree que el 20% de los individuos dentro de una población contribuyen al menos con el 80% del potencial de transmisión neto de un patógeno (2-6). Por tanto, ese 20% de individuos serían los superdiseminadores (SD) (2-6).
Los SD pueden caracterizarse por variables o circunstancias como alta carga viral, tos más grave, dispersan la infección antes de conocer su infección; trabajan, viven o visitan sitios confinados o hacinados; viajan a muchos lugares, incrementando la posibilidad de transmisión; incumplen instrucciones de protección como la cuarentena; o participan en reuniones públicas (4).
El primer caso registrado de SD se presentó entre 1900-1907, Mary Maloon o Mary Tifoidea era portadora asintomática de Salmonella Typhi, que siendo cocinera infectó a 51 individuos, tres de los cuales fallecieron (7,8). En 1989, un estudiante de secundaria en Finlandia infectó a 22 compañeros con sarampión (9). En 1992 un SD con tuberculosis contribuyó con el 35% de los nuevos casos de tuberculosis activa en Minneapolis (10). En 1995, en la República Democrática del Congo, dos individuos con ébola infectaron a más de 50 casos secundarios (11).
En la epidemia del SARS-CoV del 2002-2003 la mayoría de los pacientes tenía muy baja infectividad, y los eventos de SD fueron lo particular en esta epidemia (12). En Hong Kong en 2003, uno de los dos SD infectó a 138 de156 individuos que tuvieron contacto con él en el Hospital Prince of Wales (personal de salud, pacientes y visitantes) (13-15). El brote del MERS-CoV en Corea del Sur en 2015 comenzó con un caso índice importado con características de SD, el paciente visitó varias clínicas antes de ser hospitalizado y generó 29 casos secundarios, dos de los cuales fueron responsables de 106 infecciones subsecuentes (15,16).
No está claro por qué algunas personas (SD) infectan un gran número de contactos secundarios. Esto parece estar determinado por factores del hospedero, del patógeno o del medio ambiente (7). Más de un factor puede estar implicado en el mismo brote. La enfermedad no reconocida o mal diagnosticada en el paciente es la causa más común de estos eventos de SD, seguida por la forma de transmisión del microorganismo (aerosoles o gotitas), alta tasa de contacto estrecho, coinfecciones y la transferencia entre hospitales (17).
Presentamos un estudio de vigilancia epidemiológica y describimos algunas características de los SD en Cartagena (Colombia) durante la pandemia por SARS-CoV-2.
Metodología
Se adoptaron las diferentes definiciones de caso consignadas en el documento de lineamientos para la detección y manejo de casos de COVID-19 por los prestadores de servicios de salud en Colombia del Ministerio de Salud y la Protección Social (17).
Superdiseminadores: minoría de personas que infectan desproporcionadamente a contactos susceptibles, en comparación con la mayoría de los individuos que infectan a pocos o ningún otro (17).
Tasa de ataque primaria: es la proporción de casos primarios entre los expuestos (18).
Tasa de ataque secundaria: es la proporción de contactos de un caso primario que enferman (18).
Vigilancia epidemiológica activa
Estudio de vigilancia epidemiológica centinela realizado por el Comité de infecciones de la clínica Gestión Salud y el Departamento Administrativo Distrital de Salud (DADIS), en Cartagena, desde el 25 de febrero al 18 abril del 2020, basado en las alertas sanitarias emitidas por la OMS y el Ministerio de Salud de Colombia sobre el SARS-CoV-2.
La primera etapa, de preparación, se realizó previo a confirmar el primer caso de COVID-19. Se gestionó un plan de acción ante la sospecha y confirmación de casos, medidas de prevención y educación. La siguiente etapa, de contención, inició con el primer caso confirmado, se tomaron medidas estrictas de aislamiento social en la ciudad para evitar la propagación y diseminación de la infección. Se realizó búsqueda activa de los contactos estrechos de los SD y exámenes confirmatorios de laboratorio. De acuerdo con los resultados, se procedió con aislamiento social, manejo sintomático u hospitalización de ser necesario. En la última etapa, de mitigación, la RT-PCR fue estandarizada por el laboratorio de medicina tropical de la Universidad de Cartagena, disminuyendo los tiempos de resultados.
Resultados
En Cartagena, el primer caso confirmado con COVID-19 fue el 8 de marzo de 2020, correspondiente a una paciente extranjera de 85 años de nacionalidad inglesa. De este primer caso, hubo 3 contactos positivos (2 enfermeras y un médico) en la institución donde se hospitalizó. Sin embargo, el primer SD en Cartagena fue un paciente de sexo masculino de 56 años procedente y residente en Cartagena, taxista, con antecedente de hipertensión arterial y diabetes mellitus tipo 2.
Detección del primer superdiseminador y sus contactos
La identificación del primer SD fue en forma retrospectiva, como se describe en la mayoría de la literatura. El 4 de marzo del 2020, el paciente (1er SD) transportó a turistas italianos, el 6 de marzo inició con síntomas de tos seca, fiebre y disnea. Visitó varias instituciones de salud entre el 9 y 11 de marzo antes de ser hospitalizado en una clínica el 13 del mismo mes, falleciendo el 16 de marzo (Figura 1). El personal de salud que estuvo en contacto con el paciente no usó equipos de protección personal (EPP) adecuados durante su atención ni mantuvieron las medidas de aislamiento y distanciamiento en el área de atención donde estuvo hospitalizado, por lo cual estuvieron expuestos personal de salud, pacientes y familiares.
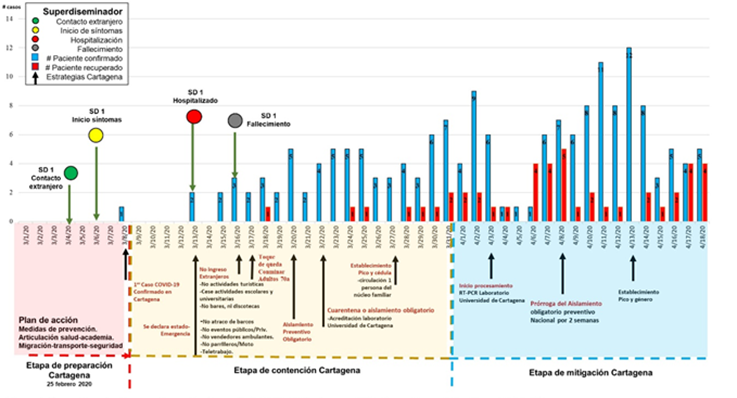
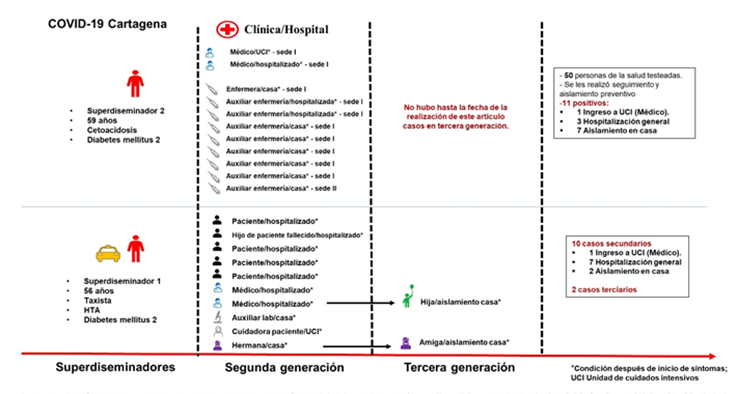
Figura 1 Superdiseminadores en la pandemia por COVID-19 Cartagena 2020. Fuente: Coronell-Rodríguez W, DADIS
El diagnóstico de COVID-19 fue confirmado por nexo epidemiológico (hermana positiva para COVID-19) y hallazgos post mortem. Fue la primera muerte por COVID-19 reportada en Colombia (19).
El DADIS realizó vigilancia, y abordaje de los contactos, con RT-PCR para SARS-CoV-2, seguimiento por telemedicina y contacto telefónico. Diez infecciones secundarias se confirmaron de este caso índice, de los cuales el 10% (1/10) requirió hospitalización en UCI, 70% (7/10) en sala general y 20% (2/10) realizó cuarentena en casa. Los contactos que se tornaron sintomáticos lo hicieron entre los 5-10 días, después del contacto con el caso índice. De las personas contagiadas, nueve fueron intrahospitalarias. Adicionalmente, dos de estos casos secundarios fueron responsables por otros dos casos subsecuentes (Figura 2). Debido a que se desconoce el número exacto de personas con las que estuvo en contacto el turista y el caso índice, no se pudo calcular la tasa de ataque primaria y secundaria, respectivamente.
Detección del segundo superdiseminador y sus contactos
En este caso se identificaron los contactos por búsqueda activa de parte del Comité de infecciones de la Clínica Gestión Salud de Cartagena y el SD fue determinado retrospectivamente.
El segundo SD en Cartagena fue un paciente masculino de 59 años, con diabetes mellitus tipo 2, que consultó por cetoacidosis diabética. Tratado en la urgencia de la sede 2 de la institución y posteriormente trasladado a la sede 1 estipulada como “NO COVID-19”, para continuar manejo. En esta sede se reinterroga y encontrando datos de anosmia y disgeusia, se le realizan pruebas serológicas y RT-PCR para SARS-CoV-2 reportadas positivas y habiendo transcurrido 48 horas desde su hospitalización en la sede 2. El personal de salud (médicos, enfermeras, auxiliares de enfermería, camilleros, conductores) no utilizó los EPP adecuados ni mantuvo el distanciamiento físico recomendado en la atención del paciente, por lo que fueron definidos como contactos estrechos. Se hizo búsqueda activa de contactos, se completaron las fichas epidemiológicas de notificación de caso y a todos se les tomó muestras por hisopado nasofaríngeo para RT-PCR por parte del personal de terapia respiratoria entrenados.
Los casos fueron notificados al DADIS para su vigilancia y seguimiento. Todos los contactos estrechos fueron a aislamiento preventivo y, de acuerdo con esta vigilancia y evolución, se consideró seguir manejo en casa, hospitalización general o ingreso a UCI. Los contactos que iniciaron síntomas lo hicieron entre los 7-14 días del contacto con el caso índice.
Hubo 50 contactos del personal de salud (médicos, jefes de enfermería, auxiliares de enfermería, servicios generales) entre las dos sedes, para una tasa de ataque secundaria intrahospitalaria del 22%; resultando 11 contactos positivos, siete con aislamiento en casa, tres hospitalizados en sala general y una persona en UCI (Figura 2).
El 2º SD se deterioró clínicamente con compromiso respiratorio, mediante tomografía axial computarizada de tórax de alta resolución se evidenció compromiso pulmonar entre el 50-75%, requirió ventilación mecánica invasiva, soporte vasopresor, una estancia prolongada en UCI traqueostomía y presentó infecciones secundarias. Se recuperó con un déficit físico importante y psicológico, fue trasladado al hogar de cuidados crónicos.
Una rápida intervención, una vigilancia activa, la realización de pruebas diagnósticas, la identificación temprana de los casos positivos y un aislamiento preventivo sobre los contactos conllevó a la no propagación del virus a más personas y no más casos.
Discusión
Los SD representan un punto clave para la propagación y control de una infección. En los casos presentados, ambos compartieron factores que contribuyeron a la superdiseminación, llamados actualmente eventos de superdiseminación (ESD) (20). Dentro de estos ESD se resalta: 1. El no reconocimiento o diagnóstico de la infección. En el primer caso el paciente presentó sintomatología inespecífica, síntomas constitucionales y respiratorios superiores que, en ese momento, no se correlacionaron con un caso probable de la COVID-19. Durante la atención médica del paciente, muchas personas estuvieron expuestas: médicos, pacientes internados y visitantes de la clínica; además, el diagnóstico confirmado de COVID-19, en este caso, fue hecho post mortem. Con el segundo paciente, su sintomatología fue compatible con una descompensación de su enfermedad de base (diabetes mellitus). Sin embargo, se determinó 48 horas después de su ingreso hospitalario datos como anosmia y disgeusia permitieron orientar al diagnóstico de COVID-19. Aun así, 50 personas del área de la salud tuvieron contacto con el paciente antes del diagnóstico de la COVID-19, resultando 11 casos positivos. Este ESD se reconoce como la causa más común de la superdiseminación de un agente infeccioso en un brote, epidemia o pandemia (20,21). 2. Otro ESD descrito es la transferencia interhospitalaria. 3. Un último ESD es la transmisión por gotas y aerosoles de la infección, siendo susceptible el personal de salud, en especial cuando se realizan procedimientos generadores de aerosoles sin adecuados elementos de protección (22-25).
Para determinar la capacidad de transmisibilidad de un proceso infeccioso en una población, en epidemiología se realiza el cálculo del número de reproducción básico o R0. Estudios iniciales han estimado el R0 de la COVID-19 en 2,2 (95 % IC, 1,4 a 3,9) (24). Esto quiere decir que una persona con COVID-19 infectará en promedio a 2,2 personas más. Sin embargo, Shen et al. han definido a un SD como aquel paciente que transmite la infección a por lo menos 8 contactos (26). Otros autores evidenciaron en el SARS y MERS-CoV que el 10 % de los pacientes se asociaban con SD con un R0 mayor de 10 (15,27).
Efectivamente, el efecto de los SD hace que la transmisión de la infección sea más rápida y más grave, debido a la alta carga viral presente en ellos podría conllevar a la generación de más SD, tal como fue propuesto por Beldomenico (5,28). Una de las características de los SD es que generan un peak en la curva de casos de forma rápida y temprana en una epidemia o pandemia en un corto periodo de tiempo, debido a un mayor número de contactos y a una mayor tasa de transmisión (27). Por ello, la mayoría de países que sufren pandemias como la actual, establecen estrategias de contención o mitigación para poder tener un efecto sobre la curva, de tal manera que esta se aplane y que el mayor número de casos se presenten lo más tardío o lejano posible, permitiendo una adecuada preparación de los sistemas de salud y evitando su colapso.
El impacto de las estrategias de aislamiento depende de la dinámica de transmisión de la infección. Las estrategias de intervención del aislamiento dirigido sitian a los individuos SD; es decir, estarán aislados y tendrán contacto efectivo solo con individuos infectados sean SD o diseminadores regulares (27). El aislamiento dirigido puede retrasar y aplanar el peak de la curva (28); por lo tanto, ésta sería la estrategia ideal frente a los SD. Sin embargo, una dificultad en establecer dicha estrategia es que los SD suelen identificarse en forma retrospectiva, por lo cual diferentes estrategias masivas han sido establecidas por muchos países durante la pandemia (control fronterizo, restricción aérea, medidas de control de transmisión comunitaria, aislamiento temprano y medidas de control basadas en casos) (29). Detectar tempranamente pacientes con la COVID-19, aislarlos o confinarlos sean SD o diseminadores regulares, hacer rastreo, cuarentena de contactos estrechos, contención de movilidad en zonas epidémicas, usar EPP y el distanciamiento físico, son medidas que disminuirán la probabilidad de generar SD y reducirán la transmisión del SARS-CoV-2 (3,7,28,30).
Al inicio de la pandemia, la ausencia de infección en los trabajadores de la salud sugirió que esta infección era diferente a las del SARS-CoV y MERS-CoV, en donde según datos de la OMS, uno de cada 10 casos eran trabajadores de la salud. Posteriores informes de numerosos trabajadores de la salud infectados en Wuhan indicaron que la infección por COVID-19 no solo se podía transmitir de la manera usual entre humanos, sino que pudo ser el producto de un paciente SD (31), como el que se ilustra en la Figura 2.
Cartagena, así como en muchas ciudades de Colombia y del mundo, carecía de pruebas diagnósticas para la identificación viral de los casos probables de la COVID-19 y, a pesar de que muchas instituciones de salud contaban con comité de prevención y control de infecciones, no se habían implementado medidas de prevención suficientes y eficaces para controlar y prevenir la transmisión del nuevo virus, aislar y tratar los casos sospechosos o probables (32,33). Muchas instituciones hospitalarias no tenían la infraestructura física adecuada para tratar este tipo de pacientes, numerosas áreas tuvieron que ser adaptadas sin cumplir con los requisitos indispensables para la atención, dado el volumen de pacientes que consultaban y, sumado a lo anterior, el personal de salud no tenía entrenamiento en el manejo de estos pacientes ni se contaba con equipos de protección personal suficientes. Por lo cual, los hospitales se convirtieron en un ambiente de alto riesgo para la transmisión del SARS-CoV-2, siendo los trabajadores de la salud la población con el mayor riesgo ocupacional en el mundo (32,33).
Por otro lado, estrategias exitosas de programas estrictos de control de infecciones que han reducido el riesgo de transmisión nosocomial del SARS-CoV-2, se han basado en diferentes guías, como las del CDC (Centers for Diseases Control and Prevention) que incluyen unidades exclusivas de COVID-19 con salas de aislamiento de infecciones transmitidas por gotas o aerosoles, equipos de protección personal para todos los trabajadores de salud, monitores de entrenamiento y vigilancia para orientar el uso de los equipos de protección personal, máscaras faciales de uso universal, restricción de visitantes y pruebas de RT-PCR disponibles para realizar en contactos y personas sintomáticos (34).
Los SD y los ESD están íntimamente relacionados y debido a que la identificación de los SD por lo general se hace en forma retrospectiva, es importante y necesario reconocer aquellos ESD para establecer estrategias tempranas y efectivas para el control de un brote o una pandemia.
Los ESD tienen características similares que debieran obligarnos a identificarlas claramente para evitarlas. Sneppen et al. exploraron un modelo teórico que incluía el fenómeno de los SD para guiar las estrategias a utilizar (34). El modelo consideró los patrones de contacto en tres entornos: hogar, trabajo y una categoría llamada "otros", entornos que representan contactos sociales difusos. Para comparar los resultados de la simulación en cada escenario de mitigación consideraron la utilidad máxima diaria de la UCI. Sus resultados sugieren que limitar los contactos sociales difusos en entornos tales como bares, transporte, restaurantes, fiestas, conciertos y salas de conferencias, es mucho más efectivo que limitar la misma cantidad de eventos de contacto en el hogar y el lugar de trabajo. Concluyeron, entre otras cosas, que incluir estrategias sobre los ESD pueden ayudar a explicar el éxito que han tenido los bloqueos, incluso moderados, como el de Dinamarca. Y señala la necesidad de evitar reuniones masivas hasta que se haya logrado la inmunidad de rebaño o se haya alcanzado una vacunación efectiva (34).
El presente estudio tiene como limitaciones el no haber podido identificar los casos expuestos al primer SD, ni la genotipificación del virus que permitiera realizar la confirmación molecular. Sin embargo, es el primer estudio de vigilancia epidemiológica clínica realizado en la Costa Caribe Colombiana, en el que se incluye al primer paciente fallecido por COVID-19 en Colombia como un SD.
Conclusión
En un periodo de 30 días se determinaron dos pacientes SD, 21 casos secundarios y, hasta el 18 de abril del 2020, solo dos casos terciarios. Los SD juegan un papel importante en la dinámica de transmisión de las enfermedades infecciosas, incluyendo SARS-CoV, MERS-CoV y COVID-19. Los SD y los ESD como el no reconocimiento de la enfermedad, el diagnóstico errado en un paciente, la transferencia interhospitalaria, la transmisión del agente infeccioso por gotas o aerosoles, entre otros, son una de las principales causas de generación de casos secundarios. Por lo anterior, los gobiernos deberían velar por mantener hospitales y clínicas con una adecuada infraestructura hospitalaria, dotados con la mejor tecnología para diagnóstico y tratamiento; además de fortalecer y equipar los programas para el control de infecciones. con el fin de controlar y evitar la diseminación y transmisión de agentes infecciosos como el SARS-CoV-2.