Introducción
La diabetes mellitus (DM) es una enfermedad de alta prevalencia y alto costo en el mundo. Dentro del espectro de las complicaciones microvasculares se destaca la retinopatía diabética (RD), que es una de las principales causas de la discapacidad visual y la principal de la ceguera en los adultos en edad productiva. (1-3). Un tercio de los pacientes con diabetes sufre de RD y, de estos, un tercio ya tiene compromiso de su función visual (4), siendo la principal causa de esta el edema macular diabético (EMD) (5,6).
Según la Academia Americana de Oftalmología, la retinopatía diabética es la tercera causa de la pérdida visual, irreversible, en el mundo, y la primera en países en desarrollo en las personas entre los 16 y 64 años (7,8). En Colombia la prevalencia de la RD es aproximadamente de 20 individuos por cada 100.000 habitantes. Se ha reportado que entre un 9 y 31 % de los pacientes que sufren de DM presentan RD (9). Los departamentos Bogotá, Valle, Norte de Santander, Antioquia y Santander tienen las prevalencias más altas (17-24 por cada 100.000 habitantes). El Valle es el departamento con más casos para el periodo entre 2009 y 2014, con una tasa de 539 por cada 100.000 personas diagnosticadas con diabetes (10).
La RD se puede clasificar, según su gravedad, en retinopatía diabética no proliferativa (RDNP) y retinopatía diabética proliferativa (RDP), cualquiera de estas dos puede complicarse al presentar EMD (11). Se entiende por EMD al engrosamiento de la retina secundario a la acumulación de líquido intrarretiniano, a isquemia o alteraciones de la interfase vitreorretiniana. El EMD se localiza principalmente entre las capas nuclear interna y plexiforme externa, esto debido a una alteración en la barrera hematorretiniana interna (endotelio de los capilares de la retina) (3,8,12). Cuando este engrosamiento logra ser detectado por evaluación clínica es llamado edema macular clínicamente significativo (CSME) (8).
La clasificación clínica de la gravedad del EMD se divide en leve a moderado si tiene algo de engrosamiento o presencia de exudados duros a más de 1 mm de la mácula. y grave en caso de que ya se comprometa el centro de la mácula, es decir, a menos de 1 mm (13). El Early Treatment Diabetic Retinopathy Study (ETDRS) define al CSME como cualquier paciente que cumple con alguno de los siguientes criterios: engrosamiento de la retina a menos de 500 um del centro de la mácula, exudados duros a menos de 500 um del centro de la mácula con engrosamiento de la retina adyacente, o edema de retina con área igual o mayor a 1 DD (diámetro de disco) dentro de 1 DD del centro de la mácula (11).
En el mundo, un 6,8 % de la población diabética tiene EMD (3). En cuanto a la prevalencia en Latinoamérica se encontró lo siguiente: en Costa Rica un 2,6 % (14), en Honduras un 12 % (15), en México un 3-10 % (16) y en Chile, un 3,8 % (17). En Colombia no hay datos de la prevalencia de esta patología dentro de nuestra revisión bibliográfica.
Según el tipo de diabetes, se estima que el 29 % los diabéticos tipo 1 a los 20 años desarrollarán EMD y el 3 % de los diabéticos tipo 2 tendrá EMD a los 5 años y aumentará al 28 % a los 20 años (18,19).
Hay 3 factores principales de riesgo para la aparición de EMD: tiempo de evolución de la diabetes, mal control metabólico y la presencia de hipertensión arterial. Se ha demostrado que controlar estas variables es efectivo para la prevención de esta patología (20).
Para el diagnóstico, clasificación, control y evaluación de la respuesta a los posibles tratamientos se disponen de diferentes imágenes diagnósticas, una de las más importantes por su sensibilidad es la tomografía óptica de coherencia (OCT) (13).
Identificar estos individuos tiene gran importancia, por ser esta la principal causa de disminución crónica de la agudeza visual en los pacientes diabéticos. Esto con el fin de lograr el diagnóstico temprano con el consecuente tratamiento, lo cual impactará en la calidad visual (21). Esta investigación muestra las características clínicas, los hallazgos del examen oftalmológico y en la OCT en pacientes diabéticos que asistieron a un programa de tamización de retinopatía diabética en Medellín (Colombia), que fueron diagnosticados con EMD clínico. Este es el primer estudio sobre la presencia EMD en una población colombiana.
Métodos
Se desarrolló un estudio de corte transversal de tipo bidireccional, donde se usaron tanto datos históricos como prospectivos para establecer la prevalencia de RD y EMD, con el fin de profundizar en las características de los pacientes con EMD de una población atendida y encuestada en la jornada “No más ciegos por diabetes” del Hospital San Vicente Fundación, entre el 2017 y 2018 en Medellín (Colombia). Se incluyeron los pacientes con examen clínico positivo para EMD de todas las edades y sexo, con datos completos en las encuestas realizadas con las variables a estudiar: sexo, tipo de DM, control glicémico evaluado con último HbA1C en porcentaje, tiempo de evolución de la diabetes en años, tipo de tratamiento (insulina, hipoglicemiantes o dieta), tratamiento previo para la retinopatía, complicaciones como neuropatía periférica, pie diabético o nefropatía diabética, presencia de retinopatía diabética con su gravedad y de otras comorbilidades como la dislipidemia, enfermedad coronaria o hipertensión arterial (HTA).
No se calculó el tamaño de la muestra, ya que se incluyó el total de los pacientes evaluados en el programa (1.203). Se utilizaron fuentes de información secundaria: datos recolectados en las encuestas de la jornada “No más ciegos por diabetes” del Hospital San Vicente Fundación y resultados de la evaluación por oftalmoscopia indirecta y OCT (Topcon® OCT-2000).
Jornada “No más ciegos por diabetes”
Desde hace 20 años en el Hospital Universitario San Vicente Fundación se viene realizando un evento anual y gratuito alrededor del día 14 de noviembre, Día mundial de la Diabetes Mellitus, durante una jornada de 8 a.m. a 3 p.m. En este evento, especialistas en retina, oftalmólogos generales y residentes de las tres facultades de Medellín: Universidad de Antioquia, CES y Universidad Pontificia Bolivariana realizan una evaluación de la retina a pacientes con diagnóstico de DM. Esto lo hacen usando oftalmoscopia indirecta con lentes de 78 dioptrías (D) y 90 D o con lente de 20 D, para determinar clínicamente si tienen RD y clasificar si además existe EMD clínico, para posteriormente elaborar un plan de manejo a seguir dependiendo de la condición encontrada.
A los pacientes con EMD diagnosticado por clínica, se les convocó en los siguientes 6 meses de la última tamización a una segunda revisión clínica y por OCT (Topcon® OCT-2000) para confirmar el diagnóstico. Posterior al examen, se clasificó la gravedad del EMD según la Escala Internacional Clínica de Severidad del EMD (9). Se tomaron los grosores maculares centrales a través del OCT y se exploraron mediante un análisis bivariado entre los grosores maculares centrales (> 265 micras) y la presencia o no de EMD.
Plan de análisis de la información
Los datos se analizaron en el programa SPSS, versión 21. Para la descripción de las características demográficas y clínicas de los pacientes, se realizó un análisis bivariado en el que se compararon pacientes diabéticos con y sin RD y aparte, en los pacientes con RD se buscaron diferencias entre los que tenían EMD y los que no. Se reportaron frecuencias absolutas y relativas para las variables cualitativas junto con los valores p. Se consideró significancia estadística un valor de p < 0,05. Para las variables cuantitativas como la edad, tiempo de evolución de la diabetes, niveles de HbA1c y grosores maculares se utilizó la prueba U de Mann-Whitney y se probó el supuesto de normalidad con la prueba de Kolmogorov-Smirnov; debido a que no se siguió una distribución cercana a la normal (p < 0,05) se describen las medianas y rangos intercuartiles. Para las variables categóricas se utilizó la prueba de Chi cuadrado de Pearson: sexo, tipo de diabetes, tipo de terapia, presencia de dislipidemia, HTA, nefropatía diabética, enfermedad coronaria, pie o neuropatía diabéticos.
Se calculó la prevalencia de RD y de EMD en la población del estudio dividiendo el número de pacientes para cada condición sobre el total de la población multiplicado por 100.
El estudio fue aprobado por el Comité de Ética de la Investigación del Hospital San Vicente Fundación: Acta No. 33-2019.
Resultados
Del total de pacientes con diabetes mellitus evaluados (1.203), 219 tenían RD y 65 EMD clínico, con prevalencia del 18,2 % y 5,4 %, respectivamente.
La mediana de la edad del grupo de los pacientes con RD fue de 63 años (rango intercuartílico [RIQ] 55-68), el 65 % fueron mujeres, el 47 % de los pacientes estaban en tratamiento con insulina mientras que el otro 53 % recibían terapia con hipoglicemiantes orales y dieta. El tiempo de evolución de la diabetes tuvo una mediana de 15 años (RIQ 10-25), siendo significativamente mayor al compararla con los que no tenían RD (10 años, RIQ 4-16, p = <0,001). La media de HbA1c fue de 7,8 (RIQ 7-9), mientras que en los pacientes sin RD fue de 7,2 (RIQ 6,5-8,2; p=<0,001). La dislipidemia y la HTA fueron las comorbilidades más frecuentes en este grupo, con frecuencias de 61,2 % y 67,1 %, respectivamente (Tabla 1).
Tabla 1 Análisis bivariado de variables entre pacientes diabéticos con y sin retinopatía diabética
| Variable | Retinopatía diabética | Valor p ‡ | |
|---|---|---|---|
| Si n = 219 (%) | No n = 984 (%) | ||
| Edad (años) Mediana (RIQ)* | 63 (55-68) | 63 (55-68) | 0,2 |
| Sexo | |||
| Masculino | 76 (34,7) | 350 (35,6) | 0,8 |
| Femenino | 143 (65,3) | 634 (64,4) | |
| Tipo de diabetes | |||
| Tipo 1 | 20 (9,1) | 109 (11,1) | 0,2 |
| Tipo 2 | 193 (88,1) | 863 (87,7) | |
| Terapia | |||
| Con insulina | 103 (47) | 481 (48,9) | 0,6 |
| Sin insulina | 116 (53) | 503 (51,1) | |
| Tiempo de diabetes (años), Mediana RIQ) * | 15 (10-25) | 10 (4-16) | < 0,001 |
| HbA1c†, Mediana (RIQ)* | 7,8 (7-9) | 7,16 (6,5-8,2) | < 0,001 |
| Dislipidemia | |||
| Sí | 134 (61,2) | 588 (59,8) | 0,7 |
| No | 85 (38,8) | 396 (40,2) | |
| Hipertensión arterial | |||
| Sí | 147 (67,1) | 605 (61,5) | 0,1 |
| No | 72 (32,9) | 379 (38,5) | |
| Nefropatía diabética | |||
| Sí | 31 (14,2) | 62 (6,3) | < 0,001 |
| No | 188 (85,8) | 922 (93,7) | |
| Enfermedad coronaria | |||
| Sí | 23 (10,5) | 44 (4,5) | < 0,001 |
| No | 196 (89,5) | 940 (95,5) | |
| Pie diabético | |||
| Sí | 15 (6,8) | 15 (1,5) | < 0,001 |
| No | 204 (93,2) | 969 (98,5) | |
| Neuropatía diabética | |||
| Sí | 16 (7,3) | 61 (6,2) | 0,6 |
| No | 203 (92,7) | 923 (93,8) |
* Rango intercuartil. † Hemoglobina glicosilada. ‡ Significativo < 0,05. Fuente: creación propia
Para el grupo de pacientes con EMD se encontró que la mediana de edad fue de 63,5 años (RIQ x). El 64,6 % fueron mujeres y el 89,2 % sufrían de DM2. Un 46,2 % estaba en tratamiento con insulina, mientras que el otro 53,8 % recibía hipoglicemiantes orales y dieta. Las comorbilidades más frecuentes fueron la dislipidemia y HTA, con frecuencias de 70,8 % y 73,8 %, respectivamente. La complicación de la DM más frecuente fue la nefropatía diabética (16,9 %), seguida por la enfermedad coronaria y la neuropatía diabética (9,2 %), por último, estaba el pie diabético en un 4,6 % de los pacientes (Tabla 2).
Tabla 2 Análisis bivariado de variables entre pacientes con retinopatía diabética con y sin edema macular diabético
| Variable | Edema macular diabético | Valor p ‡ | |
|---|---|---|---|
| Sí n = 65 (%) | No n = 154 (%) | ||
| Edad (años) Mediana (RIQ)* | 63,5 (56-69,8) | 62 (53-69) | 0,4 |
| Sexo | |||
| Masculino | 23 (35,4) | 62 (40,3) | 0,5 |
| Femenino | 42 (64,6) | 92 (59,7) | |
| Tipo de diabetes | |||
| Tipo 1 | 5 (7,7) | 21 (13,6) | 0,3 |
| Tipo 2 | 58 (89,2) | 131 (85,1) | |
| Terapia | |||
| Con insulina | 30 (46,2) | 63 (40,9) | 0,5 |
| Sin insulina | 35 (53,8) | 91 (59,1) | |
| Tiempo de diabetes (años) Mediana (RIQ)* | 14 (7-19,5) | 17 (10-25,3) | 0,009 |
| HbA1c†, mediana (RIQ)* | 8,3 (7,1-11) | 7,6 (6,9-8,5) | 0,011 |
| Dislipidemia | |||
| Sí | 46 (70,8) | 88 (57,1) | 0,1 |
| No | 19 (29,2) | 66 (42,9) | |
| Hipertensión arterial | |||
| Sí | 48 (73,8) | 99 (64,3) | 0,2 |
| No | 17 (26,2) | 55 (35,7) | |
| Nefropatía diabética | |||
| Sí | 11 (16,9) | 20 (13) | 0,5 |
| No | 54 (83,1) | 134 (87) | |
| Enfermedad coronaria | |||
| Sí | 6 (9,2) | 17 (11) | 0,7 |
| No | 59 (90,8) | 137 (89) | |
| Pie diabético | |||
| Sí | 3 (4,6) | 12 (7,8) | 0,4 |
| No | 62 (95,4) | 142 (92,2) | |
| Neuropatía diabética | |||
| Sí | 6 (9,2) | 10 (6,5) | 0,5 |
| No | 59 (90,8) | 144 (93,5) |
* Rango intercuartil. † Hemoglobina glicosilada. ‡ Significativo < 0,05. Fuente: creación propia
Encontramos que el 10,8 % (7) tenía RDP y el 73,8 % RDNP (48), de los cuales, el 24,6 % (16) correspondía a RDNP leve; 30,7 % (20) moderada y, 18,5 % (12) grave. El otro 15,4 % (10) no fue registrado (Tabla 3). En un 93,8 % (61) de los casos se hizo un diagnóstico de novo de EMD.
Tabla 3 Diagnóstico y clasificación de la retinopatía diabética por oftalmoscopia
| Diagnóstico | n | % |
|---|---|---|
| RDP* | 7 | 10,8 |
| RDNP† | 48 | 73,8 |
| Leve | 16 | 24,6 |
| Moderada | 20 | 30,7 |
| Grave | 12 | 18,5 |
| No clasificados | 10 | 15,4 |
* RDP: retinopatía diabética proliferativa. † RDNP: retinopatía diabética no proliferativa. Fuente: creación propia
Asistieron a la segunda convocatoria 28 pacientes (43,1 %, 56 ojos) para una nueva valoración clínica y realización de OCT. De estos, 24 tenían EMD confirmado por OCT (85,7 %); a una paciente no fue posible realizarle el OCT por catarata madura en el ojo derecho y dificultad a lograr dilatación en el ojo izquierdo. Tres pacientes (10,7 %) no tenían EMD por OCT y en un ojo de uno de ellos no fue posible obtener una buena calidad de OCT por opacidad de los medios. En total se obtuvieron fotos de fondo de ojo y se clasificaron 41 ojos positivos para EMD, entre los cuales 18 (43,9 %) eran graves y 23 (56,1 %) leve-moderados. En cuanto al grosor macular, en los 5 ojos sin edema macular la mediana fue de 267 micras (RIQ: 250-320), mientras que en los pacientes con presencia de edema macular la mediana del grosor fue de 249 micras (RIQ: 229-337; n = 48); no se encontraron diferencias estadísticas en el grosor macular entre los pacientes con edema y sin edema macular (p > 0,05).
Discusión
Este es el primer trabajo publicado en Colombia que describe los hallazgos epidemiológicos relevantes sobre el EMD en una población correspondiente al departamento de Antioquia. Esto gracias a la realización de la jornada “No más ciegos por Diabetes” del Hospital San Vicente Fundación de Medellín, que ha acogido por más de 20 años a alrededor de 13.000 pacientes (600 anuales).
Al comparar la prevalencia de RD en nuestra población diabética (18,2 %) con lo reportado en el mundo (34,6 %) (3) o incluso con reportes latinoamericanos (31,6 %) (22), encontramos que esta es menor, probablemente por el subregistro y las dificultades que presentan muchos de nuestros pacientes a la hora de acceder a los servicios de salud, especialmente los que están alejados de las grandes ciudades. Ahora bien, al hacer la comparación con la literatura colombiana, notamos que está dentro del rango de lo reportado en otros estudios, de 9 % (23) a 31 % (24).
Por otro lado, la prevalencia de EMD en nuestra población (5,4 %) se acerca más a lo reportado en el mundo (6,8 %) (3). Respecto a los países latinoamericanos que la han reportado, se encontró que es más baja que en Honduras y México (15,25), pero es más alta que las reportadas en Costa Rica y Chile (14,17). Este contraste puede ser explicado por los diferentes sistemas de salud de cada país relacionado con la cobertura global en salud, especialmente en poblaciones rurales o marginales. Adicionalmente, la existencia de programas estructurados de promoción y prevención que se realicen en conjunto con médicos generales, internistas, optómetras, oftalmólogos, o programas con tamización digital por medio de fotografías de fondo de ojo usando telemedicina enfocados en RD y EMD.
Dentro de las variables estudiadas, al comparar los pacientes diabéticos con y sin RD (incluyendo los pacientes con EMD), se encontró que los que tenían RD presentan un mayor tiempo de evolución de la DM, HbA1C más elevada y mayor prevalencia de las complicaciones de la DM como la nefropatía diabética, infarto agudo de miocardio (IAM) o pie diabético; todas con significado estadística (p < 0,05) (Tabla 1). Mientras que la neuropatía diabética y las comorbilidades como HTA o la dislipidemia no fueron significativamente distintas entre ambos grupos (Tabla 1).
Dentro del grupo de los pacientes con RD, llamativamente encontramos que aquellos con EMD presentan un menor tiempo de evolución de la DM respecto al otro (pacientes con RD sin EMD), lo cual concuerda con lo reportado en la literatura. Esto puede ser explicado porque no es el único factor implicado; el mal control metabólico también contribuye con el desarrollo de esta complicación y en este estudio, vemos que los pacientes con EMD presentan un pobre control metabólico evidenciado por los altos niveles de HbA1c (p < 0,05). La dislipidemia parece estar con mayor frecuencia en los pacientes con EMD, pero cabe resaltar que no logra significado estadístico (p = 0,059). En las otras variables no se encontraron diferencias significativas (20,26).
La mayoría de los pacientes con EMD en la población estudiada correspondía a pacientes con DM tipo 2 y cursaba con retinopatía diabética no proliferativa, principalmente en los grupos de RDNP leve y moderada, y en menor medida en los grupos de RDNP severa y RDP. Llamativamente en la población del estudio la mayoría de los pacientes con EMD fueron mujeres, diferente a lo reportado en la literatura (20), en la cual presentan al sexo masculino como factor de riesgo para el desarrollo de esta complicación; esto quizás se deba a que la mayoría de los pacientes consultantes fueron mujeres, lo cual aumenta el riesgo de sesgo de selección.
La mayor parte de los pacientes estudiados tenía como comorbilidades la dislipidemia y la hipertensión arterial, similar a lo reportado en la literatura internacional (26,27).
La OCT no pudo realizarse en la totalidad de los pacientes positivos para EMD debido a la imposibilidad para contactarlos o porque no hubo aceptación de la convocatoria por problemas de traslado en la gran parte de los casos. Se encontró que la mayoría de los pacientes que asistieron a realizarse este examen fueron positivos para EMD por OCT. Sin embargo, el periodo de tiempo entre el examen clínico y el realizado por OCT no se hizo de manera sincrónica, sino que entre la primera fundoscopia y la segunda valoración para la realización de la OCT pasaron entre 0 y 6 meses, y en el transcurso de este tiempo pudo alterarse su condición. Pese a ello, de los pacientes que asistieron la gran mayoría no habían recibido seguimiento o tratamiento por su entidad de salud, a pesar de realizarles el diagnóstico clínico y la remisión oportuna en el programa de tamización.
Dentro de los 3 pacientes que no se les encontró EMD por OCT, se asume que la presencia de drusas perimaculares pudo haber sido confundida por exudados duros del EMD (Figura 1); para diferenciar estas dos entidades es muy útil analizar la OCT, en la cual podemos ver que los exudados duros están localizados de forma intraretinal, mientras que las drusas se encuentran en el epitelio pigmentario. Además, se les realizó una nueva fundoscopia por un especialista de retina y se encontró que el brillo de la limitante interna pudo ser otro factor de confusión en el examen clínico del tamizaje, especialmente en los pacientes más jóvenes.
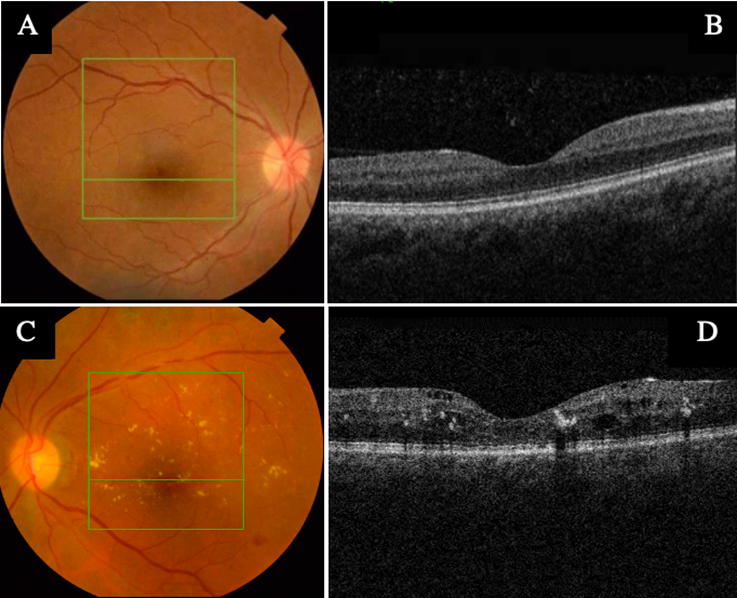
Figura 1 Imágenes por tomografía de coherencia óptica (OCT). Comparativas entre (A, B) donde se identifican drusas perimaculares y, (C, D), donde se evidencian exudados duros maculares. Fuente: tomadas de las historias clínicas de los pacientes con autorización
En cuanto a los grosores maculares centrales, se encontró que los pacientes con presencia de EMD tenían grosores similares respecto a los pacientes sin EMD; esto puede ser explicado por la presencia de EMD leve-moderado. A pesar de que la mayoría de los reportes de las lecturas de OCT expresan solo los grosores centrales, es importante que tanto el médico que realiza la interpretación como el médico tratante verifiquen el resto de la mácula y los grosores externos al centro de esta para determinar la presencia o no de EMD, ya que aún con un edema importante, los grosores centrales pueden observarse normales en aquellos clasificados como leve-moderado, como se encontró en el presente estudio.
Dentro de las limitaciones se identifica que la muestra no fue aleatoria, sino por conveniencia, esto genera un sesgo de selección. Toda la información, exceptuando los datos obtenidos en la evaluación por OCT, provinieron de fuentes secundarias (encuesta realizada al momento de la tamización inicial); no todos los pacientes tuvieron una valoración por OCT y en los que la tuvieron, esta no fue realizada en el momento del examen inicial en la tamización de la jornada “No más ciegos por diabetes”, sino posteriormente, y pudieron haber recibido algún tratamiento o cambiado su control metabólico en este lapso. Adicionalmente, la valoración del EMD en el examen clínico se pudo ver afectada por la subjetividad del examinador y en el caso de la jornada “No más ciegos por diabetes”, son múltiples los evaluadores.
El presente estudio presenta una validez interna adecuada. Por otro lado, debido a las características de la población incluida en este y a las limitaciones mencionadas, los resultados solo se pueden extrapolar completamente a la población de pacientes diabéticos que han asistido a la jornada “No más ciegos por Diabetes”. Este es uno de los pocos estudios acerca de RD que ha incluido un gran número de individuos. Es el primero en describir la prevalencia y las características epidemiológicas del EMD a nivel nacional, lo cual nos permite mejorar el entendimiento de dichas patologías. Incluso así, se requieren de estudios epidemiológicos con diseños más robustos para implementar estrategias de prevención, diagnóstico, atención y rehabilitación para retinopatía diabética y edema macular diabético.














