Introducción
La cardiotoxicidad inducida por citarabina es un efecto adverso poco conocido del cual sólo hay algunos reportes de caso. La cardiomiopatía por estrés (Takotsoubo) y la pericarditis son las formas más comunes de presentación. Algunos reportes describen compromiso miocárdico, especialmente en combinación con antraciclinas o ciclofosfamida (1-3). Se presenta el caso clínico de un paciente que desarrolló miopericarditis por citarabina como consecuencia del tratamiento quimioterapéutico para leucemia mieloide aguda (LMA).
Presentación del caso
Paciente masculino de 51 años con historia personal de hipertensión arterial (HTA), con diagnostico en el año 2020 de LMA con riesgo citogenético intermedio, por lo que se inició manejo con quimioterapia de inducción con el esquema 7+3 con citarabina-idarrubicina (Citarabina 400 mg cada 24 horas por 7 días e idarrubicina 24 mg cada 24 horas por 3 días) y 3 ciclos de terapia de consolidación con dosis altas de citarabina (Citarabina 5 460 mg intravenosos cada 12 horas los días 1, 3 y 5). Dos semanas posteriores al último ciclo de quimioterapia de consolidación, el paciente consultó por síndrome febril agudo e inestabilidad hemodinámica, el cual fue considerado como choque séptico asociado a neutropenia febril por lo que recibió antibioticoterapia de amplio espectro y soporte vasopresor. Durante la vigilancia en la unidad de cuidados especiales, el paciente refirió dolor torácico intenso, por lo que se realizó un electrocardiograma (ECG) que evidenció elevación difusa del segmento ST en las derivadas DI, DII, aVL, V4, V5, V6 con infradesnivel del ST en V1 y aVR asociado a signo de Spodick, además signos de injuria miocárdica por niveles elevados de troponina I de alta sensibilidad (47 653 ng/L -valor de ref 26,2 ng/L-). Se llevó a coronariografía en la que no se evidenciaron lesiones angiográficamente significativas. Su estado clínico evolucionó a falla orgánica multisistemica con choque séptico y cardiogénico, por lo que se trasladó a cuidados intensivos. La ecocardiografía transtorácica demostró compromiso grave de la fracción de eyección del ventrículo izquierdo (FEVI) del 25 %, dilatación del ventrículo izquierdo, compromiso difuso de la contractilidad y derrame pericárdico leve de 10 mm (Figura 1).
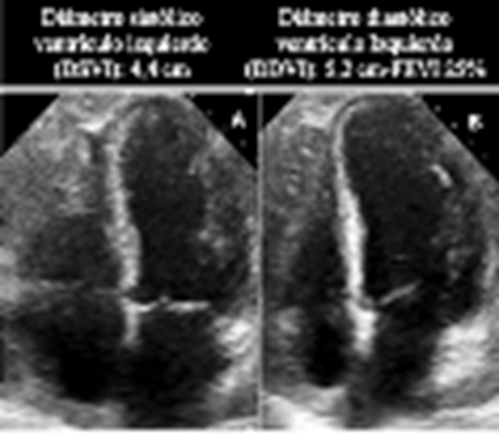
Fuente: Ecocardiografía de caso índice, archivo radiología. Reproducido con autorización
Figura 1: Ecocardiografía transtorácica (4AC) se observa dilatación del ventrículo izquierdo en sístole (A) y en diástole (B), leve derrame pericárdico y disminución de la fracción de eyección.
Dado el debut con dolor torácico y el ECG con elevación del ST y signos de pericarditis, sumado a la elevación de biomarcadores, alteraciones de contractilidad y compromiso grave de la FEVI, se sospechó miopericarditis, por lo que se realizó una resonancia magnética simple y contrastada de corazón que reportó edema, hiperemia y realce tardío difuso de distribución no isquémica en las paredes anterior, lateral e inferior (criterios Lake Louise 3/3) del ventrículo izquierdo, además de compromiso del pericardio con engrosamiento y realce basal inferior y derrame pericárdico leve (Figura 2); confirmando así, el diagnóstico de miopericarditis aguda. Se inició manejo con antiinflamatorio no esteroideo (AINE) - Ibuprofeno 400 mg cada 8 horas- y colchicina 0,5 mg/24 horas, para controlar la inflamación y disminuir el riesgo de recurrencias del compromiso pericárdico; además, se inició manejo cardioprotector con enalapril 2,5 mg cada 24 horas y carvedilol 3,125 mg cada 12 horas. Luego de 30 días de hospitalización y previo al egreso, se demostró resolución completa de las alteraciones de la contractilidad y mejoría de la FEVI a 59 %, atribuida al manejo de soporte, suspensión de la quimioterapia, a la resolución de la inflamación sistémica y miocárdica, la suspensión de la ventilación mecánica y el manejo instaurado. Fue dado de alta con los medicamentos anotados previamente y se dejó mínimo 3 meses la colchicina, pues luego de discutir con el grupo de hematología se concluyó que era alta la posibilidad de requerir dosis altas de citarabina en el manejo oncológico ulterior.
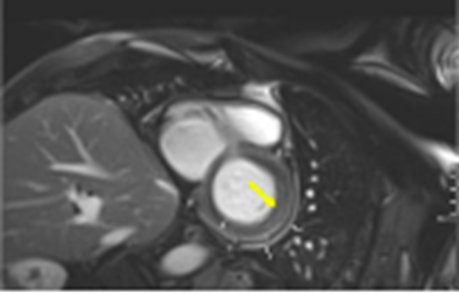
Reproducido con autorización
Figura 2: Resonancia magnética de corazón contrastada. Se evidencia inflamación del pericardio parietal y visceral (flechas blancas) y realce tardío de predominio epicárdico en la pared lateral del ventrículo izquierdo (flecha amarilla). Fuente: Resonancia de caso índice, archivo de radiología.
Para la publicación de este caso se protegió la identidad del paciente, no se realizaron intervenciones experimentales que pusieran en riesgo su integridad, se obtuvo consentimiento verbal para la publicación de este manuscrito y se obtuvo el aval del Comité de Investigaciones y Ética en Investigaciones de la institución.
Discusión
La citarabina se considera un medicamento de gran importancia en el tratamiento de la LMA. Es un análogo de la desoxicitidina que funciona como antimetabolito de la fase S del ciclo (4).
En pacientes menores de 60 años con LMA el tratamiento antitumoral se divide en dos fases: inducción y consolidación. La inducción es la etapa encargada de destruir la mayoría de las células leucémicas y a menudo se incluye el tratamiento con citarabina y una antraciclina en un régimen denominado 7+3 (Citarabina por 7 días y citarabina en los primeros 3 días). En cuanto a la fase de consolidación su objetivo es eliminar el resto de los remanentes celulares leucémicos y evitar la recaída; una de las opciones más utilizadas son dosis altas de citarabina que se administra por 5 días cada 4 semanas en un total de 3 o 4 ciclos. Otras opciones de tratamiento son el alotrasplante o autotrasplante de células madre (trasplante autólogo) (5).
La cardiotoxicidad por quimioterapéuticos es una afección poco reconocida que tiene mayor relación con el uso de antraciclinas (Doxorrubicina, epirrubicina, daunorrubicina e idarrubicina), ciclofosfamida y el trastuzumab, mientras que el riesgo es moderado o bajo con medicamentos tales como el docetaxel, pertuzumab, sunitinib, sorafenib, bevacizumab, dasatinib e imatinib (6).
La citarabina no es un fármaco relacionado frecuentemente con cardiotoxicidad y solo hay algunos reportes de casos de Síndrome de Takotsubo y miopericarditis, en donde se reporta uso entre 100 a 200 mg/m2 en infusión continua por una semana o incluso 200 mg día por una semana (dosis más baja que la suministrada al paciente en este caso) (4-9). Sin embargo, en ninguno de estos casos se reportan secuelas directamente relacionadas con el uso de este fármaco y su manejo ha sido con terapias sintomáticas con metilprednisolona, furosemida y AINE, con una mejoría en días a semanas) (2,3,7-11).
En la actualidad, se estima que el 5-6 % de los pacientes tratados con quimioterapéuticos potencialmente cardiotóxicos sufren insuficiencia cardiaca o fallecen por causas cardiovasculares (12), por lo que se ha recomendado realizar una valoración multimodal para detectar el riesgo potencial de complicaciones cardiovasculares en los pacientes sometidos a quimioterapia. Dicha valoración debe considerar los factores de riesgo del paciente como comorbilidades, edad y sexo, y el riesgo intrínseco de complicaciones cardiovasculares de los medicamentos quimioterapéuticos. Según el riesgo, se define la frecuencia en el seguimiento de ayudas diagnósticas como electrocardiograma, ecocardiografía transtorácica para evaluar la fracción de eyección y la deformación longitudinal global (strain), y biomarcadores como troponina de alta sensibilidad o propéptido natriurético cerebral N-terminal (NT-proBNP) (13).
El cuadro clínico no es significativamente diferente a la miopericarditis viral (etiología más común), por lo que debe ser sospechada al desarrollar síntomas tales como dolor torácico (usualmente de características pleuríticas), alteraciones electrocardiográficas características (elevación difusa del segmento ST) e injuria miocárdica evidenciada por niveles altos de troponinas y alteraciones de contractilidad en pruebas de imagen (14). El compromiso ventricular difuso más que segmentario hace que el diagnóstico de miocardiopatía por estrés (Takotsubo) sea menos probable en este caso, a diferencia de lo reportado previamente en la literatura (15). Los hallazgos ecocardiográficos pueden o no estar presentes en la cardiotoxicidad por antraciclinas, pues la determinación de la FEVI plantea dificultades en relación con la calidad de la imagen, las presunciones sobre la geometría del ventrículo izquierdo, la dependencia de la carga, la pericia en la técnica y la variabilidad inter-observador. Es útil que dicho estudio vaya acompañado de deformación longitudinal del miocardio (strain), parámetro estudiado para la identificación de cardiotoxicidad en fase preclínica (16). Sin embargo, el estudio diagnóstico de elección es la resonancia magnética cardíaca simple y contrastada, que permite una evaluación tisular detallada con una visión completa de la morfología del corazón, pericardio, grandes vasos y estructuras adyacentes; por lo que se considera el estándar de oro para la evaluación de la FEVI, pero su disponibilidad es limitada y su costo es alto (17,18).
Finalmente, debido a la necesidad de continuar con el manejo quimioterapéutico por la enfermedad de base y el riesgo de recidiva del compromiso pericárdico y miocárdico, se requiere una discusión interdisciplinaria e instauración del tratamiento cardioprotector (inhibidores de la enzima convertidora de angiotensina y beta bloqueadores), además de brindar manejo específico para las condiciones presentes (19).
En nuestro caso, la relación temporal de la aplicación del medicamento con el inicio de los síntomas, el hecho de haber descartado enfermedad coronaria aguda, inicio del cuadro con evidencia de compromiso pericárdico y no haber documentado otra causa posible del compromiso miocárdico, soportan el diagnostico de miopericarditis.
Conclusión
La cardio-oncología es una disciplina creciente y conocer los efectos cardiovasculares de los antineoplásicos concierne cada vez más a los cardiólogos y la comunidad médica en general. La citarabina es considerada un medicamento de gran importancia en el tratamiento de la LMA. El compromiso cardíaco se ha descrito previamente causando cardiomiopatía de estrés y pericarditis, en algunos casos con compromiso miocárdico, con una incidencia hasta ahora descrita cerca del 5-6 %, pero con posibilidad de subregistro. El caso presentado discute la presentación clínica, la relación tiempo- aplicación y una estrategia diagnóstica para pacientes con altas dosis de citarabina y compromiso pericárdico y miocárdico.














