Introducción
La trombosis venosa profunda (TVP) es una condición que hace parte del espectro de la enfermedad tromboembólica venosa (ETV), junto con la embolia pulmonar (EP) (1). La TVP se define como la “aparición de un trombo en una vena de la red vascular” (1,2). Es una enfermedad común que afecta principalmente el sistema venoso profundo de los miembros inferiores (1). Su verdadera incidencia es desconocida, pero se calcula que el riesgo estimado de ETV es de 100/100.000 casos al año, generando una incidencia anual de 0,1 % en Estados Unidos (3); sin embargo, se ha reportado una incidencia de TVP que varía entre 48/100.000 y 160/100.000 casos al año (1,2). En Colombia no se cuenta con un registro claro de los datos epidemiológicos sobre TVP. Aun así, en un estudio realizado en 1996 se encontró una prevalencia de ETV cercana al 7 % (4).
Por otro lado, se ha debatido la práctica de la realización de ecografía Doppler venosa a todo paciente con sospecha de TVP, pues de ser normal, no descartaría este diagnóstico y requeriría una confirmación a la semana siguiente, lo que pone en duda el costo efectividad de esta conducta (2).
Así pues, con el tiempo se contempló la necesidad de desarrollar escalas de predicción clínica para evaluar la probabilidad de presentar TVP y no verse en la necesidad de realizar ecografía Doppler venosa a todo paciente con sospecha clínica de TVP (2). Las escalas de predicción clínica son herramientas que combinan múltiples variables con el fin de estimar la probabilidad de que una enfermedad esté presente o que pueda presentarse. Además, son desarrolladas en una población específica, lo que hace necesaria su validación en diferentes grupos poblacionales (1,2). Existen diferentes escalas de predicción diagnóstica para TVP, la más conocida y validada es la escala de Wells: su cálculo se basa en una relación entre la anamnesis y el examen físico, permitiendo deducir una probabilidad alta, moderada y baja para TVP en el Wells tradicional, o un resultado probable o poco probable para el Wells modificado. Además, ambas están validadas, tanto en pacientes ambulatorios como en hospitalizados (2,5). Se disponen de otras escalas como la Oudega, que incluye dentro de sus variables el valor del dímero D y clasifica a los pacientes en cuatro categorías de probabilidad: muy baja, baja, moderada y alta. Está validada en pacientes ambulatorios atendidos en centros de atención primaria (6), (CEBI) Center for Evidence-Base Imaging Score, que utiliza variables clínicas y clasifica el riesgo en bajo y alto; está validada solo en pacientes hospitalizados (7). Por último, está la escala de Constans, que combina 6 variables clínicas y clasifica a los pacientes en bajo, medio y alto riesgo. Se encuentra validada en pacientes ambulatorios y hospitalizados (8). En los estudios de validación, la escala de Wells y Constans presentan un rendimiento similar, mientras que la escala CEBI presenta una mejor sensibilidad en los pacientes hospitalizados que Wells; la escala Oudega es la única validada para ser utilizada en atención primaria (2,5-7). No obstante, la información del rendimiento de cada una de estas escalas es desconocida en nuestro medio y, adicionalmente, considerando que la TVP puede preceder al tromboembolismo pulmonar masivo, e incluso la muerte de los pacientes, se requieren de estudios que evalúen en nuestro medio estas herramientas diagnósticas para dar una mejor información de cuál puede ser la más exacta y así disminuir la probabilidad de error al evaluar un paciente con riesgo de TVP. De igual forma, algunas de estas escalas incluyen en sus variables los resultados de pruebas de laboratorio, las cuales pueden no estar disponibles en centros de baja complejidad, por lo que conocer el rendimiento de las pruebas basadas en variables clínicas podría disminuir la necesidad de toma de exámenes complementarios y, por lo tanto, los costos en la evaluación inicial de estos pacientes.
Por tanto, además de mostrar las características clínicas que pueden diferenciar a los pacientes con esta condición, este estudio busca determinar entre los puntajes de Wells clásico, Wells modificado, Oudega, CEBI y Constans, cuál tiene mejor poder de discriminación para el diagnóstico.
Métodos
Se llevó a cabo un estudio de corte transversal con análisis de prueba diagnóstica en sujetos con sospecha de trombosis venosa profunda, definida de acuerdo con el criterio del médico tratante, en pacientes atendidos en los servicios de urgencias y hospitalización en la Clínica Universidad de la Sabana, centro de atención de tercer nivel ubicado en la sabana de Bogotá, entre agosto del 2009 y enero del 2020. Se incluyeron todos los sujetos mayores de 18 años con realización de ecografía Doppler venosa de miembros inferiores por sospecha de TVP. Se excluyeron sujetos sin información o no localización de la historia clínica por problemas del sistema de información y sujetos con reporte de ecografía no disponible. Para la realización del presente estudio se cuenta con la aprobación por parte del Comité de ética institucional.
Se registraron todas las variables clínicas y paraclínicas necesarias para la construcción de los puntajes de Wells clásico, Wells modificado, Oudega, CEBI y Constans para TVP, siguiendo la recomendación de los autores para la construcción de cada uno de estos puntajes al momento de la sospecha diagnóstica de la TVP (2) (Tabla 1). Se incluyeron como variables la información obtenida en la anamnesis, hallazgos al examen físico, resultado del dímero D, resultado de la ecografía Doppler venosa de miembros inferiores, fecha de ingreso y egreso.
Tabla 1 Variables de las escalas Wells, Wells modificado, Oudega, Constans y CEBI, y su puntaje para trombosis venosa profunda
| Variables | Constans | CEBI | Oudega | Wells | Wells modificado |
|---|---|---|---|---|---|
| Antecedente de TVP | 6 pts | 1 pto | |||
| Cáncer activo (en tratamiento actual o en los últimos 6 meses o en cuidados paliativos) | 1 pto | 1 pto | 1 pto | ||
| Estadía hospitalaria prolongada (≥ 6 meses) | 1 pto | ||||
| Edad ≥ 46 años | 1 pto | ||||
| Género masculino | 1 pto | 1 pto | |||
| Uso de anticonceptivos orales | 1 pto | ||||
| Presencia de malignidad | 1 pto | ||||
| Cirugía reciente (últimas 4 semanas) | 1 pto | ||||
| Ausencia de trauma de miembros inferiores | 1 pto | ||||
| Distensión venosa | 1 pto | ||||
| Diferencia de diámetro de miembro inferior ≥ 3cm | 2 ptos | ||||
| Dímero D anormal (≥500 ng/mL) | 6 ptos | ||||
| Parálisis, paresia o inmovilización reciente de miembros inferiores | 1 pto | 1 pto | |||
| Estancia en cama mayor a 3 días o cirugía mayor, en las últimas 4 semanas | 1 pto | 1 pto | |||
| Sensibilidad localizada a lo largo del trayecto del sistema venoso profundo | 1 pto | 1 pto | |||
| Edema completo de la pierna | 1 pto | 1 pto | |||
| Inflamación de la pantorrilla de más de 3 cm en comparación con la pierna asintomática (medido 10 cm por debajo de la tuberosidad tibial) | 1 pto | 1 pto | |||
| Edema con fóvea (mayor en la pierna sintomática) | 1 pto | 1 pto | |||
| Venas superficiales colaterales (no varicosas) | 1 pto | 1 pto | |||
| Diagnóstico alternativo más probable que TVP | -2 ptos | -2 ptos | -2 ptos | ||
| Parálisis o inmovilización de miembro inferior | 1 pto | ||||
| Estancia en cama mayor a 3 días | 1 pto | ||||
| Edema de miembro inferior | 1 pto | ||||
| Dolor unilateral de miembro inferior | 1 pto |
TVP Trombosis Venosa Profunda. Fuente: creación propia
Para cada uno de los puntajes se calculó de manera numérica y posteriormente se clasificó según la probabilidad: el puntaje de Wells clásico en tres niveles (baja: < 0, moderada: 1-2 y alta: > 3) (5); Wells modificado en dos niveles (poco probable: ≤ 1 y probable: ≥ 2 ) (1); el puntaje de la escala Oudega se clasificó en muy bajo: 0-3, bajo: 4-5, moderado: 7-9 y alto: 1013; la escala de CEBI en bajo: 0 y alto: 1-7; la escala Constans en bajo: ≤ 0, moderado: 1-2, alto: ≥ 3 (2). Los resultados de las escalas se compararon con el diagnóstico o no de TVP, el cual fue determinado de acuerdo con los hallazgos reportados en el Doppler venoso de los miembros inferiores realizado por un radiólogo de la institución.
Con el fin de medir el desenlace de la efectividad de cada una de las cinco escalas para predecir la presencia de TVP, para el cálculo del tamaño muestral se utilizó el área bajo la curva de características operativas del receptor (ACOR); descrita en los estudios originales de cada una de las escalas. Se tomó la prevalencia de la enfermedad tromboembólica descrita para la población colombiana, que es del 7 % (4), un nivel de significación del 95 % (error tipo I 0,05), obteniendo como mínimo 96 pacientes con un ROC de 0,78 para Oudega, 240 pacientes con un ROC de 0,68 para CEBI, 96 pacientes con un ROC de 0,78 para Constans, 112 pacientes con un ROC de 0,76 para Wells clásico y 272 pacientes con un ROC de 0,67 para el Wells modificado. Se ingresaron los sujetos con sospecha clínica de TVP mediante muestreo secuencial hasta completar el número requerido. Se realizó un ajuste por la corrección de Bonferroni para el valor p en la comparación de 5 áreas bajo la curva ROC, con valor p significativo (0,01).
Los datos obtenidos de las historias clínicas fueron recolectados mediante el software de captura de datos electrónicos RedCap, para ser llevados a una hoja de cálculo de Excel y ser analizados con el programa estadístico IBM® SPSS® Statistics 25 y STATA 16.
Se realizó una revisión inicial de los datos por variable para valorar el porcentaje de pérdida de estas, que no debía ser mayor al 20 %. Después, las variables cualitativas se resumieron en frecuencias y porcentajes, las cuantitativas según su distribución, si es normal, en promedio y desviación estándar y, si es no normal, en mediana y rango intercuartílico. Se realizó un análisis bivariado con cada una de las variables estudiadas, las cuantitativas se compararon según su distribución con t de Student o U de Mann-Whitney y las cualitativas con chi Cuadrada. Una vez construidos los puntajes, se elaboró y realizó un análisis del área bajo la curva de las características operativas del receptor (ACOR) del puntaje de cada escala, calculando el intervalo de confianza del 95 % y considerándose una P estadísticamente significativa < 0,05. Se comparó el rendimiento diagnóstico de estas cinco escalas de acuerdo con la población en la que han sido validadas (pacientes ambulatorios u hospitalizados). En la muestra total se aplicaron las escalas de Wells, Wells modificado y Constans. Posteriormente, se dividió la muestra de acuerdo con el tiempo de estancia hospitalaria en hospitalizados mayor de 2 días, en quienes se aplicó adicionalmente la escala de CEBI, y en ambulatorios o estancia menor o igual a 2 días, a quienes además se aplicó la escala de Oudega en los pacientes que contaban con el reporte del Dímero D. El tiempo fue definido por el aumento del riesgo de la enfermedad tromboembólica venosa en pacientes con una estancia hospitalaria superior a 48 horas (9). Para disminuir el riesgo del sesgo de selección diagnóstica, el radiólogo no conocía los resultados de los puntajes obtenidos para el diagnóstico de TVP. Se siguieron las recomendaciones éticas de Helsinki y la resolución 8430 de 1993 para investigación en humanos, así como la reserva y protección de los datos de acuerdo con la ley Habeas Data, considerándose una investigación sin riesgo y con aprobación del Comité de Ética en la Investigación Académica de la Clínica Universidad de La Sabana, el 07 de julio del 2020.
Resultados
Se ingresaron al análisis final un total de 794 pacientes, 399 hospitalizados y 395 ambulatorios; no hubo pérdidas de datos, la prevalencia de TVP en el total de la muestra fue del 49,7 %, siendo del 59 % para los pacientes hospitalizados y del 64 % para aquellos ambulatorios. En la Figura 1 se muestra el flujo de ingreso de los pacientes al estudio. La edad media de los sujetos fue de 60 años. En la Tabla 2 se presentan las características sociodemográficas y los antecedentes de la población en relación con el diagnóstico de TVP, donde se encontró una relación estadísticamente significativa para el sexo masculino (p=0,038), malignidad (p=0,002), cáncer activo en el último año (p <0,001) y antecedente de TVP (p=0,023). En la Tabla 2 se presentan adicionalmente las características clínicas, hallazgos del examen físico, paraclínicos y desenlaces. Se encontró una relación estadísticamente significativa (p <0,05) para los signos clínicos de TVP y el valor de dímero D. En la Tabla 3 se presentan los valores de ROC, con sus intervalos de confianza para las escalas de acuerdo con la población en la que fueron calculadas y el valor p de la comparación
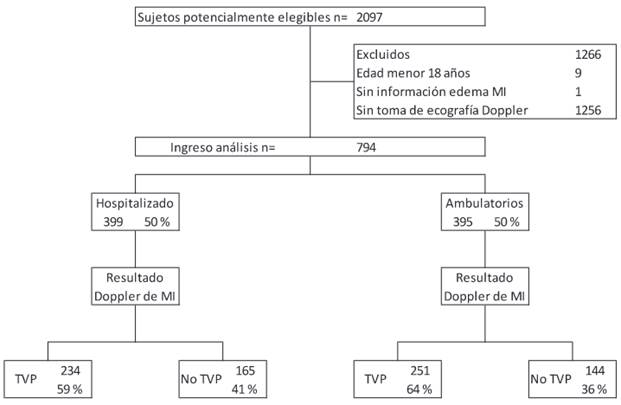
Figura 1 Flujo de ingreso de pacientes al estudio. MI miembro inferior; TVP trombosis venosa profunda: Fuente: creación propia
Tabla 2 Características generales de la población
| Variables | Población total n=794 | TVP n=485 | Sin TVP n=309 | Valor p |
|---|---|---|---|---|
| Edad años media (ds) | 60,3 (19,2) | 60 (19,3) | 60,6 (19) | 0,67 |
| Sexo masculino n (%) | 399 (50,3 %) | 258 (53,2 %) | 141 (45,6 %) | 0,038 |
| Antecedentes n (%) | ||||
| Enfermedad cardiovascular | 95 (12 %) | 42 (8,7 %) | 53 (17,2 %) | <0,001 |
| Infarto agudo de miocardio en los últimos 3 meses | 8 (1 %) | 4 (0,8 %) | 4 (1,3 %) | 0,518 |
| Insuficiencia cardiaca congestiva | 45 (5,7 %) | 23 (4,7 %) | 22 (7,1 %) | 0,158 |
| Hipertensión arterial | 325 (40,9 %) | 179 (36,9 %) | 146 (47,2 %) | 0,004 |
| Fibrilación auricular | 22 (2,8 %) | 9 (1,9 %) | 13 (4,2 %) | 0,049 |
| Enfermedad vascular periférica | 89 (11,2 %) | 46 (5,8 %) | 43 (5,4 %) | 0,054 |
| Enfermedad cerebrovascular | 35 (4,4 %) | 18 (3,7 %) | 17 (5,5 %) | 0,231 |
| Demencia | 21 (2,6 %) | 12 (2,5 %) | 9 (2,9 %) | 0,707 |
| Valvulopatía | 5 (0,6 %) | 2 (0,4 %) | 3 (1 %) | 0,332 |
| Historia de enfermedad pulmonar | 96 (12,1 %) | 50 (10,3 %) | 46 (14,9 %) | 0,054 |
| EPOC | 73 (9,2 %) | 39 (8 %) | 34 (11 %) | 0,159 |
| Asma | 10 (1,3 %) | 4 (0,8 %) | 6 (1,9 %) | 0,169 |
| Fibrosis pulmonar | 2 (0,3 %) | 0 (0 %) | 2 (0 %) | 0,165 |
| Patología del tejido conectivo | 8 (1 %) | 4 (0,8 %) | 4 (1,3 %) | 0,518 |
| Enfermedades autoinmunes | 52 (6,5 %) | 28 (5,8 %) | 24 (7,8 %) | 0,268 |
| Trastorno de la coagulación | 46 (5,8 %) | 30 (6,2 %) | 16 (5,2 %) | 0,553 |
| Diabetes mellitus | 100 (12,6 %) | 56 (11,5 %) | 44 (14,2 %) | 0,265 |
| Diabetes mellitus con lesión orgánica | 10 (1,3 %) | 6 (1,2 %) | 4 (1,3 %) | 0,944 |
| Patología renal | 39 (4,9 %) | 21 (4,3 %) | 18 (5,8 %) | 0,342 |
| Hemiplejia | 10 (1,3 %) | 7 (1,4 %) | 3 (1 %) | 0,561 |
| Obesidad (IMC >30) | 29 (3,7 %) | 14 (2,9 %) | 15 (4,9 %) | 0,15 |
| Embarazo en curso | 8 (1 %) | 4 (0,8 %) | 4 (1,3 %) | 0,07 |
| Inmovilización por más de 3 días | 126 (15,9 %) | 82 (16,9 %) | 44 (14,2 %) | 0,316 |
| Cirugía en las últimas 4 semanas | 105 (13,2 %) | 62 (12,8 %) | 43 (13,9 %) | 0,646 |
| Reemplazo de cadera o rodilla | 23 (2,9 %) | 11 (2,3 %) | 12 (3,9 %) | 0,186 |
| Lesión de la medula espinal | 4 (0,5 %) | 3 (0,6 %) | 1 (0,3 %) | 0,567 |
| Trauma en las últimas 4 semanas | 52 (6,5 %) | 27 (5,6 %) | 25 (8,1 %) | 0,161 |
| Fractura de miembros inferiores en las últimas 4 semanas | 27 (3,4 %) | 13 (2,7 %) | 14 (4,5 %) | 0,161 |
| Antecedente de malignidad | 86 (10,8 %) | 66 (13,6 %) | 20 (6,5 %) | 0,002 |
| Cáncer activo en el último año | 47 (5,9 %) | 39 (8 %) | 8 (2,6 %) | <0,001 |
| Uso de hormonas orales | 8 (1 %) | 3 (0,6 %) | 5 (1,6 %) | 0,005 |
| Antecedente de TVP | 158 (19,9 %) | 109 (22,5 %) | 49 (4,9 %) | 0,023 |
| Antecedente de TEP | 30 (3,8 %) | 15 (3,1 %) | 15 (4,9 %) | 0,204 |
| Sida | 3 (0,4 %) | 1 (0,2 %) | 2 (0,6 %) | 0,323 |
| Sintomatología n (%) | ||||
| Disnea aguda | 202 (25,4 %) | 91 (18,8 %) | 111 (35,9 %) | <0,001 |
| Dolor torácico | 177 (22,3 %) | 80 (16,5 %) | 97 (31,4 %) | <0,001 |
| Hemoptisis | 29 (3,7 %) | 13 (2,7 %) | 16 (5,2 %) | 0,067 |
| Dolor en miembro inferior unilateral | 526 (66,2 %) | 385 (79,4 %) | 141 (45,6 %) | <0,001 |
| Examen Físico n (%) | ||||
| Edema unilateral de miembro inferior | 507 (63,9 %) | 379 (78,1 %) | 128 (41,4 %) | <0,001 |
| Dolor a la palpación | 454 (57,2 %) | 335 (69,1 %) | 119 (38,5 %) | <0,001 |
| Signos de trombosis venosa profunda | 449 (56,5 %) | 361 (74,4 %) | 88 (28,5 %) | <0,001 |
| Venas colaterales no varicosas | 21 (2,6 %) | 18 (3,7 %) | 3 (1 %) | 0,019 |
| Distensión venosa de la extremidad afectada | 37 (4,7 %) | 30 (6,2 %) | 7 (2,3 %) | 0,011 |
| Diferencia de diámetro de los MI >3 cm | 134 (16,9 %) | 106 (21,9 %) | 28 (9,1 %) | <0,001 |
| Signos vitales media (ds) | ||||
| Temperatura | 36 (4,01) | 36 (3,28) | 36 (4,94) | 0,172 |
| Frecuencia cardiaca | 84 (17,16) | 84 (15,46) | 84 (19,55) | 0,761 |
| Presión arterial sistólica | 126 (21,31) | 126 (21,18) | 126 (21,42) | 0,987 |
| Presión arterial diastólica | 75 (14,02) | 75 (13,42) | 74 (14,43) | 0,184 |
| SatO2 | 91 (10,12) | 92 (8,75) | 90 (11,86) | 0,01 |
| FIO2 | 22 (6,55) | 22 (4,84) | 23 (8,52) | 0,029 |
| SaO2/FIO2 | 417 (67,78) | 425 (58,98) | 404 (78,13) | <0,001 |
| Paraclínicos | ||||
| Trombosis venosa superficial n (%) | 125 (15,7 %) | 74 (15,3 %) | 51 (16,5 %) | <0,001 |
| Toma Dímero D n (%) | 181 (22,8 %) | 82 (16,9) | 99 (32 %) | <0,001 |
| Valor Dímero D media (ds) | 4,4 (3,74) | 5,8 (4,03) | 3,3 (3,05) | <0,001 |
| Desenlaces | ||||
| Ventilación mecánica n (%) | 38 (4,8 %) | 18 (3,7 %) | 20 (6,5 %) | 0,076 |
| Ingreso UCI n (%) | 90 (11,3 %) | 43 (8,9 %) | 47 (15,2 %) | 0,006 |
| Mortalidad n (%) | 22 (2,8 %) | 13 (2,7 %) | 9 (2,9 %) | 0,846 |
| Días estancia hospitalización media (ds) | 6 (10,55) | 6,07 (10,33) | 7,01 (10,89) | 0,22 |
| Días estancia UCI media (ds) | 8 (11,85) | 6,87 (7,33) | 8,56 (15,59) | 0,075 |
EPOC: enfermedad pulmonar obstructiva crónica; IMC: índice de masa corporal; TVP: trombosis venosa profunda; TEP tromboembolismo pulmonar; MI: miembros inferiores; SatO2: saturación de oxígeno por pulsioximetría; FiO2: fracción inspirado de oxígeno; UCI: unidad de cuidado intensivo; p: estadísticamente significativa <0,05. Fuente: creación propia
Tabla 3 ACOR por escala y por subgrupo
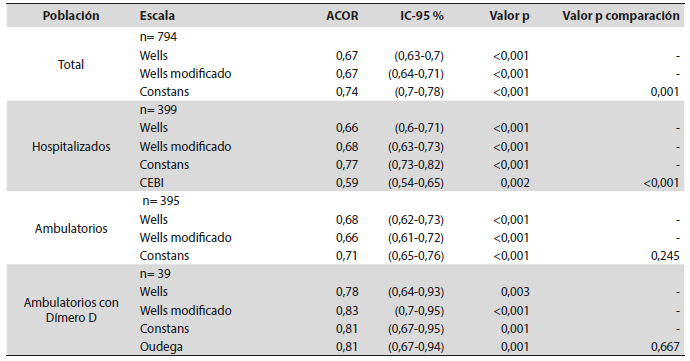
ACOR: área bajo la curva de características operativas del receptor; p: significativa en comparación de 5 escalas <0,01. Fuente: creación propia
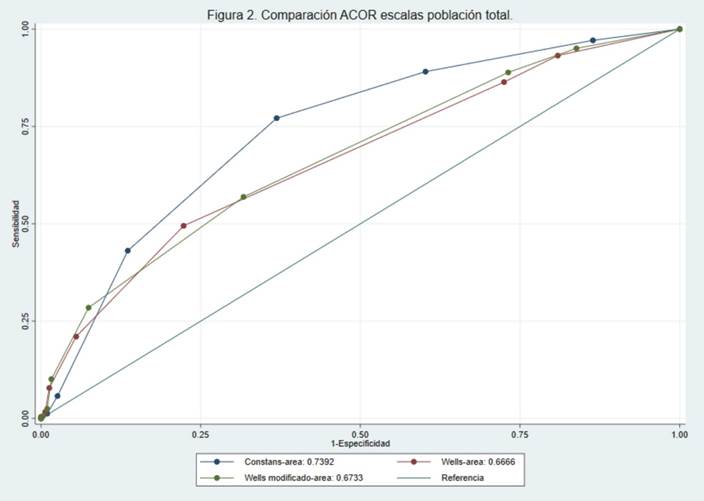
Encontramos una diferencia significativa en la muestra total y los pacientes hospitalizados a favor de la escala de Constans, con un área bajo la curva de 0,74 (IC-95 % 0,70-0,78) y 0,77(I-95 % 0,73-0,82), respectivamente. En la Tabla 4 se presenta la distribución de las escalas de acuerdo con sus diferentes puntos de corte y el diagnóstico de TVP, para la muestra general y para cada uno de los subgrupos. En la Figura 2 se muestran las áreas bajo la curva de las escalas de Constans, Wells y Wells modificada en la población total. En los anexos se encuentran las figuras de las áreas bajo la curva en los pacientes hospitalizados, ambulatorios y ambulatorios con reporte de Dímero D.
Tabla 4 Comportamiento de las escalas en cada una de las subpoblaciones
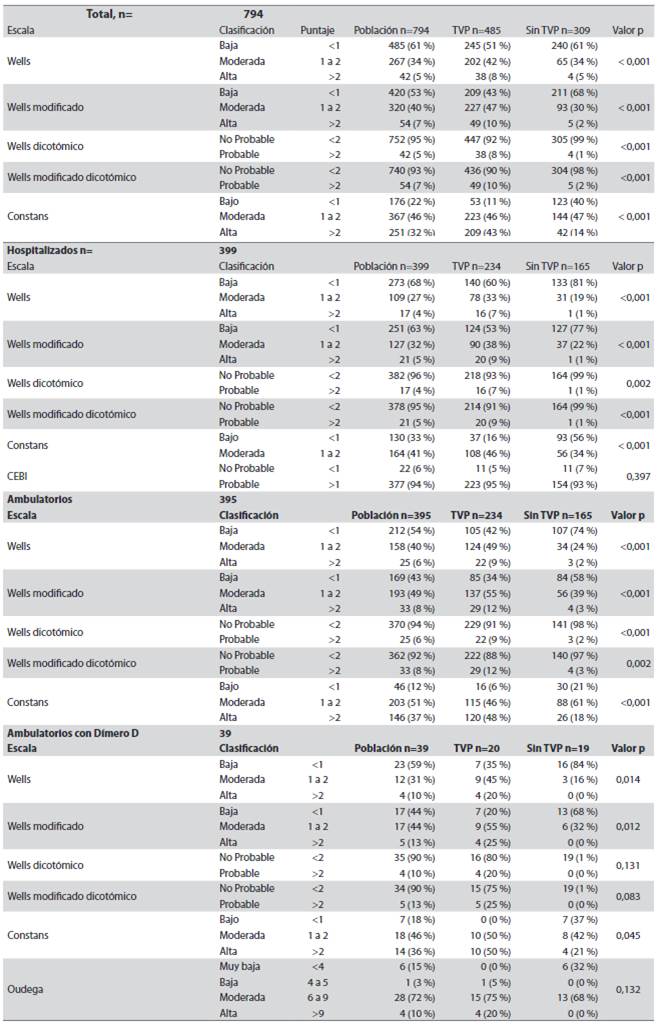
TVP trombosis venosa profunda, p estadísticamente significativa < 0,05. Fuente: creación propia
Discusión
Según la literatura encontrada, este es el primer estudio en nuestro medio que se realiza con el fin de validar cinco escalas de predicción clínica para el diagnóstico de trombosis venosa profunda. Se tuvo en cuenta sujetos de los servicios de urgencias y hospitalización, encontrando que el mayor rendimiento diagnóstico es con la escala de Constans. Esto difiere de los resultados hallados en la literatura, donde se evidenció un rendimiento similar de la escala de Constans y Wells (8). Aunque estas escalas mencionadas previamente fueron originalmente desarrolladas para pacientes ambulatorios, han sido validadas en hospitalizados (2,8), donde la escala de Wells muestra un menor rendimiento que Constans (10). Con relación a la escala Oudega, se pudo observar que tuvo un menor rendimiento al compararla con Wells y Constans, lo cual puede deberse a que fue originalmente realizada para pacientes ambulatorios que acudían a los servicios de atención primaria, donde muestra un mejor rendimiento (6). Al comparar la escala de Wells modificado y Oudega en pacientes mayores de 60 años, valorados en servicios de atención primaria, se ha encontrado un rendimiento similar para diagnosticar TVP, incluso ligeramente superior para la escala de Wells (11). Por otra parte, la escala CEBI fue la que mostró menor rendimiento en el estudio al compararla con Wells y Constans, en contraste con lo que se encuentra descrito, donde se ha evidenciado un mejor rendimiento de CEBI (7). Se pudo observar que las escalas que están validadas en pacientes ambulatorios y hospitalizados por separado, presentaron menor rendimiento diagnóstico (CEBI y Oudega) que aquellas que tienen la capacidad de evaluar tanto a pacientes ambulatorios como a hospitalizados (Constans, Wells clásico y Wells modificado).
Con respecto a las características de la población, los resultados indicaron una mayor prevalencia de TVP en pacientes de sexo masculino, que representan el 53 % de la población que presentó la enfermedad. Esto concuerda con lo hallado en la literatura, donde la prevalencia en hombres es el doble que en las mujeres, lo que se ha relacionado con una mayor frecuencia de asistencias médicas por parte de las mujeres, donde se puede sospechar signos de TVP con mayor facilidad (6). Sin embargo, también se ha descrito que no existe una relación entre la TVP y el sexo (12). Por lo que estos hallazgos deben ser tomados con cautela, pues pueden ser el resultado de características intrínsecas de nuestra población o de variables de confusión que no han sido tenidas en cuenta en la toma de datos y en el análisis de estos.
Por otra parte, se encontró la asociación entre la TVP y el cáncer activo, como ya es bien conocido. Según la literatura se considera el cáncer activo como un factor causante permanente o un factor de riesgo fuerte para TVP, provocando que estos pacientes tengan hasta 6 veces mayor riesgo de desarrollar ETV que aquellos sin cáncer (1,12,13). Asimismo, tal como se describe en la literatura, se encontró una asociación fuerte entre el diagnóstico y el antecedente de TVP (7,14).
Como se mencionó previamente, Constans fue la escala con mejor rendimiento diagnóstico en el estudio, tanto en pacientes hospitalizados como en ambulatorios, con un área bajo la curva ROC de 0,73 (IC5 % 0,70-0,78), lo cual coincide con los resultados hallados en la literatura, donde al comparar la escala Constans con otras 4 de predicción clínica, se encontró un mejor rendimiento que al compararla con St. André, Khan y Wells clásico, con un área bajo la curva ROC de 0,65 (IC-95 % 0,60-0,71). Sin embargo, tuvo un rendimiento similar con Wells modificado, con un área bajo la curva ROC de 0,67 (IC-95 %0,61-0,72) (15). En el estudio también se pudo encontrar un mejor rendimiento de Constans al ser aplicada en pacientes ambulatorios y en hospitalizados por separado, lo cual corresponde con lo hallado en el estudio original, donde se comparó esta escala con otras tres utilizadas solo en pacientes ambulatorios (8); pero difiere con otros autores, donde se ha observado un rendimiento similar entre Constans y Wells clásico al aplicarlas en pacientes ambulatorios, con un mejor rendimiento de Constans al ser aplicada solo en pacientes hospitalizados (15). Como resultado, lo encontrado en la literatura, sumado a los hallazgos presentados, puede sugerir que la escala de Constans es una alternativa válida con un rendimiento adecuado en la evaluación diagnóstica de los pacientes con sospecha de TVP hospitalizados o ambulatorios.
Por otra parte, también se pudo observar que las escalas que son específicas para pacientes hospitalizados o ambulatorios, como lo son CEBI y Oudega, mostraron un menor rendimiento que aquellas que han sido validadas en ambas poblaciones; es decir, Wells clásico, Wells modificado y Constans. Esto no coincide con los resultados encontrados en la literatura, donde se argumenta un mayor poder de predicción en las escalas específicas que aquellas validadas en ambos grupos de pacientes (7). Sin embargo, en los estudios que evalúan el rendimiento de la escala Constans, esta siempre tuvo un mejor rendimiento que las demás, ya sea al compararla con las escalas específicas o con las inespecíficas, indicándonos un comportamiento similar que coincide con lo encontrado en el estudio (2,8,15).
En cuanto a las limitaciones del estudio, dado que corresponde a un análisis secundario de una base de datos de enfermedad tromboembólica, podría haber sesgo de selección, ya que los datos fueron obtenidos de pacientes que acudieron al servicio de urgencias o que se encontraban hospitalizados. Adicionalmente, dado el diseño retrospectivo del estudio y a que los datos fueron adquiridos de lo consignado en la historia clínica, la información se limita a lo contenido en esta. No obstante, la fortaleza de este estudio radica en que es el primero en comparar estas escalas en la población colombiana con un buen número de pacientes según lo encontrado en la literatura; además, se realizó un adecuado análisis del desempeño de las escalas en los pacientes hospitalizados y ambulatorios. En todo caso, los resultados del estudio deben ser tomados con cautela, pues no se realizó un análisis por variables de confusión y es posible que exista algo de confusión residual. Como posibles objetivos para estudios futuros se plantea la validación de estas escalas en poblaciones especiales, como lo son mujeres en estado de embarazo y niños. Adicionalmente, se plantea la realización de estudios económicos que midan el impacto de la implementación de algoritmos diagnósticos que incorporen la escala de Constans, midiendo el efecto en nuestro sistema de salud al disminuir la toma de exámenes complementarios como el dímero D y el Doppler venoso de miembros inferiores.
Conclusiones
En este estudio encontramos un mayor rendimiento diagnóstico para la escala Constans al ser aplicada en pacientes ambulatorios y hospitalizados. No obstante, dado el rendimiento diagnóstico de estas escalas, se requiere de la realización de estudios complementarios en los pacientes con riesgo alto e intermedio para confirmar o descartar el diagnóstico. Estos resultados podrían ser confirmados en la población mayor de 18 años y no ser extrapolables en poblaciones especiales, como mujeres en embarazo y niños.