Introducción
La contaminación atmosférica, proceso en el que se introduce en la atmósfera diversos contaminantes, es la preocupación ambiental más generalizada y es una amenaza para la salud pública mundial y las personas de todos los grupos etarios (1). El uso de combustibles fósiles y las emisiones de la industria son las principales fuentes de contaminación del aire, incluido el PM, NO2, SO2, CO y O3. El PM es una mezcla heterogénea de partículas sólidas y líquidas suspendidas en el aire y producidas por diferentes actividades antropogénicas y naturales (2,3). Los constituyentes químicos del PM son diversos e incluyen nitratos, sulfatos, carbono elemental y orgánico, compuestos orgánicos, compuestos biológicos, y metales (2). Tiene diferentes propiedades fisicoquímicas y termodinámicas y según su diámetro aerodinámico, que es el principal criterio que describe su capacidad de transporte en la atmósfera y la facilidad para ser inhalado, se clasifica en PM10 (<10 μm, partículas gruesas), PM2.5 (<2.5 μm, partículas finas) y PM0.1 (<0.1 μm, partículas ultrafinas) (4). Los valores aceptables son 10 μg/m3 de media anual y 25 μg/m3 de media en las últimas 24 horas para PM2.5, y 20 μg/m3 de media anual y 50 μg/m3 de media en las últimas 24 horas para PM10 (5).
Los efectos en la salud del alto riesgo de exposición a la contaminación atmosférica han sido motivo de gran preocupación. La OMS estimó que en 2016, 90 % de la población mundial habitaba en zonas con niveles excesivos de PM (6), y que la contaminación ambiental del aire causa 4,2 millones de muertes prematuras anualmente en todo el mundo; mortalidad debida principalmente a enfermedades cardiovasculares, respiratorias y cáncer (7).
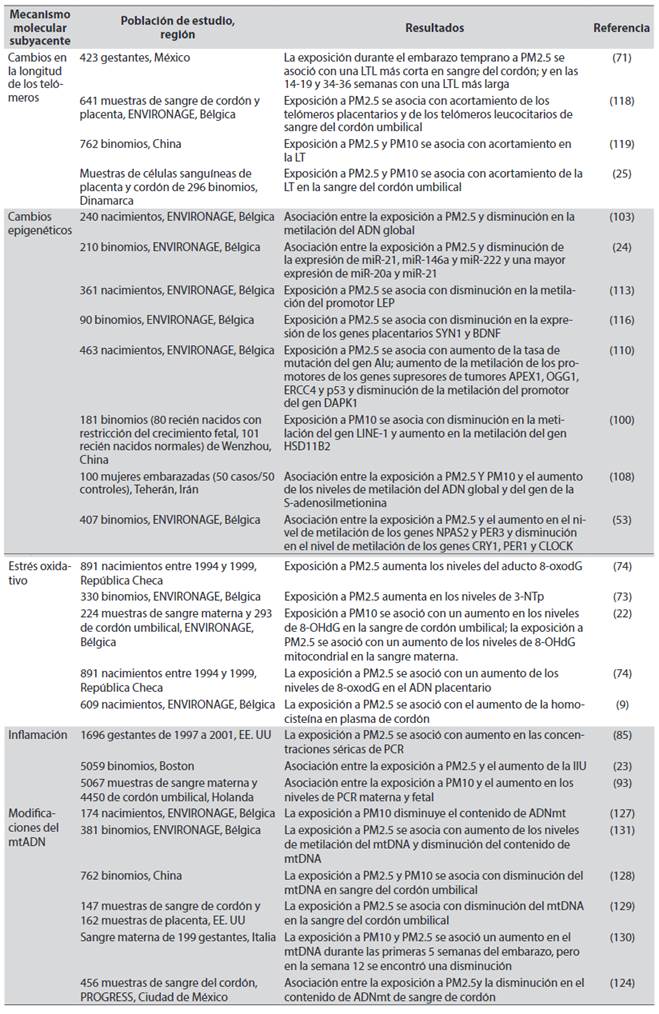
Durante el embarazo, el aire es la principal fuente de exposición a PM. El feto es particularmente sensible a las exposiciones ambientales debido a su inmadurez fisiológica y a una mayor tasa de proliferación celular. Por tanto, cambios causados por la exposición in utero pueden provocar defectos funcionales importantes y mayores riesgos de enfermedades en el futuro. Una fracción de las partículas inhaladas por la madre puede penetrar en la región de intercambio de gases del pulmón, viajar a través de la barrera respiratoria, entrar al sistema circulatorio y llegar incluso hasta la placenta (8-11), ocasionando efectos adversos en el nacimiento como bajo peso al nacer (BPN) (12,13), parto prematuro (PP) (13,14) y óbitos (15), e incluso trastornos que pueden extenderse hasta la infancia y adultez como los trastornos pulmonares (16,17), cardiovasculares (18,19) y neurológicos (20,21) (Figura 1). Entre los mecanismos biológicos que explican el vínculo entre exposición a PM y efectos en el embarazo y el feto, se ha propuesto que el estrés oxidativo (22) y la inflamación (23) desempeñan un papel central; estos pueden conducir a cambios epigenéticos (24), en la longitud de los telómeros (25) y en el contenido de ADN mitocondrial (mtADN) (26).
Esta revisión explora la literatura científica publicada, para describir los efectos adversos de la exposición al PM sobre el feto, el nacimiento y la infancia, así como algunos mecanismos moleculares que podrían explicar estos efectos.
Fuente: creación propia usando BioRender.com
Figura 1 Efectos de la exposición gestacional a PM La inflamación y el estrés oxidativo son los principales mecanismos moleculares subyacentes a la exposición a PM durante el embarazo; estos a su vez van a afectar otros mecanismos biológicos y ocasionar efectos adversos en el feto.
Efectos del pm durante el embarazo
Parto prematuro y bajo peso al nacer
La OMS define BPN como “peso neonatal inferior a 2500 g” (27) y PP como “nacimiento antes de 37 semanas de gestación” (28), ambos se han relacionado con la exposición a PM (29-31). Datos de 183 países demostraron que 30 a 40 % de los PP se asocian a esta exposición (28).
Diferentes estudios epidemiológicos demuestran que el riesgo de PP y BPN aumenta con la concentración de PM y depende del trimestre de exposición. Estudios realizados en China, demuestran que el riesgo de PP y BPN se eleva con un aumento en la concentración de PM2.5 y PM10 durante la gestación (13,31-34). Además del riesgo de PP y BPM, también existe evidencia que sugiere que la mortalidad fetal aumenta con una elevación en 10 μg/m3 de PM2.5 durante todo el embarazo y de PM10 durante el tercer semestre (15). Sin embargo, la mayoría de estos estudios comparan concentraciones ambientales de PM en relación a los entornos de vivienda de las gestantes observadas, sin control de variables que generen influencia en el desenlace de forma independiente o que generen interacciones, esto en detrimento de las predicciones realizadas por dichos modelos; por lo tanto, a pesar de la evidencia, dichas interpretaciones deben ser evaluadas con cautela.
Neuropsicológicos y en el neurodesarollo
La inflamación sistémica es uno de los mecanismos principales por el cual el PM causa toxicidad y se cree que la activación de la microglía, el estrés oxidativo y la neuroinflamación se asocian causalmente con neurotoxicidad, desarrollo de enfermedades neurodegenerativas y del neurodesarrollo (35-38). No obstante, los estudios que sustentan estas teorías están basados en mediciones ambientales de algunos contaminantes y la comparación de dichas mediciones en los resultados del desarrollo neurológico de fetos expuestos, pero en modelos murinos. Dado que la evaluación in vivo de estos desenlaces en humanos no es posible, se limita la comprensión de estos fenómenos.
Neurodesarrollo
La exposición prenatal a contaminantes del aire se relaciona con peor desarrollo neurológico (21) y desarrollo cognitivo y psicomotor deteriorado (39). Se ha demostrado la asociación negativa entre la exposición materna a PM10, el Índice de Desarrollo Mental (IDM) y el Índice de Desarrollo Psicomotor (IDP) durante los primeros 24 meses de vida. Estos índices comparan el rendimiento del desarrollo de un niño por edad con la distribución del rendimiento normal entre la población general de niños (20).
El PM afecta el desarrollo neurológico dependiendo del tiempo de exposición y sexo fetal (40,41). Chiu et al. identificaron ventanas sensibles para la exposición gestacional a PM2.5 y desarrollo neurológico infantil según el sexo fetal, utilizando la escala de inteligencia Weschler para niños (WISC-IV), el Test de Ejecución Continua de Conners (CPT-II) y de la Evaluación de Amplio Rango de la Memoria y el Aprendizaje (WRAML-2). Los niños con niveles mayores de exposición a PM2.5 presentaron menor Coeficiente Intelectual (IQ), Errores de Omisión (no responder a un objetivo), Tiempos de Reacción (tiempo medio de reacción para las respuestas objetivo) mayor; mientras que, en niñas, mayor exposición a PM2.5 se asocia con Índice de Memoria Verbal (mide la capacidad de aprender y recordar material verbal) e Índice de Memoria General (mide la capacidad de memoria inmediata y retardada junto con la adquisición de nuevos aprendizajes) reducidos (40). Similarmente, Lertxundi et al. evaluaron 438 binomios madre-hijo, concluyendo que el aumento promedio de 1 μg/m3 en las concentraciones de PM2.5 durante el embarazo se asocia con disminución en la puntuación motora y en la mental según la Escalas del Desarrollo Infantil de Bayley, un instrumento de evaluación del desarrollo cognitivo y psicomotor en niños entre 1 y 42 meses de vida (41).
Aunque hay poca evidencia sobre los efectos en el desarrollo del comportamiento neurológico infantil, la exposición gestacional a PM se ha asociado con riesgo de trastornos de la atención y del comportamiento (42).
Trastorno del espectro autista (TEA)
Los TEA son un grupo de trastornos del desarrollo con prevalencia creciente en todo el mundo (35). Aunque es un trastorno heterogéneo en el cual la genética juega un papel importante, la evidencia epidemiológica reciente sugiere que exposiciones a PM in útero o durante la vida temprana, aumentan el riesgo de TEA (43,44). En este sentido, múltiples estudios en EEUU y Taiwán han reportado asociación entre exposición a PM2.5 y PM10 con el desarrollo de TEA (35,45-50).
Trastornos del sueño
La programación de la arquitectura del sueño comienza en el embarazo y depende de la formación óptima en el útero y de la maduración de la conectividad neuronal cerebral (51). La exposición prenatal a PM puede interrumpir el desarrollo del cerebro fetal, lo que puede ocasionar diferentes trastornos del sueño en el niño (40,51). Un estudio de México demostró que el aumento en la exposición materna a PM2.5 se asocia con disminución de la duración y eficiencia del sueño en los niños (51). Una explicación a estos trastornos del sueño son las disrupciones en el ciclo circadiano debido a alteraciones en el patrón de metilación de los genes dentro de la vía circadiana (52).
En una cohorte de Bélgica, se encontró que la exposición a PM2.5 en el útero estaba asociada con el estado de metilación de genes placentarios de la vía circadiana (53).
Cardiopulmonares
La exposición intrauterina a PM predispone a resultados cardiovasculares adversos en la niñez y adultez (9,19). Modelos murinos mostraron que la exposición gestacional a PM conduce a cardiopatías en adultos (54-56). En EEUU, un estudio demostró que la exposición a PM2.5 durante el tercer trimestre del embarazo se asocia con hipertensión en niños (19). Además, la exposición prenatal a PM10 y PM2.5 se asocia con aumento en el índice de rigidez de la carótida y en el módulo elástico de Young, y una disminución en la distensibilidad, sugiriendo mayor riesgo de efectos adversos cardiovasculares (57). En este sentido, seguimientos a cohortes con datos prospectivos (desde la gestación y hasta edades avanzadas) podrían aportar al entendimiento de estos efectos, considerando otros determinantes del riesgo cardiovascular y eliminando los sesgos en su interpretación.
Por su parte, el desarrollo pulmonar va desde la gestación hasta la adultez (16,58), por eso la exposición prenatal a aire contaminado puede tener efectos perjudiciales en la salud respiratoria de niños y adultos (59).
El asma afecta a más de 300 millones de personas y su prevalencia ha aumentado continuamente (60). Evidencia creciente indica que el PM induce radicales libres, que aumentan el estrés oxidativo y provoca inflamación pulmonar, contribuyendo con el desarrollo del asma (61,62). Varios estudios han reportado que la exposición gestacional al PM2.5 se asocia con mayor incidencia de asma (58,63). Además, un estudio inglés demostró que la exposición a PM10 durante el embarazo puede resultar en reducciones de parámetros respiratorios en niños, incluyendo el volumen espiratorio forzado en un segundo (FEV1) y la capacidad vital forzada (FVC) (64).
Por otro lado, en una cohorte de bebés árabes menores de 1 año se encontró que la exposición intrauterina a niveles altos de PM 2.5 (> 24 μg/m3) se asoció con mayor riesgo de hospitalizaciones debido a infecciones del tracto respiratorio inferior (65). Sin embargo, se desconoce si el impacto de la carga de exposición intraútero es mayor a la exposición ambiental luego del parto, así como sus posibles interacciones. Esta evidencia se resume en la Tabla 1.
Tabla 1 Evidencia epidemiológica de los efectos en el embarazo, el feto y el niño de la exposición al PM
| Desenlace | Población de estudio, región | Conclusión | Referencia |
|---|---|---|---|
| Asma | 34.336 nacimientos, China | Asociación entre exposición pre y postnatal a PM2.5 y asma | (58) |
| 955 binomios, EEUU | Asociación entre PM2.5 y asma en varones | (63) | |
| BPN | 3614 gestantes, Italia | El peso al nacer se correlaciona inversamente con la exposición a PM10 | (8) |
| 687 gestantes, China | Aumento del riesgo de BPN con la exposición a PM2.5 y PM10 | (13) | |
| 1845 binomios, China | PM2.5 se asocia BPN | (31) | |
| 1.455.026 binomios, China | PM2.5 se asocia a PP y BPN | (32) | |
| 10.915 nacimientos, China | PM10 y PM2.5 se asocia a BPN | (33) | |
| 3692 nacimientos, China | PM2.5 se asocia a BPN | (34) | |
| Neurodesarrollo | 520 binomios, Corea del Sur | PM10 se asocia a retraso del neurodesarrollo | (20) |
| 9482 nacimientos, Europa | Asociación entre PM2.5 y PM10 y retraso en el desarrollo psicomotor | (39) | |
| 267 nacimientos, EEUU | Posible asociación entre PM2.5 y alteración de la memoria y atención | (40) | |
| 438 binomios, España | Asociación entre exposición a PM2.5 y alteraciones motoras y cognitivas | (41) | |
| Función Pulmonar | 13.963 nacimientos, Inglaterra | PM10 se asocia a reducciones en la función pulmonar a los 8 años de vida | (64) |
| HTA | 1293 gestantes, EEUU | El PM2.5 se asoció con HTA en niños de 3 a 9 años | (19) |
| IQ | 1005 binomios, EEUU | El PM10 se asocia a menor IQ, el efecto es modificado por consumo gestacional de folatos | (21) |
| Infecciones tracto respiratorio | 57331 binomios, Israel | Asociación entre PM2.5 y hospitalizaciones por infecciones de tracto respiratorio inferior | (65) |
| Muerte Fetal | 95.354 nacimientos, China | La exposición a PM10 y PM2.5 aumenta el riesgo de MF | (15) |
| PP | 687 gestantes, China | Aumento del riesgo de PP con la exposición a PM2.5 | (13) |
| 6693 gestantes, China | La exposición a PM10 aumenta el riesgo de PP | (14) | |
| 1455026 binomios, China | PM2.5 se asocia a PP y BPN | (32) | |
| 3692 nacimientos, China | PM2.5 se asocia PP | (34) | |
| Defectos cardiovasculares | 768 estudiantes universitarios, EEUU | Asociación entre PM10 y PM2.5 y rigidez carotidea | (57) |
| TEA | 1767 nacimientos, EEUU | PM2.5 aumenta los ODDS para TEA | (35) |
| 246.420 nacimientos, EEUU | PM2.5 se asocia con más riesgo de TEA en varones | (45) | |
| 1077 nacimientos, EEUU | PM2.5 se asocia a mayores odds de TEA | (46) | |
| 443 nacimientos, EEUU | Exposiciones a PM2.5 pre y postnatal se asocian a TEA | (48) | |
| 15.645 nacimientos, EEUU | Asociación entre TEA y PM10 | (49) | |
| 524 nacimientos, EEUU | Asociación entre TEA y PM10 y PM2.5 | (50) | |
| 397 binomios, México | Asociación entre PM2.5 y disrupción del ciclo del sueño | (51) | |
| Trastornos del sueño | 407 binomios, ENVIRONAGE, Bélgica | Asociación entre PM2.5 y disrupción del ciclo del sueño | (53) |
Fuente: creación propia
Mecanismos moleculares
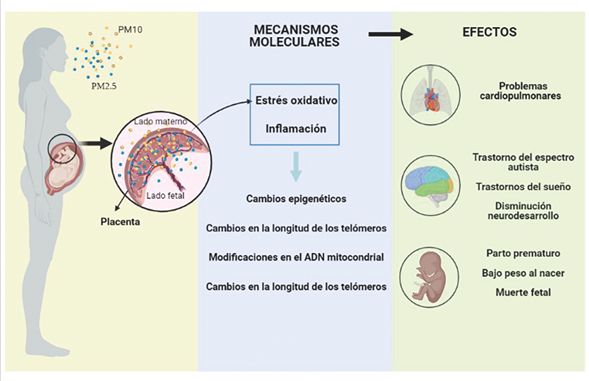
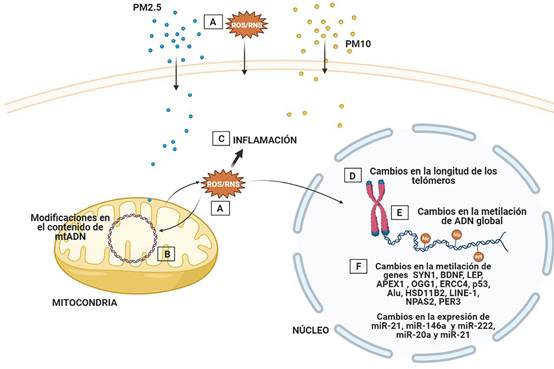
La placenta es de vital importancia para asegurar el crecimiento y desarrollo adecuados del feto; participa en la transferencia de gases, nutrientes y desechos entre la madre y el niño. La actividad metabólica de la placenta es crucial para proteger al feto de noxas externas que puedan alterar su crecimiento y desarrollo (66). El entorno durante el embarazo influye en la función de la placenta durante el desarrollo y diferentes estudios demuestran que las partículas finas como el PM tienen la posibilidad de atravesar la barrera materno-fetal para llegar al feto (10,11,67), pueden inducir inflamación y estrés oxidativo, que a su vez pueden ocasionar efectos en la metilación del ADN, cambios en el contenido de ADN mitocondrial y acortamiento telomérico, aumentando el potencial de resultados adversos en el feto y el niño (22-26) (Figura 2).
Fuente: creación propia usando BioRender.com
Figura 2 Efectos moleculares de la exposición a PM. El PM puede entrar al tejido placentario e inducir A) la producción de ROS/RNS de manera directa o indirecta. Esto a su vez puede ocasionar: B) modificaciones en la metilación y el contenido del mtADN, C) Inflamación; o afectar otras organelas como el núcleo induciendo cambios en D) la longitud de los telómeros y E) y F) cambios epigenéticos.
Estrés oxidativo
El desarrollo fetal normal requiere un equilibrio oxidante óptimo en la interfaz materno-fetal. El estrés oxidativo es uno de los elementos clave de las modificaciones placentarias y de la interrupción del desarrollo fetal inducidas por la contaminación (68). Este se genera cuando la producción de especies reactivas de oxígeno/ nitrógeno (ROS/RNS) cruza el umbral de la capacidad antioxidante celular (69). Evidencia cada vez mayor sugiere que el PM induce directa e indirectamente la producción de ROS/RNS (69,70), afectando el funcionamiento de la NADPH oxidasa, a través de la desregulación de telómeros y mitocondrias y de la activación de células inflamatorias (69,71,72). Estos oxidantes inducen además daños en lípidos, proteínas y ADN (69).
Se ha reportado que la exposición a PM2.5 durante el embarazo aumenta los niveles de los biomarcadores de estrés oxidativo como 3-nitrotirosina placentaria (3-NTp) y 8-hidroxi-2’-desoxicoguanosina (8-OHdG) (22,73). Los neonatos con altos niveles de 8-OHdG tienen mayor probabilidad de restricción del crecimiento intrauterino (74).
Existen varios mecanismos por los cuales las partículas del aire causan enfermedades cardiovasculares, incluyendo el estrés oxidativo. La elevación de homocisteína circulante (hiperhomocisteinemia) irrita el endotelio a través de mecanismos oxidantes (75), suprime el óxido nítrico, reduciendo la vasodilatación e induce inflamación de las células del músculo liso a través de la proteína C reactiva (PCR) (76,77). Todo esto se ha asociado con mayor riesgo de arterosclerosis y cardiopatías (78). Se ha demostrado también que la exposición a PM2.5 durante el embarazo se asocia a hiperhomocisteinemia en el cordón umbilical (9,77). Este aumento depende de variantes en los genes para las enzimas antioxidantes superóxido dismutasa (SOD), catalasa (CAT) y glutatión S-transferasa 1 (GSTP1), lo que sugiere el estrés oxidativo como mecanismo de acción subyacente (9), y lo que puede llevar a alteraciones cardiovasculares en la vida posterior de los niños (19).
Inflamación
La inflamación puede ser la base del vínculo entre la exposición al PM y los efectos adversos en el nacimiento; puede ser consecuencia de la estimulación de las células inflamatorias o mediada por el estrés oxidativo, que a su vez afecta el medio intrauterino y la función placentaria y, por ende, el crecimiento y desarrollo (79,80), como sugieren modelos murinos (81,82).
La evidencia indica que los efectos fisiopatológicos in vivo e in vitro de esta exposición incluyen el reclutamiento de monocitos y macrófagos; la liberación de citocinas como IL-6, IL-1beta, IL-8, IL-17 y TNF-α (83,84), la activación de linfocitos T y B; y el aumento de la PCR y el fibrinógeno (85-88). Estudios clínicos y experimentales corroboran que los mediadores inflamatorios desencadenan complicaciones pre y postparto (82,89-91). Por ejemplo, se ha demostrado que el aumento en la concentración de PM2.5 y PM10 aumenta la concentración de proteína C reactiva al comienzo del embarazo, contribuyendo a la inflamación y posiblemente a complicaciones del embarazo como el riesgo de PP (85,91,92). Asimismo, la exposición prenatal a PM2.5 se asocia con aumento en la concentración de PCR en sangre de cordón umbilical, lo que evidencia inflamación sistémica en el feto (23,93) y que es un factor de riesgo para PP, BPN y alteraciones respiratorias y del desarrollo neurológico en la primera infancia (23,94).
En murinos, se demostró que la exposición gestacional a PM aumentaba los niveles de IgE en suero, citocinas Th2 y Th17 pulmonares y sistémicas, y la hiperreactividad e inflamación de las vías respiratorias (95). En ratones expuestos durante el período prenatal, también se genera alteración de la estructura y función pulmonar (96).
Cambios epigenéticos
La epigenética se refiere a diferentes mecanismos que controlan la expresión de los genes sin alterar la secuencia de nucleótidos, como por ejemplo la metilación del ADN, la modificación de histonas y los microARN (miARN) (97).
La placenta se adapta a variaciones en las condiciones materno-fetales, morfológicas y funcionales. Ocasionalmente, la mala adaptación afecta su función y la salud materno-fetal (68). Una regulación epigenética adecuada es importante para el crecimiento y funcionamiento de la placenta (66,98). La exposición a PM durante el embarazo se asocia con la metilación del ADN que controla la expresión de genes clave (99-101), aumentando el riesgo de enfermedades cardiovasculares, del sueño y alteraciones en el neurodesarrollo (53,99,102-104).
La metilación del ADN en los elementos repetitivos de LINE1 (elementos nucleares largos intercalados) se utiliza con frecuencia como marcador de la metilación global (100). Una alteración de la metilación de ADN durante la embriogénesis afecta la función reguladora fetal. Dado el estado de hipermetilación de LINE1 después de la implantación; cualquier alteración inducida por el medio ambiente a LINE1 durante la embriogénesis se perpetuaría durante el desarrollo fetal y podría detectarse al nacer (105). Además, la metilación de LINE1 disminuye con la exposición a PM10 en el primer trimestre, mientras que la metilación del gen de la 11 Beta Hidroxiesteroide Deshidrogenasa Tipo 2 (HSD11B2), relacionada con el metabolismo de los glucocorticoides, aumenta con una elevación de PM10 durante la gestación y esto se asocia con restricción del crecimiento (100).
Algunos genes que codifican metil-transferasas y desmetilasas son fundamentales en procesos de metilación embriogenéticos. Estos incluyen metil-transferasas de ADN (DNMTs: DNMT1, DNMT3A y 3B), genes de la familia TET (Tet metilcitosina dioxigenasas: TET 1, 2, 3), y TDG (timina ADN glicosilasa) (106-108). Se ha comprobado que el PM afecta la actividad de estos genes (108,109), alterando la capacidad para metilar o desmetilar elementos LINE1 durante la embriogénesis, siendo el primer trimestre del embarazo la ventana de exposición más importante (56,99).
Por otro lado, la exposición prenatal a PM podría estar asociada con alteraciones en la metilación de las regiones promotoras de genes involucrados en la reparación del ADN como APEX1, OGG1, PARP1, ERCC1, ERCC4, p53, y DAPK1 y las vías supresoras de tumores; por ejemplo, un estudio demostró que la exposición a PM2.5 aumenta la tasa de metilación de los promotores de los genes APEX1, OGG1, ERCC4 y p53, y disminuye la metilación del promotor de DAPK1, induciendo cambios en la capacidad de reparación del ADN fetal y neonatal (110).
La leptina es una hormona proteica que, durante el embarazo, participa en la implantación de embriones, el desarrollo intrauterino y el crecimiento fetal (111). Algunas condiciones adversas durante el embarazo se han asociado con cambios en la metilación del gen de la proteína leptina (LEP) placentaria (112), incluyendo la exposición a PM2.5 que se asocia a menor metilación del ADN del gen LEP, que podría asociarse con preeclampsia de inicio temprano o alteración del metabolismo de la glucosa (113).
Los microARN (miRNA), otro mecanismo de control epigenético, pueden regular hasta el 30% del genoma humano (114,115). La exposición prenatal a PM afecta la expresión de miRNA, que a su vez afecta la programación fetal y aumenta el riesgo de PP, BPN y otros trastornos en el niño como los neurológicos (24,116,117). La disminución en la expresión placentaria de miRNA miR-20a, miR-21, miR-146a y miR-222, con el consecuente aumento en la expresión del gen homólogo de fosfatasa y tensina (PTEN), se asoció con la exposición a PM2.5 durante el embarazo, lo que podría conducir a disminución en la invasión de la decidua materna, la migración y el crecimiento de las células placentarias (24), que a su vez está relacionado con el crecimiento fetal (117).
Cambios en la longitud de los telómeros
Los telómeros son estructuras de nucleoproteínas que cubren el extremo de los cromosomas y que se acortan tras cada división celular. El acortamiento de los telómeros es un biomarcador para el envejecimiento y la longevidad celular (71,118). El embarazo puede ser el momento de mayor acortamiento de los telómeros debido a la cantidad de divisiones celulares; la configuración inicial de la longitud de los telómeros (LT) neonatales tiene implicaciones para la dinámica de los telómeros de los adultos y es afectada por el entorno intrauterino (119), además permite evaluar el envejecimiento prematuro neonatal (71,120) y se ha reportado que este proceso puede acelerarse por factores ambientales que influyen en el estrés oxidativo y el estado inflamatorio, como la exposición a PM (121). El acortamiento de la LT leucocitaria (LTL) neonatal, es un factor crítico para la biología telomérica del adulto (122), e indica mayor susceptibilidad al desarrollo de enfermedades relacionadas con la edad, como las metabólicas y cardiovasculares (33,71,123). Aunque los resultados con respecto a la ventana de tiempo más susceptible todavía son contradictorios, diversos estudios demuestran que hay una asociación significativa e inversa entre la exposición a PM durante el embarazo y la LTL maternos, en sangre de cordón umbilical o en placenta (71,118,119).
Modificaciones en el ADN mitocondrial
Las mitocondrias contienen múltiples copias de mtDNA para mantener las funciones fisiológicas óptimas (124). El estrés oxidativo generado por PM resulta en una replicación reducida del mtDNA, dando lugar a alteraciones en las funciones bioenergéticas y replicativas de la célula, llevando eventualmente a senescencia celular o apoptosis (125,126). Dado que las mutaciones del mtDNA y sus defectos bioquímicos son acumulativos, su medición proporciona información sobre las exposiciones fetales (126).
La exposición a PM se ha asociado a cambios en el contenido del mtADN en sangre de cordón umbilical y placentaria; sin embargo, los resultados son todavía inconsistentes (26,127), pues algunos sugieren que la exposición a PM durante el embarazo se asocia con una disminución del mtDNA en la sangre del cordón umbilical; sin embargo, otros sugieren un aumento (124,127-131). Un contenido de mtDNA de sangre del cordón alterado se ha asociado con resultados adversos del embarazo, incluido un crecimiento fetal anormal y BPN (130). Estos resultados se resumen en la Tabla 2.
Conclusión
La exposición a PM es frecuente en las grandes ciudades, siendo tan elevada como para relacionarse con enfermedades cardiovasculares, respiratorias, neurológicas, tumorales y trastornos del desarrollo fetal cuando la madre ha estado expuesta. Las ventanas de exposición son variadas, pero en resumen se relaciona con desenlaces fetales negativos, aumentando el riesgo de estos a medida que el PM se eleva sobre sus valores normales. Se conocen algunos mecanismos que llevan de la exposición a PM hasta las alteraciones en la salud; se requiere más conocimiento, pero la evidencia disponible apunta a los efectos deletéreos de esta exposición.
Entre los aspectos más importantes hallados en la literatura, se encuentran los estudios que demuestran no sólo cambios en el producto en el periodo perinatal, si no también cambios en el desarrollo en la infancia, adolescencia y la vida adulta a nivel de múltiples sistemas.
En la actualidad con la disposición de estaciones de medición de calidad del aire a nivel mundial, la georreferenciación de los individuos y el acceso a registros médicos de los usuarios de servicios de salud, el estudio de cohortes a largo plazo podría revelar información detallada sobre cambios en la salud relacionados con la exposición a PM.