Introducción
Un biobanco es una organización pública o privada, sin ánimo de lucro, que posee colecciones de muestras biológicas humanas con información asociada (datos personales, información clínica y biológica), bajo parámetros estandarizados y de calidad, cuya finalidad es la investigación de la salud humana (1). El reciente aumento en el número y en la relevancia de los biobancos coincide con la secuenciación del genoma humano en el año 2003, el avance de la bioinformática, el desarrollo de nuevos medicamentos, la prevención de enfermedades y de tratamientos más eficientes procedentes de la investigación traslacional (2). Lo anterior plantea aspectos éticos, legales y sociales que deben ser estrictamente analizados al momento de conformar el biobanco y sus protocolos, dado que cada muestra está vinculada a la información sociodemográfica y clínica del donante; por lo tanto, es necesario asegurar una apropiada codificación que permita proteger la identidad de los sujetos y establecer un consentimiento informado, el cual debe certificar que el donante está tomando una decisión completamente autónoma al donar su muestra. De igual forma, las investigaciones en las que se empleen las muestras deben estar regidas por estándares científicos y académicos rigurosos (3).
Con este artículo pretendemos brindar una visión general de los biobancos a través de su contexto a nivel mundial, latinoamericano y colombiano. Así como su gobernanza, estructuración y la importancia del consentimiento informado. Pues la creación de un biobanco supone un reto logístico al incluir componentes normativos, legales, éticos y científicos.
Metodología
Se realizó una revisión narrativa de la literatura comprendida entre los periodos de enero 1 de 2010 hasta diciembre 31 de 2020. Empleando las bases de datos de MEDLINE a través del buscador de PUBMED con los términos de búsqueda “biobank”, “biobanking”, “informed consent”, “Broad consent”. Se usó la herramienta “google scholar” con los términos de búsqueda “biobancos América Latina”, “biobanco covid”, “biobanco Colombia”, “biobanco Europa”. Bajo la asesoría de bibliotecología de la Facultad de Medicina de la Universidad de Antioquia, el grupo de autores refinó la búsqueda y seleccionaron 68 artículos para la revisión del resumen, de los cuáles se excluyeron 11 artículos por no tener relación clara con el objetivo de la revisión; de los 57 artículos restantes, los autores (DCC; DAVT) hicieron una revisión completa del manuscrito, excluyendo 7 artículos por duplicación para finalmente ser incluidos 50 artículos. No se realizó verificación aleatoria de la selección de los artículos por parte de los autores.
Una vez obtenida la información se elaboró una revisión de la literatura que sentará las bases para la ejecución del proyecto, con énfasis en la legislación, consentimiento informado, contexto mundial, latinoamericano, colombiano, gobernanza y requisitos del mismo. A su vez, se contó con el asesoramiento de expertos en el tema, a través de reuniones académicas en las que se brindaron conocimientos aplicados a las necesidades y contexto propio.
Biobancos: una visión general
El concepto de biobanco surgió por la observación del potencial científico y en investigación traslacional, derivada del hecho que algunos hospitales habían almacenado colecciones de muestras tisulares de distintas patologías en soluciones de formol y parafina por muchos años. Con la llegada de equipos de ultracongelación se comenzó también con el almacenamiento de muestras líquidas. Ambas formas de conservación permiten que los tejidos puedan ser revisados años después, con fines de investigación (4-5).
Los biobancos han ido cambiando en las últimas 3 décadas, comenzando como pequeños repositorios universitarios hasta biobancos grandes poblacionales. También los datos de las muestras se han ido ampliando desde datos básicos hasta información fenotípica, genética y proteómica de los donantes (6-8). Así mismo, se han instaurado protocolos con los más altos estándares éticos y de calidad en la administración, almacenamiento y organización del material biológico. Todo lo anterior para ser fuente de investigaciones biomédicas por parte de grupos científicos que tengan un convenio previo establecido con la entidad responsable del biobanco (9-11).
Las actividades de los biobancos están reguladas internacionalmente por documentos de carácter normativo sobre el manejo de muestras biológicas y datos asociados, como La Declaración Internacional Sobre los Datos Genéticos Humanos del año 2003 de la UNESCO, Pautas Éticas Internacionales para la Investigación Biomédica en Seres Humanos del año 2002 del Consejo de Organizaciones Internacionales de las Ciencias Médicas (CIOMS), Genetic Databases - Assessing the Benefits and the Impact on Human Rights and Patients Rights del año 2003, entre otros. También se han creado guías y recomendaciones que abordan temas éticos sobre el manejo de muestras biológicas y biobancos, algunos de esos son; Recommendations of European Society of Human Genetics. Data Storage and DNA Banking for Biomedical Research: Technical, Social and Ethical Issues - Sociedad Europea de Genética Humana en el año 2003, Human Tissue and Biological Samples for use in Research Consejo de Investigación Médica en Reino Unido en el año 2001 y Human Biological Material y Recommendations for collection, use and storage in researchConsejo Irlandés de Bioética. Sirven para establecer pautas en el contexto ético, pero sin un valor legal, teniendo como objetivo la defensa de los derechos de los pacientes que participan en investigaciones científicas en salud (3).
La reglamentación y legislación comenzó en Europa, a partir de la aprobación del Act on Biobanks de Islandia en el año 2002 y países como Suecia, Noruega, Finlandia, Estonia, Reino Unido y España han ido adoptando normatividad (12). España es el país con la legislación específica más robusta para manejar el material biológico humano en investigaciones y en derechos de los pacientes.
Los biobancos pueden colaborar tomando la forma de biobanco en red, red de biobancos o red de redes (13). Actualmente se organizan en redes internacionales que buscan la cooperación en investigaciones y acceso a las muestras por medio de los miembros de estas (14-15). La Red Europea de Infraestructuras en Biobancos y Recursos Biomoleculares (BBMR) cuenta con 664 miembros ubicados en Europa (https://www.bbmriportal.eu fecha de acceso 22/08/2020). Otra importante organización europea es EuroBioBank que cuenta con 25 biobancos (http://www.eurobiobank.org fecha de acceso 22/082020) (16), este fue incluido en la lista de los 10 a gran escala alrededor del mundo por biobanking.com junto con los de países como Austria, China, Reino Unido, Finlandia, Canadá, Catar y Estados Unidos (6,17).
Un estudio caracterizó los biobancos de Estados Unidos y para el 2013 contaba con 636 (18).
En el contexto latinoamericano, las publicaciones científicas en este tema son escasas, según la base de datos Scopus son sólo el 2,3 %, en su mayoría realizadas por Brasil y México (19). Brasil es el país latinoamericano con mejor regulación y cuenta con un sistema de acreditación (20). En el caso del marco legal Mexicano, no cuenta con una legislación específica para biobancos, pero su reglamentación que se aplica a la investigación médica y manejo de muestras biológicas, sirve de base para la organización y adecuada gobernanza de estos (21). Es el mismo caso de Chile que a pesar de tener 9 biobancos con fines de investigación (22), no cuenta con uniformidad regulatoria (23). Según la literatura consultada, para el año 2015 los biobancos de Panamá no contaban con una regulación específica (24) y para el año 2018, Argentina tampoco (20). Por otro lado, no se cuenta con reportes de biobancos en Guatemala, aunque si se reclutan donantes para la investigación biomédica internacional (24).
A la fecha, Colombia no cuenta con reglamentación para los biobancos. No obstante, existen normas que regulan los bancos de sangre, los aspectos éticos y legales de las investigaciones en seres humanos, el derecho a la privacidad y el consentimiento informado, que podrían aplicarse a la instauración de estos en el contexto colombiano (12) (ver Tabla 1). El Proyecto de Ley No. 168 de 2019, que desde 2017 comienza como iniciativa de reglamentar el funcionamiento e implementación de estos. Luego de una revisión por entes estatales y académicos, es sometido al congreso. El proyecto de ley es fundamentado en legislación internacional que tiene como objetivo “regular la constitución y funcionamiento de los biobancos con fines de investigación biomédica, para la obtención, procesamiento, almacenamiento, transporte y cesión de muestras biológicas humanas, sus derivados, información clínica y biológica asociada.” También busca crear el Sistema Nacional de biobancos (constituido por el Ministerio de Salud y Protección Social y el Instituto Nacional de Salud -INS-) para coordinar y apoyar el funcionamiento de estos, prestar el apoyo y las herramientas necesarias para que se constituyan en redes nacionales con el objetivo de lograr la cooperación científica y técnica (1). Esto demuestra la creciente inclinación en reglamentar la instauración de biobancos en Colombia.
Tabla 1 Legislación Colombiana relacionada con los biobancos
| Legislación | Objetivo | Aspectos aplicables a biobancos |
|---|---|---|
| Ley 9 de 1979 | Se dictan las medidas sanitarias. | Licencia Sanitaria para instalación y funcionamiento de cualquier establecimiento. |
| Ley 23 de 1981 | Se dictan Normas en Materia de Ética médica. | Requisito del consentimiento del paciente para aplicar procedimientos médicos y que puedan tener consecuencias. |
| Ley estatutaria 1266 de 2008 | Se regula el manejo de la información contenida en bases de datos personales. | Desarrollar el derecho constitucional que tienen todas las personas a conocer, actualizar y rectificar las informaciones que se hayan recogido sobre ellas en bancos de datos. |
| Ley 1374 de 2010 | Se crea el Consejo Nacional de Bioética y se dictan otras disposiciones. | Establecer un diálogo interdisciplinario para formular y resolver los dilemas que plantea la investigación. |
| Ley 1408 de 2010 | Se rinde homenaje a las víctimas del delito de desaparición forzada y se dictan medidas para su localización e identificación. | Crea el Banco de Perfiles Genéticos de Desaparecidos, como una base de datos que contiene muestras biológicas recuperadas de los restos humanos de las personas desaparecidas. |
| Ley 1805 de 2016 | Se modifican la Ley 73 de 1988 y la Ley 919 de 2004 en materia de donación de componentes anatómicos y se dictan otras disposiciones. | Tiene por objeto ampliar la presunción legal de donación de componentes anatómicos para fines de trasplantes u otros usos terapéuticos. |
| Ley Estatutaria 1581 de 2012 | Se dictan disposiciones generales para la protección de datos personales. | Desarrollar el derecho constitucional que tienen todas las personas a conocer, actualizar y rectificar las informaciones que se hayan recogido sobre ellas en bases de datos o archivos. |
| Resolución 13437 de 1991 | Se constituyen los Comités de Ética hospitalaria y se adopta el Decálogo de los Derechos de los Pacientes. | Comunicación clara y plena entre el médico y el paciente en relación a la enfermedad que padece, procedimientos y tratamientos. |
| Resolución 8430 de 1993 | Se establecen las normas científicas, técnicas y administrativas para la Investigación en salud. | Aspectos éticos de la investigación en humanos y consentimiento informado. |
| Resolución 5108 de 2005 | Por la cual se establece el Manual de Buenas Prácticas para Bancos de Tejidos y de Médula Ósea y se dictan otras disposiciones. | Dictar disposiciones relacionadas con el trámite de obtención del Certificado de Cumplimiento de las Buenas Prácticas. |
| Resolución 2378 de 2008 | Se adoptan las Buenas Prácticas Clínicas para las instituciones que conducen investigación con medicamentos en seres humanos. | Trata del consentimiento informado y sus implicaciones. |
| Decreto 1571 de 1993 | Se reglamenta parcialmente el Título IX de la Ley 9 de 1979, en cuanto a funcionamiento de establecimientos que manejan y transportan sangre o sus hemoderivados. | Regulación de aspectos técnicos de los bancos de sangre, garantía de calidad, bioseguridad, control y vigilancia, entre otros. |
| Decreto 1101 del 2001 | Por el que se crea la Comisión Intersectorial de Bioética y se nombran sus miembros. | Recomendaciones sobre implicaciones éticas de la intervención e investigación en el genoma humano; investigación biomédica, etc. |
| Decreto 1375 de 2013 | Por el cual se reglamentan las colecciones biológicas. | Reglamentar la administración y funcionamiento de las colecciones biológicas. |
Fuente: creación propia
Entre las entidades colombianas que han realizado estudios con colecciones de muestras biológicas acercándose al modelo de biobanco se encuentran GenPE -Estudio internacional de genética y pre-eclampsia, Biobanco CARDIECOL -Conocimiento y Acción para Reducir la Dimensión de la Enfermedad Cardiovascular en Colombia, CIDEIM -Biobanco del Centro Internacional de Entrenamiento e Investigaciones Médicas, Neurobanco -Grupo de Neurociencias de la Universidad de Antioquia, Banco Biológico Humano -Instituto de Genética Humana de la Facultad de Medicina de la Pontificia Universidad Javeriana, Banco Nacional de Tumores Terry FoxInstituto Nacional de Cancerología -INC y Red Chagas Colombia (25).
Según los posibles fines a los que se destinan las muestras (4), tipo de investigación científica y la institución, los biobancos se clasifican en aquellos orientados a enfermedades o a poblaciones. El primero se centra en el estudio de la patogénesis de enfermedades específicas para identificar posibles estrategias terapéuticas, mientras el segundo examina la susceptibilidad genética y factores externos relacionados con el desarrollo de enfermedades comunes o raras (26).
Los biobancos toman el rol de guardianes de los datos personales de los donantes (27), sus protocolos de manejo de la información clínica, muestras y gobernanza deben ser revisados por un comité de ética médica. Siendo el consentimiento informado la base del respeto, transparencia y derechos de los sujetos fuente (28).
Estructuración de los biobancos en Colombia
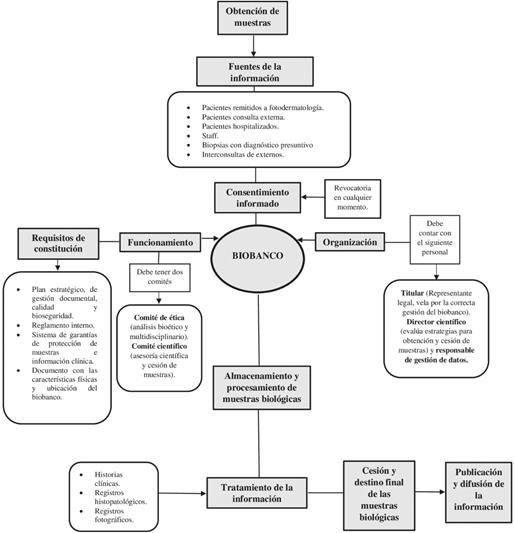
En Colombia, acorde al proyecto de ley 168-19, los componentes necesarios para la inscripción de un biobanco ante el sistema Nacional de Biobancos incluyen: plan estratégico, de gestión documental y de calidad y bioseguridad, una estructura organizativa clara, un comité de ética y uno científico, reglamento interno de funcionamiento, sistema de garantías de protección de muestras e información clínica y biológica y un documento con las características físicas y ubicación del mismo. Además, debe contar con un equipo organizativo que vele por la adecuada gobernanza de este, el cual lo conformaría: un titular, un director científico y un responsable del tratamiento de datos (1). En la Figura 1 se muestra cómo sería una adecuada articulación para el correcto funcionamiento y el flujo de entrada y salida de las muestras.
Consentimiento informado: ¿Cuál es el más apropiado?
El consentimiento informado es un documento legal con un gran trasfondo ético que sirve como intermediario entre los investigadores y los individuos implicados en algún proceso de investigación (29-31). En términos generales se ha descrito que este proceso se fundamenta en la necesidad que el paciente cuente con las competencias necesarias para el entendimiento pleno, que sea adecuadamente informado y que no exista coacción en la toma de decisiones (30,32). Lo anterior explica el objetivo mismo del consentimiento informado, puesto que ubica al donante como el protagonista.
Existen diferentes tipos de consentimiento que pueden ser aplicados a los biobancos, dentro de estos, el consentimiento específico que se usa para una investigación específica y que ha sido principalmente empleado en ensayos clínicos de intervención, por ende requiere información pertinente y detallada sobre las investigaciones; el consentimiento amplio para investigaciones futuras en las que no es posible ser muy detallados en el momento que se obtiene el mismo y generalmente aplica para una categoría de investigación especifica; el consentimiento parcialmente restringido para el uso de muestras biológicas y datos relacionados para fines específicos de investigación inmediata; el dinámico que busca explicar lo mejor posible al sujeto de investigación; y el consentimiento general, el cual es un permiso abierto sin ninguna limitación para el uso de las muestras biológicas, permitiendo el uso de su información según lo considere la gobernanza del biobanco (33-36).
Hoy en día diferentes personajes académicos han cuestionado el rigor ético de los consentimientos informados empleados en los biobancos, sobre todo lo relacionado con la protección de datos personales y comprensión por parte de los donantes (37-44). Es así como una revisión sistemática realizada por la Universidad de Michigan que incluyó 34 artículos, evidenció un pobre entendimiento de aspectos como riesgos implicados, acceso a los registros, confidencialidad, duración y devolución de resultados genéticos (45).
Un estudio publicado en el European Journal of Human Genetics en el 2013 analizó los diferentes aspectos entre el consentimiento ampliado vs el consentimiento dinámico. Este último, como su nombre lo indica, promueve un proceso dinámico entre donantes e investigadores en el que transmiten información en tiempo real sobre los proyectos de investigación y permiten a los participantes dar su consentimiento o revocarlo. La conclusión obtenida es que si bien el consentimiento informado dinámico tiene un gran potencial ético (46), el hecho de ser un proceso repetitivo acarrea el riesgo que los donantes se abstengan de participar por sentir que no es una decisión bien informada, no se revise adecuadamente las implicaciones éticas de cada proyecto de investigación o existan falsas expectativas; mientras que el consentimiento amplio, aparte de no ser inferior éticamente, no le resta valor a la investigación, planteándolo así como el modelo a elegir. (47).
Sin embargo, el debate ha continuado alrededor con el surgimiento de propuestas como el metaconsentimiento defendido por autores como Ploug y Holm que argumentan que, a diferencia del consentimiento amplio, su naturaleza flexible resuelve el problema de expiración en el que cae el anterior modelo al haber cambios en las estructuras de gobierno de los biobancos y los objetivos de las investigaciones. (48-49).
Por lo anterior, es importante tener presente las ventajas y desventajas de cada uno de los tipos de consentimientos informados, puesto que la elección del mismo se debe ajustar a las necesidades de cada biobanco, su contexto socio-económico, los investigadores y donantes y las proyecciones que tengan a corto, mediano y largo plazo (50) (Tabla 2).
Tabla 2 Tipos de consentimiento informado. Análisis de las ventajas y desventajas de cada uno en la conformación de los biobancos
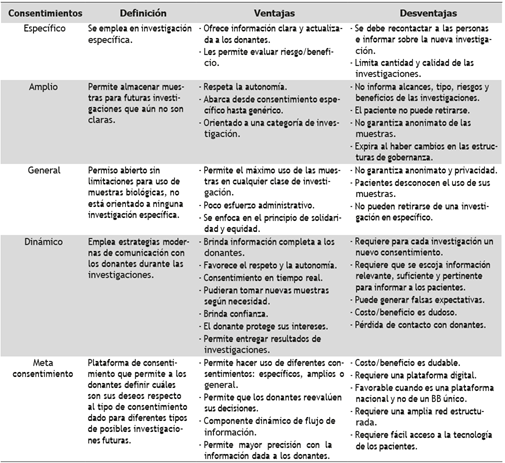
Fuente: creación propia
La Universidad de Antioquia es una de las instituciones de educación superior más importante en Colombia, desde su fundación en 1803 ha tenido como bandera la innovación al servicio de la comunidad y esto se ve reflejado en sus Facultades y Secciones, entre estas, la Sección de Dermatología de la Facultad de Medicina, creada en el año de 1963 donde el laboratorio de dermatopatología es uno de sus ejes centrales; este fue fundado en 1976 y está dedicado a los estudios de histopatología e inmunodermatología. Cuenta con más de 57.000 biopsias, incluyendo los informes patológicos, registros fotográficos, placas y bloques de los estudios de dermatopatología. El Laboratorio de Dermatopatología ha permitido el desarrollo de líneas de investigación en distintos ámbitos, siendo de resaltar la de linfomas cutáneos e inmunodermatología que día a día se fortalecen gracias al interés y compromiso de sus integrantes con la creación de proyectos que están orientados hacia el avance científico, la docencia y que resulten en beneficios para nuestros pacientes y la sociedad en general. La conformación y estructuración de un biobanco, permitirá que se optimice su potencial al servicio de la investigación traslacional.
Conclusión
Los biobancos han emergido como una estrategia vanguardista que tiene un alto potencial para la realización de investigaciones biomédicas, siendo significativamente valioso en el estudio de diversas enfermedades.
Su creación ha permitido el almacenamiento regulado de muestras biológicas, generando progreso para la ciencia y la sociedad. Estas son fundamentales para la investigación básica, epidemiológica y de traslación, pues la información que contienen posibilita a los investigadores entre muchos aspectos, uno de gran proyección que es la identificación de dianas terapéuticas que se basen en alteraciones moleculares de la enfermedad y que proporcionan nuevas opciones de diagnóstico, tratamiento y prevención, capaces de demostrar eficacia clínica. Por esa razón, las investigaciones apoyadas por los biobancos deben ser centradas en enfermedades que afectan a los colombianos y los resultados que se obtienen ir acompañados de políticas para impactar en la salud de la población.
Aunque en nuestro país no existe una legislación específica para los biobancos, la normatividad existente podría aplicarse para la instauración e implementación de estos, dando solución a los problemas éticos que pudieran surgir hasta poder instaurar una normatividad que permita un mejor acoplamiento entre la investigación con las muestras biológicas y el respeto por los derechos de los donantes. Lo anterior es sólo uno de los componentes que se deben regular, se deberá protocolizar todos los procedimientos, sistemas de gestión y lineamientos para acceder a su uso y así garantizar uniformidad.
Finalmente, reviste suma importancia la elección de un consentimiento informado acorde a la gobernanza del biobanco y que tenga como protagonista a los donantes, por lo que este proceso dependerá de las necesidades, contexto socioeconómico, investigadores, donantes y proyecciones del biobanco a corto, mediano y largo plazo, sin dejar de lado el rigor ético que implica el mismo.