Introducción
En el servicio de urgencias el dolor torácico es un motivo de consulta frecuente, representa el 10 % de las visitas y 25 % de ingresos hospitalarios anuales en Estados Unidos (1); su etiología varía desde condiciones benignas, la mayoría, hasta potencialmente mortales, incluyéndose en estas el síndrome coronario agudo (SCA). Es responsabilidad del clínico clasificar el riesgo de cada paciente y determinar si requiere manejo urgente o ambulatorio. La falta de diagnóstico oportuno de SCA se asocia a altas tasas de demandas al personal de la salud y un aumento del 25 % en mortalidad al alta (1).
En Colombia un tercio de las muertes son ocasionadas por enfermedades cardiovasculares. De estas, el 47,2 % son secundarias a enfermedad isquémica del corazón (EIC) (2). Según una revisión realizada entre los años 2010-2014 por el observatorio nacional de salud de Colombia, acerca de la carga de la EIC en el país, la incidencia de esta aumentó 8,2 % en mujeres y 13,2 % en hombres, convirtiéndose en un problema de salud pública creciente (3). Lo anterior evidencia la importancia de realizar un enfoque diagnóstico adecuado y un tratamiento oportuno. Para ello, en 2013 en Colombia se publicó la guía de práctica clínica con los lineamientos para SCA; sin embargo, esta hace uso de algoritmos basados en biomarcadores cardiacos y paraclínicos que no disponen la mayoría de primeros niveles de atención.
En Colombia se define como primer nivel de atención a aquellas instituciones que cuentan con personal en medicina general, técnico auxiliar y tecnología de baja complejidad (4). En 2004, el 84,3 % de instituciones prestadoras de servicio (IPS) públicas correspondían a dicho nivel (5). En las zonas rurales del país la mayoría de IPS son de este tipo, donde el electrocardiograma (ECG) y la semiología son los únicos instrumentos disponibles; a esto se adicionan otras dificultades como distanciamiento de los centros de intervención coronaria percutánea, localizados principalmente en zonas urbanas, lo que implica un gran reto para el clínico. Ante esta problemática es necesario contar con recomendaciones actualizadas y contextualizadas que puedan emplearse en sitios que no cuentan con biomarcadores.
En este artículo se realizará un abordaje diagnóstico basado en algoritmos útiles para contextos donde hay escasez de recursos. Este incluye anamnesis, examen físico, paraclínicos básicos y puntajes de probabilidad para ayudar al médico a tomar una conducta inmediata con el paciente. No se pretende desestimar el uso de biomarcadores, debido a que estos aumentan la sensibilidad del diagnóstico y determinan el manejo a seguir en SCA. Adicionalmente, un estudio realizado en el contexto de atención primaria en Holanda demostró su costo-efectividad en dicho nivel de atención, pues con su uso se reducen las remisiones innecesarias, los gastos por cada paciente que consulta por dolor torácico y el médico puede excluir con mayor certeza el SCA (6,7).
Factores de riesgo para SCA
Gran parte de la población objetivo de los primeros niveles pertenece a la zona rural. Se ha observado que este grupo poblacional presenta diferencias en los factores de riesgo, tasas más altas de ingreso hospitalario y muerte por enfermedad cardiovascular (ECV) al compararse con áreas metropolitanas (8,9). En estudios realizados en Australia y Estados Unidos se ha encontrado que estas diferencias están asociadas a variaciones en el acceso al sistema de salud, incluyendo terapias especializadas basadas en la evidencia, disparidad en el estado socioeconómico y mayor índice de algunos factores de riesgo como el tabaquismo, el consumo de alcohol y la obesidad.
No se encontraron trabajos en Colombia que evalúen los factores de riesgo de la población rural, pero existe un estudio realizado en población venezolana donde se comparan 52 individuos pertenecientes a la comunidad rural y 66 a la urbana. En este no se hallaron diferencias significativas en factores de riesgo de ECV (10). Sin embargo, cabe resaltar que en algunas poblaciones rurales colombianas existe poca accesibilidad a servicios de salud, mala infraestructura vial, pobreza extrema, baja escolaridad, factores que pueden influir en los desenlaces de la ECV (11).
En cuanto a Suramérica, un subestudio publicado en 2022 de la cohorte PURE (Prospective urban and rural epidemiological study) sobre los factores de riesgo para ECV que incluye participantes de comunidades rurales y urbanas de Argentina, Brasil, Chile y Colombia, evidenció que los factores que más se asocian al desarrollo de ECV son, en orden de importancia, la hipertensión, la obesidad abdominal, el tabaquismo, la baja fuerza y la diabetes mellitus; mientras que los más asociados a mortalidad son el tabaquismo, la hipertensión, la baja escolaridad, la obesidad abdominal y la diabetes mellitus (12).
Diagnóstico
La evaluación inicial del paciente requiere de anamnesis y examen físico dirigidos, ECG, biomarcadores cardiacos, aplicación de algoritmos rápidos de confirmación o exclusión y revisión de diagnósticos diferenciales (13). Debido a la pobre disponibilidad de biomarcadores en el primer nivel, los cuales son indispensables para la mayoría de algoritmos, la semiología y el ECG se convierten en la principal herramienta de trabajo del médico.
Por lo expuesto anteriormente se propone realizar una aproximación diagnóstica basada en anamnesis, examen físico, ECG y puntajes de riesgo que no incluyen biomarcadores; de esta manera se podrá tomar una conducta que beneficie al paciente.
Evaluación clínica
Anamnesis completa y precisa
Iniciar el interrogatorio indagando por antecedentes personales, en búsqueda de factores de riesgo para ECV como los mencionados anteriormente, teniendo en cuenta preguntar por historia de enfermedad coronaria, la cual se asocia con alta probabilidad del diagnóstico, resultado anormal en test de estrés miocárdico y enfermedad arterial periférica, los cuales presentan especificidad de 96-97 % respectivamente (14).
Se recomienda proceder con la caracterización del dolor, para lo cual se propone la mnemotecnia ALICIA FDA, esta se usa en semiología para descripción de cualquier tipo de dolor (Antiguedad, Localización, Irradiación, Características, Intensidad, Agravantes, Frecuencia, Duración y Asociados). En la Tabla 1 se realiza el ejercicio con dolor anginoso típico (15,16). Cabe resaltar que la irradiación del dolor a ambos brazos, cambio del dolor en las últimas 24 horas y presentación de dolor similar a isquemia cardiaca previa se asocian con valores predictivos positivos mayores de SCA (14,17).
Algunas personas pueden presentarse con síntomas atípicos, entre ellos palpitaciones, náuseas, vómito, epigastralgia, síncope, disnea y diaforesis. Esta última se catalogó como predictor fuerte SCA con (razón de probabilidad [LR] = 2,44) (14). En una revisión sobre el diagnóstico y tratamiento de SCA publicado en 2022 se encontró que no existe una mayor prevalencia de síntomas atípicos en mujeres y que pacientes diabéticos y ancianos tienen mayor probabilidad de presentar disnea en lugar de dolor torácico (18).
Examen Físico
Es importante determinar el estado hemodinámico, la presencia de inestabilidad cardiaca, arritmia o sobrecarga hídrica (14). Debe realizarse un examen físico sistemático: desde el ingreso a la inspección el paciente puede mostrarse ansioso, inquieto o intentando cambiar su postura para mejorar el dolor, comúnmente asociado a palidez, diaforesis y frialdad distal (16).
Con respecto a los signos vitales, estos pueden ser variables. En muchos pacientes son normales en la primera hora de desarrollo de los síntomas. La hipotensión es el signo clínico más asociado con SCA (17). En el 25 % de los casos de infarto de la cara anterior hay hiperreactividad simpática y se presenta taquicardia e hipertensión, mientras que en la mitad de los infartos de cara posterior se observa hiperreactividad parasimpática, manifestada con bradicardia e hipotensión (16).
En cuanto a la revisión de la región precordial se ha encontrado que la reproducción del dolor con la palpación reduce la probabilidad de SCA (17). Por otra parte, es fundamental la auscultación, pues encontrar un tercer o cuarto ruido se asocia a disfunción ventricular, al igual que la aparición de nuevos soplos, principalmente regurgitación mitral, puede ser sugestivo de SCA.
Paraclínicos e imágenes en primer nivel
ECG
El ECG de 12 derivaciones tiene una especificidad de 91 % y una sensibilidad de 32 % en el diagnóstico de SCA (17). A pesar de su baja sensibilidad es la principal herramienta diagnóstica en pacientes con sospecha de SCA. Debe tomarse en los primeros 10 minutos desde el ingreso a urgencias. Proporciona información importante sobre la presencia, extensión y gravedad de la isquemia miocárdica. Si el paciente cuenta con ECG previos deben revisarse para detectar la presencia de hallazgos nuevos (13,19). El segmento ST permite realizar la clasificación de infarto agudo del miocardio con elevación del segmento ST (IAMCEST) y sin elevación de este.
Elevación del ST
Clásicamente ocurre de manera convexa. Para determinar la elevación se utiliza el punto J como referencia (unión entre la terminación del QRS y el inicio del ST), según el consenso de la cuarta definición de infarto en pacientes con línea de base estable, el segmento TP ha demostrado ser preciso para evaluar la magnitud del cambio del ST y distinguir pericarditis. El hallazgo compatible con SCA es una nueva elevación en el punto J en dos o más derivadas contiguas, que correspondan a un territorio. El punto de corte es >1 mm en todas las derivaciones, exceptuando V2V3, donde en hombres menores de 40 años debe ser >2,5 mm, en hombres mayores de 40 años >2,0 mm y en mujeres de cualquier edad >1,5 mm. La elevación puede acompañarse de depresión del segmento ST recíproca (19). Existen causas no isquémicas de elevación del segmento ST como la preexcitación, la miocarditis, entre otras, detalladas con sus características diferenciales del SCA en la Tabla 2 (20,21).
Equivalentes a elevación del ST
Son patrones electrocardiográficos que han demostrado estar asociados con oclusión completa de diversas arterias, por lo que ante su presencia se requiere revascularización emergente (22). Entre ellos se encuentran el síndrome de de Winter, caracterizado por una depresión >1mm del ST precedido por ascenso del mismo y onda T picuda simétrica; el infarto posterior donde se evidencia depresión ST >0,5 mm de V1-V3; el infarto del tronco coronario el cual presenta depresión del ST >1 mm en 8 o más derivaciones con ST ascendido en V1 o AVR (Figura 1) (23), el síndrome de Wellens consistente con un ST isoeléctrico o mínimamente elevado <1 seguido por un ST cóncavo y finalmente una T invertida simétrica. Existe el tipo A y B, y este último tiene una presentación más común (24); también se han descrito las ondas de activación retardadas y la inestabilidad precordial caracterizada por ondas T verticales en V1 cuya amplitud es mayor a las de V6 (22).
Tabla 2: Causas no isquémicas de elevación del segmento ST
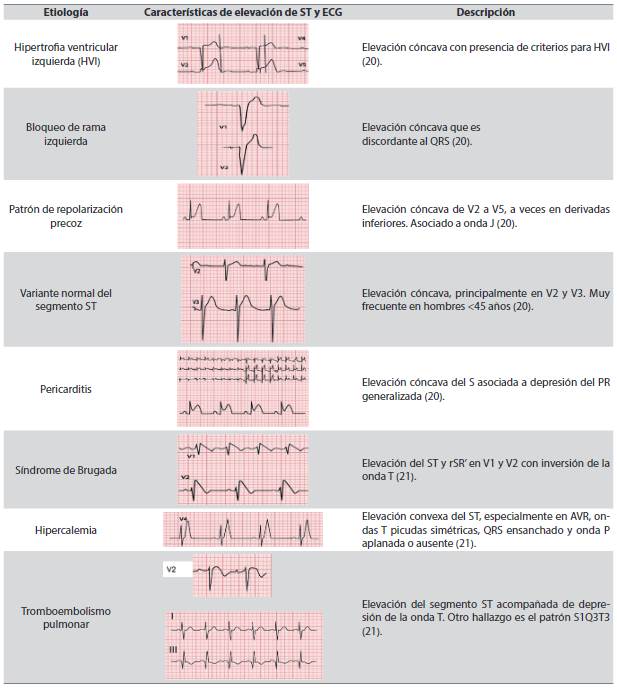
Fuente: creación propia, electrocardiogramas dibujados por la diseñadora Ana García Uribe.
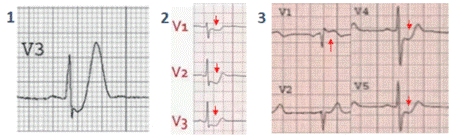
Figura 1: Patrones electrocardiográficos equivalentes a la elevación del segmento ST. El caso 1 corresponde al Patrón de de Winter, caracterizado por la depresión del segmento ST seguido de una onda T picuda en derivadas precordiales. El caso 2 evidencia un infarto posterior dado por infradesnivel del ST en V1-V3, y el caso 3 expone un compromiso del tronco determinado por elevación del ST en V1, asociada al infradesnivel del ST en al menos 8 derivaciones. Fuente: imágenes obtenidas de archivos personales de Dr. Carlos José Jaramillo, previa autorización
Bloqueo de rama y SCA
Las guías americanas de la AHA (American Heart Association) de 2013 sobre el manejo del IAMCEST se dejó de considerar el bloqueo de rama izquierda (BRIHH) de nueva aparición como equivalente a elevación del segmento ST debido al número de falsos positivos (25). Ante la presentación de este, el diagnóstico debe confirmarse con el apoyo de troponinas o ecocardiografía. Además, a la hora de analizar el ECG se deben tener en cuenta los criterios de Smith o Sgarbossa modificados, cuya sensibilidad y especificidad alcanzan respectivamente el 91 % y 98 % para el diagnóstico de SCA (26). También pueden usarse los criterios de Cabrera-Friedland o el signo de Chapman-Pearce (27). En cuanto al bloqueo de rama derecha del haz de Hiss (BRDHH), si bien las guías americanas o europeas hasta la fecha no recomiendan considerarlo como equivalente a elevación del ST o isquemia aguda, se han reportado casos de BRDHH de nueva aparición asociado a dolor torácico en el contexto de infarto agudo de miocardio (IAM) con lesiones críticas de la arteria descendente anterior (28).
Otros cambios
Se deben tener en cuenta hallazgos como depresión del segmento ST > 0,5 mm, inversión de la onda T >1 mm con onda R prominente o relación R/S >1, estos en dos derivaciones contiguas. Ondas Q patológicas >30 ms y >0,4 mv, tradicionalmente representaban infarto antiguo, ahora se sabe que hasta la mitad de los pacientes con IAMCEST las presenta transitoriamente (19).
En pacientes con síntomas típicos y ECG no diagnóstico deben tomarse adicionalmente derivadas posteriores y derechas; los que presentan síntomas persistentes requieren seguimiento electrocardiográfico cada 15-30 minutos en las primeras 1 a 2 horas posteriores a la consulta inicial (13,19).
Hemograma
Es útil para descartar anemia o infecciones como causas primarias o agravantes del SCA. Se ha demostrado que un recuento leucocitario mayor a 10.000 en las primeras horas de un IAM es un predictor independiente para mortalidad total a largo plazo (29).
Creatinina
Es necesaria para estratificar el riesgo del paciente con herramientas como GRACE (The global registry of acute coronary events) (13).
Glucemia
La hipoglucemia puede aumentar la mortalidad y el tamaño del infarto. Se ha asociado a valores de presión arterial mayores, aumento del estrés oxidativo y catecolaminas, deterioro de la función endotelial y activación de la vía de la coagulación (30).
Radiografía de tórax
Es útil para evaluar signos de embolismo pulmonar, disección aortica, falla cardiaca, principalmente el edema pulmonar, y para descartar diagnósticos diferenciales como neumonía, neumotórax o fracturas costales (31).
Probabilidad de presentar SCA
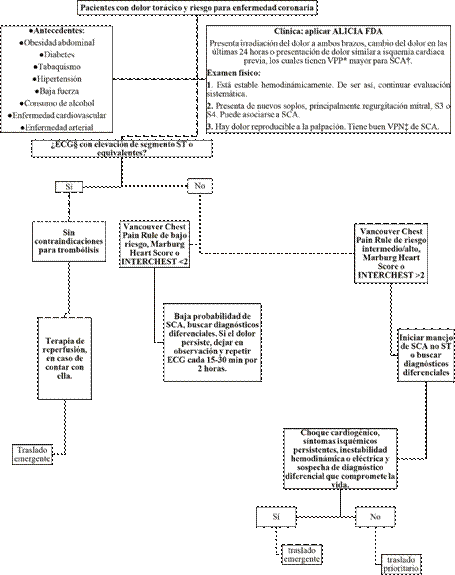
Las escalas de predicción clínica surgen ante la necesidad de clasificar de manera adecuada y rápida el riesgo de que un paciente con dolor torácico presente SCA, lo que permite al clínico tomar decisiones acertadas sobre la necesidad de intervenciones adicionales intra o extrahospitalarias. Se han desarrollado diversos instrumentos con este fin, incluyendo escalas como TIMI (Thrombolysis in myocardial infarction) y GRACE (32); ambas se ajustan a la población de Colombia, con la diferencia de que la última ha demostrado mejor desempeño en la predicción de riesgo a los 6 meses (33). Lamentablemente, en el contexto del primer nivel colombiano estos modelos no son útiles debido a que requieren biomarcadores cardiacos.
Existen diferentes herramientas que se han creado para la atención primaria en el contexto extrahospitalario, donde los recursos son mínimos, entre ellas están Marburg Heart Score (MHS) e International Working Group on Chest Pain Primary in Primary Care (INTERCHEST) (34) (Tabla 3). Por otra parte, el puntaje de predicción Vancouver Chest Pain Rule también podría adaptarse a este escenario.
Tabla 3: Herramientas para el diagnóstico de SCA

* Enfermedad coronaria, enfermedad vascular oclusiva o enfermedad cerebrovascular. † Definido como ausencia de aplanamiento de la onda T, inversión de T en 2 derivaciones contiguas, depresión ST (0,05 mV) en dos derivaciones contiguas, elevación de ST >0,1 mV en derivaciones de extremidades o >0,2 mV en derivaciones precordiales, presencia de bloqueo de rama izquierda, o hipertrofia ventricular izquierda. ‡ No irradiado, pleurítico o con dolor a la palpación. Fuente: elaboración propia
Marburg Heart Score
Para desarrollar una puntuación de predicción clínica que permitiera determinar el riesgo de enfermedad coronaria se utilizó una cohorte multicéntrica de pacientes que consultaban por dolor torácico a centros de atención primaria de un estado alemán; posteriormente para validar dicho puntaje, se usó una cohorte externa de pacientes en el contexto de atención primaria en Suiza. Se considera paciente de alto riesgo si presenta ≥3 puntos, y de bajo riesgo ≤2. Con esta herramienta se obtuvo una sensibilidad del diagnóstico de 86,4 % (IC 95 % 78,5 %-91,7 %), una especificidad del 75,2 % (95 % IC 71,8 %-78,3 %), un valor predictivo positivo (VPP) de 34,9 % (IC 95 % 29,3 %-40,9 %) y un valor predictivo negativo (VPN) 97,3 % (IC 95 % 95,5 %-98,4 %), con una tasa de falsos negativos de 2,7 %. Cuando se consideró alto riesgo ≥2, se aumentó la sensibilidad hasta el 100 % con una caída significativa de la especificidad. En la cohorte de validación se obtuvieron resultados similares con sensibilidad del 87,1 % (IC 95 % 79,9 %-94,2 %), especificidad del 80,8 % (95 % IC 77,6 %-83,9 %) (35).
En 2019 se realiza una revisión sistemática sobre las escalas de predicción clínica existentes en el contexto de la atención primaria. Se encontró que MHS tiene un nivel de evidencia 2 según la definición de Mount-Sinai Evidence-Based Medicine Working Group, lo que implica que puede ser usada certeramente en pacientes de bajo riesgo con dolor torácico intermitente. La desventaja de esta escala es que está diseñada principalmente para dolor torácico intermitente y no agudo, por lo que no existe evidencia suficiente para usarla como herramienta que descarte SCA (36).
INTERCHEST
Es un metaanálisis que se realizó a partir del análisis de 5 cohortes de 5 estudios diferentes, incluyendo finalmente 3.099 pacientes, con el objetivo de identificar factores que permitieran realizar una escala de predicción clínica para detectar el riesgo de enfermedad coronaria en pacientes con dolor torácico, todo ello en el contexto de la atención primaria.
Se evidenciaron 6 predictores, de los cuales 5 son positivos (historia de enfermedad coronaria, edad ≥55 años en hombres o ≥65 en mujeres, dolor torácico desencadenado por esfuerzo, sospecha diagnóstica inicial del clínico de condición grave y disconfort torácico expresado como opresivo) y uno es negativo (la presencia de dolor reproducible a la palpación). Cada ítem positivo suma un punto y el negativo resta uno. Se determinó como bajo riesgo un puntaje <2, con el cual había una probabilidad de 2,1 % (95 % IC 1,1-3,9) de presentar enfermedad coronaria, mientras que un puntaje ≥2 incrementa la probabilidad a 43,0 % (95 % IC 35,8-50,4.) con VPP de 43 % y un VPN de 97,9 %. La sensibilidad fue igual a 88,2 % (95 % IC 79,5-93,6) y la especificidad 82,2 % (95 % IC 78,7-85,2) (37)
Esta escala tiene como ventaja que es fácil de usar y que toma datos de estudios de 5 poblaciones diferentes. Sin embargo, en la revisión sistemática mencionada anteriormente se concluyó que, a pesar de que el estudio cuenta con una buena sensibilidad y especificidad, su nivel de evidencia es 4 debido al riesgo de sesgo por pérdida de datos en 20 % de los pacientes (36).
Vancouver Chest Pain Rule
Es una regla diseñada para identificar pacientes con muy bajo riesgo de SCA dentro de las primeras 2 horas posteriores al ingreso al servicio de urgencias. Se define como paciente de bajo riesgo aquel con una edad <40 años, sin antecedente de enfermedad cardiovascular y con un ECG inicial normal, este último dado por la ausencia de aplanamiento de la onda T, inversión de T en 2 derivaciones contiguas, depresión ST>0,05 mV en 2 derivaciones contiguas, elevación de ST>0,1 mV en derivaciones de extremidades o >0,2 mV en derivaciones precordiales, presencia de bloqueo de rama izquierda, o hipertrofia ventricular izquierda. Tiene una sensibilidad del 98,8 % (38). Posteriormente fue validado por otros estudios donde se encontró una sensibilidad de 95,1 %, un VPP del 23,3 % (IC 95 % 21,1-25,5) y VPN de 98,6 % (IC 95 % 95,9-99,5) (39).
Las ventajas que tiene este algoritmo es que cuenta con validez externa en otras poblaciones, además de que es rápido y fácil de usar. Entre las desventajas cabe señalar que se realizó basado en una cohorte urbana de primer mundo con grandes comorbilidades asociadas, tales como IAM en el 24,2 % y angina previa en el 35,9 % de los casos (39), esto difiere de la población general colombiana, donde la incidencia de EIC es de 424,6 por cada 100.000 habitantes (0,4 %) (3). En caso de que el paciente sea mayor de 40 años o de que no pertenezca a la categoría de bajo riesgo, requeriría estudios adicionales en un mayor nivel de complejidad.
Diagnóstico diferencial
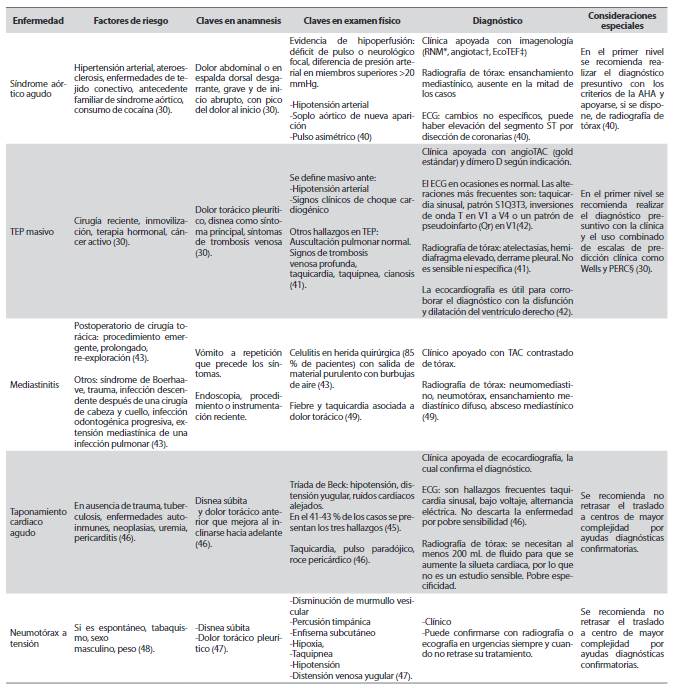
Del total de pacientes que consultan por dolor torácico en el contexto de atención primaria, el 1,5 a 3,5 % presentan SCA o IAM, el resto puede cursar con enfermedades respiratorias (10,3-18,2 %), síndrome de la pared torácica (24,5-49,8 %), enfermedad coronaria estable (6,6-11,2 %), trastornos gastrointestinales (5,6-9,7 %), trastornos esofágicos (6,0-7,1 %), etiologías psicógenas (9,5-18,2 %), entre otras (40). En el contexto de urgencias es de vital importancia reconocer tempranamente aquellas condiciones que se manifiestan como dolor torácico y pueden comprometer la vida, incluyendo neumotórax, síndrome aórtico agudo, miopericarditis, embolismo pulmonar y ruptura esofágica. En algunos casos extraños el IAMCEST puede ser secundario a síndrome aórtico agudo (31). En esta situación la trombólisis estaría contraindicada, por lo que es importante descartar su presencia. En la Tabla 4 se exponen algunas enfermedades potencialmente mortales que deben evaluarse (31,41-50).
Indicaciones de traslado a un nivel de mayor complejidad
Teniendo en cuenta el enfoque realizado previamente, deben ser remitidos de forma emergente a instituciones de mayor complejidad aquellos pacientes que presenten elevación del segmento ST o sus equivalentes y en los que se sospeche un diagnóstico diferencial que pueda comprometer la vida. Además, requieren traslado no emergente, pero si prioritario, aquellos en quienes, después de realizar las escalas de predicción, presenten MSH >2, INTERCHEST >2 o un Vancouver Chest Pain Rule de riesgo intermedio/alto, debido a que requieren estudios adicionales. Lo anterior se resume en el algoritmo de la Figura 2.
Conclusiones
Existen pocas herramientas que permitan descartar de manera segura el SCA en un primer nivel de atención, valiéndose únicamente de la clínica y el ECG. Entre estas se encuentran el Vancouver chest pain rule, el INTERCHEST y la escala MSH. Estas dos últimas descartan enfermedad coronaria y no SCA. Aunque la escala MSH es la que ha demostrado mayor evidencia, cuenta con la limitación de estar desarrollada en el contexto de dolor torácico intermitente y no agudo. El INTERCHEST, por su parte, tiene riesgo de sesgo por pérdida de datos, y el Vancouver chest pain rule solo permite descartar el riesgo en pacientes menores de 40 años.
A pesar de lo anterior, en instituciones de primer nivel donde los recursos son escasos, estas herramientas son de apoyo al clínico para la toma de decisiones, por lo que se plantea un algoritmo diagnóstico incluyendo la historia clínica, el examen físico, los hallazgos electrocardiográficos y estas escalas. Cabe resaltar que no se pretende desestimar el uso de biomarcadores en los lugares que cuenten con estos, y por el contrario se considera importante enfatizar en la necesidad de implementar troponinas en el primer nivel, puesto que su uso ha demostrado ser costoefectivo en este escenario (7).