Introducción
El hipercortisolismo endógeno es poco frecuente en pediatría: la incidencia global es de 2 a 5 casos por millón de personas al año, y solo el 10% de estos ocurren en niños, siendo más frecuente la enfermedad de Cushing (EC) (1-3). Las manifestaciones clínicas en pediatría por exposición prolongada al cortisol son: ganancia de peso asociado al retraso en la velocidad de crecimiento (4,5), cara de luna llena, joroba de búfalo, hirsutismo, estrías violáceas mayores a 1 cm, fatiga, cefalea, hipertensión, hipotrofia muscular, entre otras (Tabla 1).
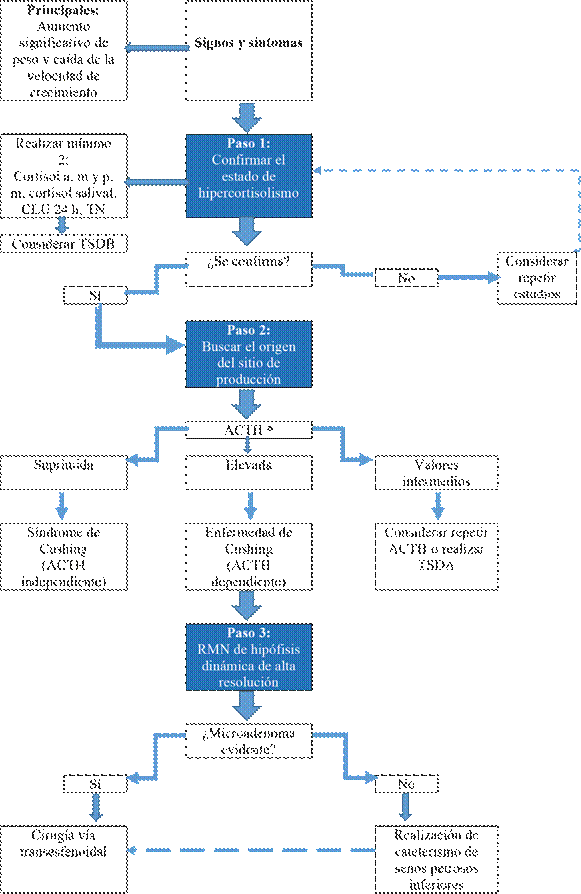
Ante la presencia de un paciente con estos síntomas se sugiere realizar una secuencia diagnóstica en tres pasos (4-7). Primero se debe demostrar la pérdida de ciclicidad del cortisol (o hipercortisolismo) con: estudios de dicha hormona en la mañana y en la tarde, cortisol libre urinario (CLU) en 24 horas, test de Nugent (TN), test de supresión a dosis bajas con dexametasona (TSDB) o cortisol salival. Se sugiere realizar mínimo dos pruebas en diferentes tiempos.
Tras comprobar que el cortisol se encuentra inapropiadamente elevado se busca, en segunda instancia, el origen de su producción, midiendo los niveles de la hormona adrenocorticotropa o ACTH, con el fin de confirmar si es de origen hipofisiario o suprarrenal/tumor ectópico. En caso de obtener una ACTH inapropiadamente elevada (>15 pg/ml) por pérdida del feedback se diagnostica EC.
Finalmente, como último paso diagnóstico se realiza una RMN de hipófisis para comprobar la presencia de un microadenoma. En caso de dudas en la interpretación de los niveles de ACTH se recomienda repetir la prueba o realizar el test de supresión a dosis altas con dexametasona (TSDA), conocido también como test de Liddle (ver Tabla 2 y resumen de los 3 pasos diagnósticos en la Figura 1).
Tabla 2 Estudios más frecuentes usados en el paciente con sospecha de Cushing
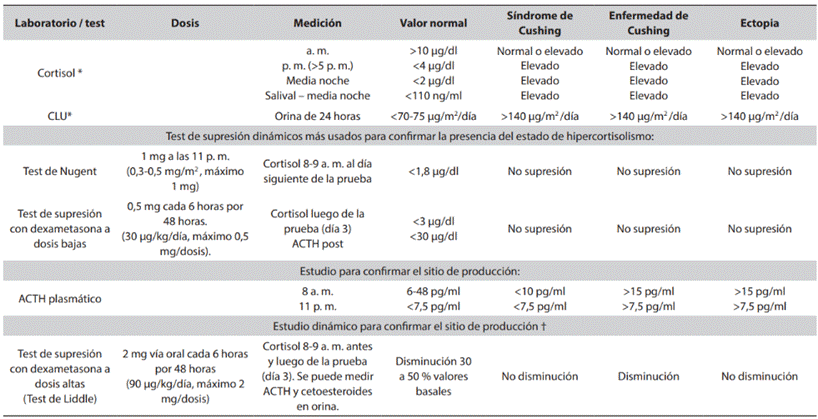
* Estudios iniciales para confirmar hipercortisolismo (se sugiere combinar mínimo 2 pruebas y repetirlas en varias ocasiones si los estudios iniciales son normales). Resultado de CLU para comprobar hipercortisolismo patológico es más de 2 veces el valor de referencia. En caso de un CLU entre 1 a 2 veces el valor normal, pensar en pseudo-Cushing. † Estudio más usado en caso de que el valor de la ACTH no discrimine el sitio de producción de cortisol. Hay una modificación del test con una dosis alta única de dexametasona (8 mg), pero es usada frecuentemente en adultos. Fuente: creación propia. Modificado de referencias (1,5,7,10,13)
El propósito de este artículo es describir tres casos clínicos de pacientes pediátricos con EC y mostrar la secuencia diagnóstica realizada.
Consideraciones éticas
Para este trabajo se siguieron las normas sobre aspectos éticos de la investigación en seres humanos. El estudio fue aprobado por el Comité de Ética Médica del Hospital Infantil Napoleón Franco Pareja en Cartagena, Colombia. Se conservó la confidencialidad de los pacientes de este reporte.
Reporte de casos
Caso N°1
Paciente masculino de 10 años y 1 mes de edad. Consulta porque tiene 6 meses de evolución de aumento progresivo de peso y disminución de la velocidad de crecimiento. No hay antecedentes personales ni familiares de importancia.
Examen físico (EF): talla 133,5 cm (-0,8 desviación estándar [DE]), peso 45,7 kg (+1,2 DE), índice de masa corporal (IMC) 25,8 kg/m2 (+2,9 DE), tensión arterial (TA) 145/90 mmHg, facies con cara de luna, joroba de búfalo, acantosis nigricans, hipertricosis, hipotrofia muscular y plétora facial. Los resultados de los estudios se presentan en la Tabla 3.
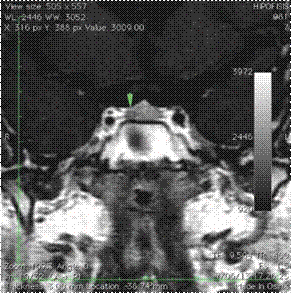
Fuente: creación propia
Figura 1: Secuencia diagnóstica en el paciente con sospecha de EC * En el estado de hipercortisolismo la ACTH se considera elevada si es mayor a 15 pg/ml, y suprimida si es menor a 10 pg/ml.
Tabla 3: Resultados de estudios hormonales del paciente 1

*Valor de referencia tomado de Tabla 2. Fuente: creación propia
Estudios de imágenes: edad ósea de 9 años y 6 meses. La RMN en silla turca dinámica (con equipo de 3,0 Teslas) mostró una lesión de 4 mm hipocaptante (Figura 2).
Caso N°2
Paciente femenina que asiste a consulta a los 10 años y 8 meses de edad por presentar cuadro clínico de plétora, disminución de velocidad de crecimiento, aumento progresivo de peso y cansancio. Sin antecedentes personales ni familiares relevantes.
EF: talla 128 cm (-2,7 DE), peso 33 kg (-0,8 DE), IMC 20,6 kg/m2 (+ 0,5 DE), TA 135/90 mmHg, cara redondeada, joroba de búfalo, hipotrofia muscular, hipertricosis generalizada, Tanner mamario II y púbico I. Los resultados de los estudios se encuentran en la Tabla 4.
Tabla 4: Resultados de estudios hormonales del paciente 2

*Valor de referencia tomado de Tabla 2. Fuente: creación propia
Estudio de imagen: RMN de hipófisis (con equipo de 3,0 Teslas) que mostró lesión hipocaptante de 3 mm de diámetro.
Los resultados iniciales (Tabla 4) no son concordantes con hipercortisolismo (inicialmente la lesión hallada con RMN se considera como incidentaloma). A los 11 años y 7 meses persiste la obesidad asociada a una mala velocidad de crecimiento, por lo que se realiza TN: cortisol 20 µg/dl (no ocurre supresión).
Diagnóstico: EC cíclico
Tratamiento: debido a los estudios iniciales fue manejada con ketoconazol 800 mg/día, con mejoría momentánea. A los 12 años y 5 meses se realiza cirugía transesfenoidal por considerarse EC cíclico (Figura 3).
Patología: adenoma hipofisiario corticotropo.
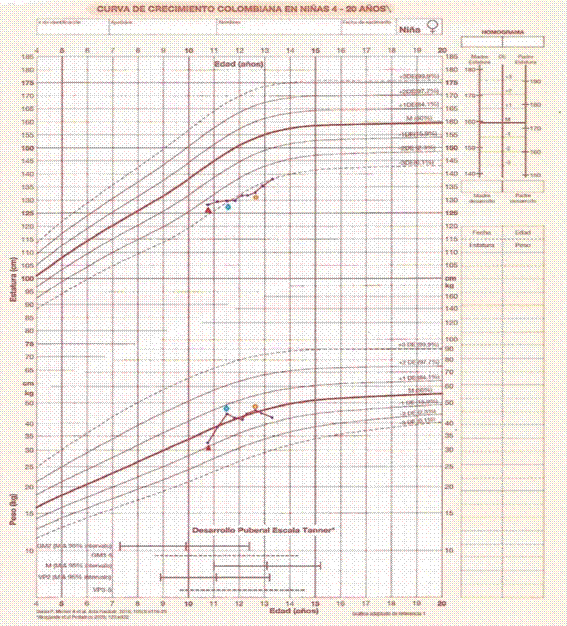
Figura 3: Gráfica del paciente 2. Nótese el aumento de peso exagerado con alteración en la velocidad de crecimiento en los primeros meses. Triángulo rojo: primera consulta. Rombo azul: inicio de ketoconazol. Círculo amarillo: cirugía transesfenoidal. (Fuente de la imagen: Durán P, Merker A, Briceño G, Colón E, Line D, Abad V, et al. Colombian reference growth curves for height, weight, body mass index and head circumference. Acta Paediatr. 2016 Mar;105(3):e116-25. DOI: https://doi.org/10.1111/apa.13269)
Caso N°3
Paciente femenina de 12 años y 9 meses de edad que ingresa a urgencias por un cuadro clínico de 18 horas de evolución, consistente en dolor torácico de tipo opresivo y de intensidad moderada, el cual se exacerba con la deambulación y está acompañado de diaforesis, náuseas y cefalea. Se nota el aumento de peso y mala velocidad de crecimiento. No hay antecedentes personales ni familiares de importancia.
EF: peso 42 kg (-0,2 DE), talla: 138 cm (-2,7 DE), IMC: 22 (+1 DE), TA: 140/90 mmHg, facies con cara de luna, joroba de búfalo, acantosis nigricans, hipertricosis, plétora facial, sin estrías. Estudios resumidos en Tabla 5.
Estudio de imagen RMN de hipófisis (con equipo de 3,0 Tesla): normal.
Se remite a centro de cuarto nivel donde se realiza cateterismo de senos petrosos inferiores (CSP) con vasopresina. Se presentan los resultados resumidos y su interpretación en la Tabla 6.
Tabla 5: Resultados de estudios hormonales del paciente 3
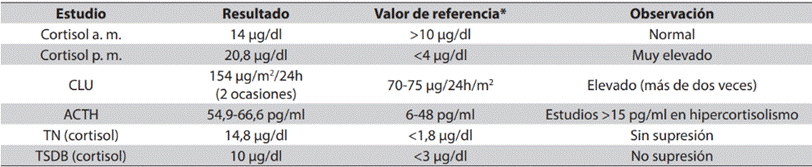
*Valor de referencia tomado de Tabla 2. Fuente: creación propia
Diagnóstico: EC
Tratamiento: se realiza cirugía transesfenoidal por microadenoma lateralizado en hemi-hipófisis derecha.
Patología: adenoma corticotropo.
En los tres casos el seguimiento anual se ha realizado con cortisol a. m.-p. m., CLU 24 horas TN y RMN de hipófisis, sin recidiva hasta el momento.
Discusión
La EC es una entidad muy rara antes de los 18 años, y es causada frecuentemente por microadenomas de ACTH (4,5,8). En cuanto a las manifestaciones clínicas, en los tres pacientes se destaca la detención de la velocidad de crecimiento y el aumento de peso progresivo (6,7). En la obesidad exógena de causa no endocrina se observa aumento de peso, pero sin compromiso de estatura (9). Otras manifestaciones frecuentes observadas en los casos reportados fueron cambios faciales, hipertensión, hipotrofia muscular y una edad ósea atrasada (6,7).
En cada uno de los casos se llevó a cabo la secuencia diagnóstica presentada en la Figura 1. Se demostró el estado de hipercortisolismo para luego confirmar el sitio de producción y, finalmente, realizar imágenes (3,5-7,10). En ocasiones puede haber resultados hormonales normales, como ocurrió en el caso 2, por lo que se sugiere una EC cíclica (enfermedad con concentraciones de cortisol fluctuantes e impredecibles), lo que hace difícil realizar el diagnóstico oportuno, por lo que se sugiere repetir estudios ante su sospecha (6,10-12).
Las pruebas de supresión tienen algunas desventajas en pediatría, tales como la necesidad de hospitalización, el estrés en el paciente y posibles errores de interpretación (13). En el caso 1 se observó un TSDB inicial con respuesta fisiológica de supresión, lo que dio lugar a una confusión inicial en el diagnóstico.
En el caso 3 los estudios hormonales confirmaron EC (3-5,8), pero la RMN de hipófisis no evidenció lesión, por lo que se recurrió a realizar un CSP para medir los niveles de ACTH (6,14). Se pudo observar una diferencia marcada de ACTH entre el CSP derecho y el CSP izquierdo (Tabla 6).
Al realizar el diagnóstico de EC el tratamiento de primera línea es la resección quirúrgica del microadenoma (frecuentemente por vía transesfenoidal) (6,7,15). También se han usado tratamientos médicos como el ketoconazol (7,16), aunque con baja efectividad y alto riesgo de efectos secundarios (17,18). Normalmente este manejo farmacológico (poco usado en EC) y la radioterapia son de segunda línea, sugeridos en pacientes en los cuales es imposible realizar el tratamiento quirúrgico, o cuando hay recidiva (7,16,19).
El pronóstico de la EC es favorable y frecuentemente se logra la remisión completa posterior a la cirugía (15). La mayoría de los pacientes alcanzan una talla adulta dentro de su rango objetivo (20). Es importante realizar un seguimiento estricto de los casos evaluando con estudios hormonales e imágenes periódicas, para descartar recidivas (6,15).
Conclusión
La EC es una entidad muy rara en la población infantil. Ante la sospecha de un paciente pediátrico con hipercortisolismo se debe hacer el cribado con varios estudios como cortisol a. m.-p. m., CLU 24 horas, TN y cortisol salival, para luego buscar el sitio de producción de la enfermedad (ACTH, TSDA) y finalmente realizar imágenes (RMN de hipófisis) en búsqueda de la presencia de un microadenoma. La cirugía transesfenoidal sigue siendo el tratamiento curativo de elección. En los casos descritos no se ha demostrado recidiva de la enfermedad. Es interesante conocer cuál será la estatura final alcanzada en cada uno de los pacientes.