Introducción
La mayoría de los eventos notificados de hiperinfección por Strongyloides stercoralis (SHS) se han descrito en pacientes con virus linfotrópico humano de células T tipo 1 (HTLV-1) y en quienes reciben corticosteroides a dosis altas (1). La infección por el virus de inmunodeficiencia humana (VIH) se asocia con cuadros de diarrea crónica, siendo el SHS una condición relatada en pocos casos y asociada a otras condiciones independientes del estado de inmunosupresión (2,3). Esta enfermedad parasitaria puede manifestarse en formas graves y como consecuencia de la pérdida de la integridad de la pared intestinal de la persona que vive con VIH, por la penetración de larvas filariformes (con la probabilidad de complicarse con infecciones bacterianas y, a su vez, desencadenar estados sépticos y desenlaces fatales posteriores) (4). Por tal motivo, se presenta el caso de un paciente con diagnóstico de novo de infección por VIH en quien se documenta un SHS.
Presentación de caso
Paciente masculino de 30 años, mestizo, procedente de zona urbana, quien consulta por la presencia de masa en región cervical derecha con 2 meses de evolución, indolora, asociada a síntomas constitucionales dados por astenia, pérdida de aproximadamente 7 kg en dicho intervalo de tiempo, con posterior aparición de dolor abdominal tipo cólico generalizado, distensión y constipación, sin otra sintomatología relatada. Dentro de los antecedentes personales sólo se destaca la historia de colecistectomía laparoscópica.
En el examen físico de ingreso se registran los siguientes signos vitales: presión arterial de 100/50 mmHg, pulso de 80 latidos por minuto, frecuencia respiratoria de 18 respiraciones por minuto, temperatura de 36 °C, con saturación adecuada al medio ambiente, con hallazgo positivo de una masa pétrea en región cervical derecha, inmóvil, indolora y múltiples adenopatías axilares de pequeño tamaño, blandas e insensibles. A nivel abdominal se halla una marcada distensión, ascitis grado II, sin masas palpables y ausencia de signos de irritación peritoneal, sin documentarse otros hallazgos al examen clínico.
Dentro de las ayudas diagnósticas de ingreso se destaca un hemograma con leucocitos de 6.700 células/μL, neutrófilos de 3.800 células/μL; linfocitos de 2.400 células/μL, eosinófilos 0 células/μL, hemoglobina 14,6 g/dL y plaquetas 308.000 células/μL. Se observa una función renal normal sin alteración electrolítica, un perfil hepático con TGO de 61 UI/L, TGP de 56 UI/L, albúmina de 3,2 g/dL, sin otras alteraciones. Se solicitó una prueba rápida y posterior confirmatoria para VIH, las cuales fueron positivas, por lo cual se hizo un conteo de CD4, que fue de 402 células/μL, y una carga viral de 132,145 copias/mL.
Por el diagnóstico de novo de inmunosupresión secundaria se sospechó enfermedad linfoproliferativa, por lo cual se solicitaron estudios de extensión. Entre ellos se incluyó una tomografía de cuello, tórax y abdomen, que evidenció adenopatías cervicales, retroperitoneales, masas y nódulos mesentéricos de aspecto metastásico. Se realizó la biopsia de una adenopatía, cuya descripción informó linfoma de Hodgkin de celularidad mixta.
Ante los síntomas gastrointestinales y la sospecha de una lesión ocupante a nivel colónico se solicitó una colonoscopia, con biopsia confirmatoria de linfoma B difuso de células grandes de tipo centro germinal. Ante estos hallazgos, el paciente fue valorado por el área de hematología, que inició manejo con altas dosis de esteroides por diagnóstico de enfermedad linfoproliferativa. Posteriormente se realizó un aspirado de médula ósea para descartar compromiso a este nivel, tras lo que se destacó la presencia de la larva filariforme extracelular compatible con Strongyloides stercoralis (Figura 1). Por lo anterior, se sugirió la realización de un coprológico seriado que documentó cadáveres de larvas de Strongyloides stercoralis (Figura 2). Durante la hospitalización se tomaron otros estudios complementarios que descartaron infecciones oportunistas.
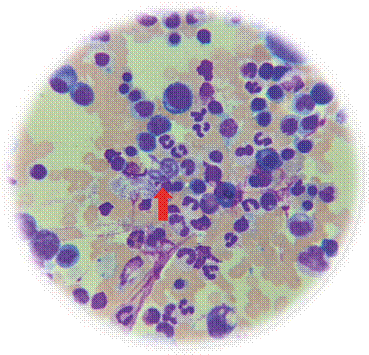
Fuente: creación propia.
Figura 1: Imagen de aspirado de médula ósea con maduración normoblástica completa con eosinófilos 6 %. Se destaca la observación de larva filariforme extracelular compatible con Strongyloides stercoralis.

Fuente: creación propia
Figura 2: Muestra de uno de los coprológicos seriados. Se destaca la observación de un cadáver de larva filariforme que recuerda las de Strongyloides stercoralis
El paciente fue valorado por el área de infectología, que consideró iniciar de manera conjunta tratamiento para estrongiloidiasis diseminada con ivermectina y tenofovir/emtricitabina/efavirenz como terapia antirretroviral. Después de haber recibido durante una semana el manejo para Strongyloides stercoralis, el servicio de hematología indicó quimioterapia con R-CHOP (ciclofosfamida, doxorrubicina, vincristina, y continuó con altas dosis de prednisolona). Dos días después del inicio de la terapia inmunosupresora, el paciente presentó deterioro clínico, con signos de respuesta inflamatoria sistémica clínica y paraclínica, con posterior choque distributivo sugestivo de etiología séptica, sin alcanzar a obtener aislamiento microbiológico, condición por la cual falleció.
Discusión
Se estima que el helminto Strongyloides stercoralis afecta entre 3 a 100 millones de personas alrededor del mundo. Es endémico de zonas tropicales húmedas de América Latina (5). En Colombia, la Encuesta nacional de parasitismo intestinal en población escolar, 20122014, ha estipulado una prevalencia entre el 0,4 al 1,1 %, con variación en las diversas regiones del país y mayor prevalencia en la Amazonía (6). Su ciclo de vida involucra la infección a través de la piel, los pulmones y, finalmente, hacia el tracto gastrointestinal. En individuos inmunocomprometidos puede presentarse un SHS que afecte otros órganos no relacionados al ciclo tradicional de vida de este nemátodo (7). Tal estado de hiperinfección se ha asociado a pacientes con una inmunidad alterada de células T, entre las cuales se destacan condiciones de inmunosupresión adquiridas (infección por HTLV-1 y corticoesteroides) y enfermedades malignas linfo-hematopoyéticas (3,8).
En pacientes que viven con VIH se han identificado frecuencias de Strongyloides stercoralis desde 2,2 hasta 30,1 %, y se ha estipulado que la relación entre SHS y VIH es dada por el estado inmunológico que los pacientes presentan y no por una relación directa (3). Anteriormente se consideraba el SHS como un criterio definitorio de SIDA, pero fue retirado desde 1987 (9,10). El SHS no es tan usual en estos pacientes, y hasta 2012 se habían reportado alrededor de 40 casos, la mayoría asociados al uso de corticoesteroides a altas dosis (11,12).
La presencia del SHS en pacientes que viven con VIH se ha asociado con recuentos de CD4 <200 células/μL (13), lo cual se podría explicar debido a que una respuesta inmunológica TH2 apropiada favorece la eliminación de estos agentes parasitarios. Sin embargo, se ha debatido esta consideración, debido a que la linfopenia asociada al VIH disminuye las opciones de maduración larvaria dentro del intestino, lo cual podría ayudar a disminuir el riesgo de infección, proceso requerido para el desarrollo de un SHS (12,14).
El SHS también se ha relacionado con estados de reconstitución inmune (immune reconstitution inflammatory syndrome, IRIS), condición que es frecuente en los 19 a 150 días posteriores al inicio de la terapia antirretroviral (highly active antiretroviral therapy, HAART). No obstante, la presencia de IRIS se ha relacionado con la de estrongiloidiasis crónica y predominio de síntomas gastrointestinales (15).
El caso actualmente presentado trata de un paciente con condiciones que pudieron propiciar el desarrollo de un SHS, que incluyen la presencia de un trastorno linfo-hematopoyético y el suministro de altas dosis de esteroides, situaciones predisponentes mencionadas en la literatura, (aunque es menos probable que el esteroide suministrado haya jugado un papel importante, debido a que se inició poco tiempo antes del diagnóstico). Además, el estado de choque distributivo de origen séptico puede ser explicado por la invasión de bacterias entéricas facilitada por una pérdida de la barrera intestinal (16). Es improbable la presencia de IRIS como elemento causal del cuadro, considerando que el paciente presentó un deterioro clínico antes de los 19 días de inicio de HAART y la mayoría de casos relacionados se asocian a cuadros de estrongiloidiasis crónica.
Conclusión
Es fundamental considerar el diagnóstico de Strongyloides stercoralis en personas que viven con VIH y que van a ser llevados a quimioterapia u otros tratamientos inmunosupresores, independientemente del estado de inmunosupresión, ya que el síndrome de hiperinfección puede desencadenar complicaciones inusuales e incluso desenlaces fatales.














