Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807On-line version ISSN 2145-8464
Rev. Univ. Ind. Santander. Salud vol.41 no.2 Bucaramanga May/Aug. 2009
Perfil electroforético de proteínas
presentes en la saliva de
Triatoma dimidiata (Hemiptera:
Reduviidae:Triatominae)
Mónica Flórez1, Rocío del Pilar Niño2, Rodrigo Gonzalo Torres3
Gerardo Muñoz4, Víctor Manuel Angulo5
1. Bióloga. Estudiante Maestría Ciencias Básicas Biomédicas, Centro de Investigaciones en Enfermedades Tropicales. CINTROP,
Universidad Industrial de Santander UIS.
2. Química. Estudiante Maestría Ciencias Básicas Biomédicas; Grupo de Investigación en Bioquímica e Ingeniería de Proteínas,
Universidad Industrial de Santander UIS.
3. Bioquímico PhD; Grupo de Investigación en Bioquímica e Ingeniería de Proteínas, Universidad Industrial de Santander UIS.
4. Bacteriólogo y Laboratorista Clínico PhD; Grupo de Investigación en Bioquímica e Ingeniería de Proteínas,Universidad
Industrial de Santander UIS
5. Médico y Cirujano MsC, Centro de Investigaciones en Enfermedades Tropicales. CINTROP. Universidad Industrial de Santander UIS
Correspondencia: Mónica Flórez. Bióloga. Estudiante Maestría Ciencias Básicas Biomédicas. monicaflorezm@hotmail.com;
Centro de Investigaciones en Enfermedades Tropicales; CINTROP. Universidad Industrial de Santander UIS. Sede UIS, Km 2 Vía
Guatiguará, Piedecuesta, Santander. PBX: (57) (7) 6344000 Ext: 3526. Fax: (57) (7) 6540808.
Recibido: 10 marzo de 2009 - Aceptado: 19 julio de 2009
RESUMEN
Introducción: Los triatominos (Hemiptera: Reduviidae:Triatominae) son insectos hematófagos que secretan una saliva rica en proteínas con propiedades anticoagulantes, antihistamínicas, vasodilatadoras y antiplaquetarias que facilitan su proceso de alimentación en el huésped vertebrado y favorecen la transmisión a éste de los protozoarios que se desarrollan en sus glándulas salivales. Estas proteínas son características de cada especie de triatomino y pueden ayudar a diferenciar especies, incluso aquellas fenotípicamente similares. Objetivo: Describir los perfiles electroforéticos de las proteínas salivales de Triatoma dimidiata encontrados en el intradomicilio, peridomicilio y extradomicilio en un área endémica en Santander. Materiales y métodos: Se disectaron las glándulas salivales de insectos adultos de T. dimidiata de tres municipios de Santander procedentes de colonias de laboratorio y de campo. Los perfiles de proteínas se visualizaron realizando una electroforesis de una dimensión en geles de poliacrilamida tenidos con azul de Coomassie. Resultados: Los perfiles electroforéticos de las proteínas presentes en la saliva de T. dimidiata muestran hasta 33 bandas en el rango de 23,7 a 228,8 kDa, con una alta concentración en la región 41 a 99,7 kDa. El índice de polimorfismo para T. dimidiata fue de 0,9646. Conclusión: El perfil electroforético de las proteínas salivares de T. dimidiata mostró una composición proteica compleja, donde las bandas más prominentes tienen pesos moleculares menores de 45 KDa. No se pudieron establecer agrupamientos basados en las regiones geográficas y lugares de captura, a pesar de la gran variabilidad intraespecífica observada. Sin embargo, se pudieron establecer diferencias claras a nivel de especie entre T. dimidiata y el grupo externo utilizado, P. geniculatus. Salud UIS 2009; 41: 121-127.
Palabras Claves:Triatoma dimidiata, proteínas, electroforesis, saliva.
Electrophoretic profile of salivary proteins of Triatoma
dimidiata (Hemiptera: Reduviidae:Triatominae)
ABSTRACT
Introduction: The triatomines (Heteroptera, Reduviidae, Triatominae) are hematophagous insects that secrete saliva rich in proteins with anticoagulant, antihistamine, vasodilator and platelet inhibitor properties, these facilitate its alimentary process on the vertebrate host and facilitate transmission of the protozoa carried in the salivary glands of the triatomines. Such proteins are characteristic of each triatomine species and might help differentiate species, including those phenotypically similar. Objective: Describe electrophoretic profiles of salivary proteins of Triatoma dimidiata found inside, around and outside residences in an endemic area of Santander. Materials and methods: Salivary glands from adult insects of T. dimidiata from laboratory colonies and field from three municipalities of Santander were dissected. The protein profiles were viewed in a unidimensional electrophoresis of poliacrilamida gels taken with coomassie blue. Results: The electrophoretic profiles of proteins present in saliva of T. dimidiata showed up to 33 bands in the range of 23.7 to 228.8 kDa, with a high concentration in the region 41 to 99.7 kDa. The index of polymorphism to T. dimidiata was 0.9646. Conclusion: The electrophorectic profile of salivary protein of T. dimidiata showed a complex composition, where the most prominent bands have molecular weights lower than 45 KDa. No grouping could be established based on geographical regions and capture places, in spite of the great intraespecific variability observed. However, clear differences between T. dimidiata and the external group were established. Salud UIS 2009; 41: 121-127.
Keywords: Triatoma dimidiata, protein, electrophoresis, salivary.
INTRODUCCIÓN
Los triatominos (Heteroptera, Reduviidae, Triatominae) son insectos hematófagos de un amplio interés médico debido a que muchas de sus especies son hospederos de protozoarios hemoflagelados como Trypanosoma cruzi, lo que los convierte en vectores o potenciales vectores de la enfermedad de Chagas1. Son conocidas cerca de 144 especies de triatominos, de las cuales 105 se encuentran en el Nuevo Mundo2,3,4. De los 14 géneros descritos, 12 son exclusivos de América5,6. En Colombia, se han reportado 26 especies de triatominos, los cuales tienen una amplia distribución en la mayoría de sus regiones naturales por debajo de los 2000 msnm7,8.
T. dimidiata, es una especie ecléctica que se alimenta e una gran variedad de hospederos silvestres y domésticos; y se puede adaptar a una enorme diversidad de hábitats, los cuales incluyen numerosos ecotopos de tipo selvático, peridoméstico y doméstico, donde se ha encontrado colonizando9,10,11. Además de que se ha reportado su presencia urbana en varios lugares, ocupa una gran diversidad de zonas de vida y ecosistemas, que incluyen bosques premontanos húmedos y muy calidos hasta bosques húmedos tropicales11.
La mayoría de insectos hematófagos secretan una saliva rica en proteínas, la cual, presenta diferentes sustancias con propiedades anticoagulantes, antihistamínicas, vasodilatadoras y antiplaquetarias que facilitan su proceso de alimentación del huésped vertebrado y a la vez favorecen la transmisión a éste de protozoarios que se desarrollan en sus glándulas salivales12,13. En especies como R. prolixus se han caracterizado 9 proteínas salivales, todas con propiedades antihemostaticas14. Tres son factores anticoagulantes, una es una apirasa que bloquea la agregación plaquetaria por hidrólisis de ADP, cuatro son nitroforinas con funciones vasodilatadoras, mediante la liberación de oxido nítrico en el tejido del huésped15,16 y unión con la histamina reduciendo así la irritación17, y una proteína antitrombina llamada rhodniin14. En otras especies se han caracterizado factores inhibidores de la agregación plaquetaria y anticoagulantes14,18.
MATERIALES Y MÉTODOS
Insectos
Se tomaron insectos adultos de Triatoma dimidiata y de Panstrongylus geniculatus, como grupo externo comparativo, procedentes de tres municipios de Santander (Cuadro 1), pertenecientes al insectario del Centro de Investigaciones de Enfermedades Tropicales (CINTROP) y mantenidos en el laboratorio bajo las mismas condiciones de temperatura, 26-28°C, humedad relativa 85-95 %, fotoperiodicidad 12/12 horas, alimentados sobre gallina y con un período de ayuno de 7 días. De T. dimidiata se utilizaron 9 individuos capturados en campo mediante búsqueda activa en cuevas de animales silvestres y en una casa abandonada usada como sitio de reposo nocturno de animales domésticos (peridomicilio modificado) como se especifica en el Cuadro 1.
Obtención de la saliva y extracción de proteínas
Se realizo disección de las glándulas de 40 individuos Cuadro 1. Las glándulas se lavaron en solución salina estéril 0,9 % y almacenaron en 40 μl de buffer lisis (Urea 7M, tiourea 2M, tris base 40mM, CHAPS 4 % y PMSF 1mM). Luego se homogenizaron en un sonicador por 8 segundos a 40 % de amplitud y centrifugaron a 10.000 rpm durante 5 minutos para obtener el sobrenadante23. La concentración de proteínas totales fue determinada por el método de Bradford.
Electroforesis (SDS-PAGE)
Los perfiles de proteínas se obtuvieron en geles de poliacrilamida al 12 % teñidos con azul de Coomassie23. Los geles fueron escaneados en un escáner UMAX Powerlook 2100 a color con una resolución de 16 megapixeles.
Análisis de datos
Las imágenes de cada gel fueron transformadas a una escala de grises, salvadas en un archivo de formato TIFF y analizadas usando el programa PhotoCaptMw versión 10.01 para Windows. Se calculó el índice de polimorfismo de proteínas para T. dimidiata según el análisis descrito por Soares et al20. Se elaboró una matriz carácter/taxón basada en la presencia/ausencia de bandas encontradas en todos los perfiles por lugar y especie para construir un fenograma usando el método UPGMA (Unweighted Pair Group Method Analysis)20,23.
RESULTADOS
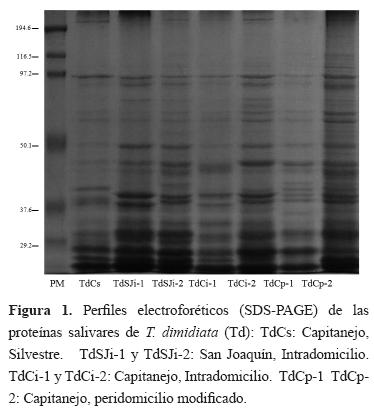
La visualización de los perfiles electroforéticos de las proteínas presentes en la saliva de T. dimidiata muestra hasta 33 bandas en el rango de 23,7 a 228,8 kDa. Se observó una alta concentración de bandas en la región 41 a 99,7 kDa (46,9%) con un mínimo de 8 y un máximo de 16 bandas por perfil (Figura 1 y Cuadro 2). El índice de polimorfismo sin tener en cuenta la procedencia para T. dimidiata fue de 0,9646. El índice por origen se observa en el Cuadro 2.
En el caso de P. geniculatus se observaron hasta 29 bandas con un mínimo de 21 y un máximo de 25 en el mismo rango que para T. dimidiata. La región con la mayor concentración de bandas también fue la de 41 a 99,7 kDa (55,1%) con un mínimo de 10 y un máximo de 15 bandas por perfil. El índice de polimorfismo para P. geniculatus fue de 0,8367 (Cuadro 2). De las 38 bandas obtenidas entre las dos especies, 23 fueron compartidas. De las 15 no compartidas, 9 fueron exclusivas para T. dimidiata y 6 para P. geniculatus (Cuadro 3).
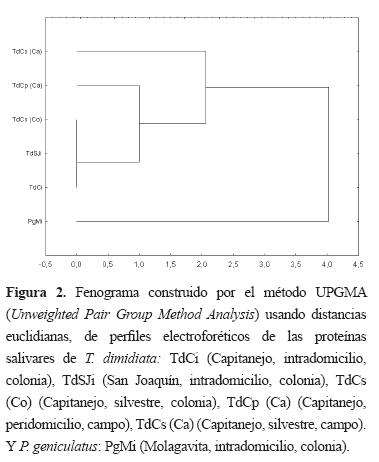
En el fenograma se observa el agrupamiento de los individuos de T. dimidiata, diferenciándose claramente de P. geniculatus (Figura 2).
DISCUSIÓN
El perfil electroforético de las proteínas salivares de los triatominos descritos hasta el momento ha mostrado una composición proteica compleja, donde las bandas más prominentes tienen pesos moleculares menores de 45 KDa23.
El número de bandas identificadas para T. dimidiata fue menor que el encontrado por Pineda et al19, quienes hallaron hasta 61 bandas en una rango de 10 a 100 kDa. La diferencia posiblemente se deba a que en el corrido electroforético no se pudieron diferenciar bandas por debajo de los 23,7 kDa. En contraste, el número de bandas registrado en este trabajo fue mayor que el reportado en otras especies como T. infestans por Pereira et al19, aunque las bandas más prominentes se localizan en la misma región, por debajo de los 35 kDa. Estas proteínas posiblemente pertenezcan a la familia de las lipocalinas, como se ha observado en T. brasiliensis, donde la mayoría de proteínas salivares tienen pesos moleculares de 18 a 22 kDa24. Esta familia contiene proteínas salivales que neutralizan eventos homeostáticos del huésped tales como la coagulación, vasoconstricción y agregación plaquetaria24. Otras proteínas de bajos pesos moleculares como el pallidipin14, que tiene propiedades de interferencia de la agregación plaquetaria mediada por colágeno, o las defensinas, componentes del sistema inmune contra bacterias gram positivas25, pueden estar presentes en la saliva de T. dimidiata, pero no se diferenciaron en el corrido electroforético.
Al igual que en los perfiles obtenidos para P. megistus por Barbosa et al23, donde estudiaron la variabilidad en 20 poblaciones de Brasil, y para T. dimidiata por Pineda et al19 en Guatemala, no se pudieron establecer diferencias claras por área geográfica, o por lugar de captura como lo observaron Ramírez et al26, usando RAPD, en poblaciones domesticas, peridomésticas y silvestres de T. dimidiata provenientes de Boavita, Boyacá, localidad contigua a las poblaciones de Capitanejo por cerca de 20 Km, a pesar de la gran variabilidad intraespecífica observada. Bargues et al27 sugieren que en Colombia las poblaciones silvestres tienen una alta similaridad genética con las domésticas porque son formas autóctonas y no introducidas. Se observan ciertas diferencias entre los perfiles de las cepas de campo y las de laboratorio posiblemente por el tipo de alimentación, como se ha descrito para otros hemiptera28. Como se ha demostrado anteriormente21,22, se pudieron establecer diferencias entre especies.
El índice de polimorfismo encontrado para T. dimidiata es más alto que el observado para otras especies de Rhodnius como R. colombiensis22 y R. prolixus20,22, entre otras20. Soares et al20 consideraron que estos índices de variabilidad genética para las especies de Rhodnius que estudiaron, pudieron ser reducidos por mecanismos de deriva génica y efecto fundador, ya que solo utilizaron insectos provenientes de colonias de laboratorio. A pesar de esta consideración la variabilidad encontrada para T. dimidiata fue alta, incluso teniendo en cuenta el valor obtenido según su origen. La alta variabilidad genética de T. dimidiata también se ha evidenciado en poblaciones de Guatemala usando marcadores moleculares29.
CONCLUSIONES
Este trabajo es una aproximación al sialoma de T. dimidiata que muestra un gran potencial farmacológico por la enorme complejidad y variabilidad en las proteínas presentes en su saliva. Construcción de librerías de ADNc y caracterización de estas proteínas son estudios necesarios para profundizar en el conocimiento de la evolución de los hábitos de alimentación de los insectos hematófagos y en el descubrimiento de compuestos activos útiles en farmacología.
Esta técnica se constituye en una herramienta alternativa de fácil aplicación que puede ser utilizada como marcador para diferenciar especies y poblaciones de la misma especie cuando los programas de prevención y control vectorial de la enfermedad de Chagas lo requieran, aunque requiere el uso de individuos vivos.
AGRADECIMIENTOS
A la Maestría Ciencias Básicas Biomédicas. Grupo de Investigación en Bioquímica e Ingeniería de Proteínas. Universidad Industrial de Santander UIS. Centro de Investigaciones en Enfermedades Tropicales por su apoyo técnico y financiero.
CONFLICTO DE INTERESES
Los autores declaran que no existe conflicto de intereses en el trabajo realizado.
REFERENCIAS
1. Lent H, Wygodzinsky P. Revision of the Triatominae (Hemiptera, Reduviidae), and their significance as vectors of Chagas disease. Bull Am Mus Nat Hist 1979; 163:125-520. [ Links ]
2. Galvão C, Rocha D, Cunha V, Presgrave OA, Jurberg J, Carcavallo R. Influência da temperatura no ciclo de vida de Triatoma melanosoma Martínez, Olmedo & Carcavallo, 1987 (Hemiptera, Reduviidae). Mem Inst Oswaldo Cruz 1999; 94(6):851-4. [ Links ]
3. Aldana E, Lizano E, Ramon F, Valderrama A. Nueva Especie de Psammolestes Bergroth de la Region Sur-Occidental de Venezuela (Hemiptera: Reduviidae: Triatominae). Caribbean J Sci 1996; 32(2):145-50. [ Links ]
4. Schofield CJ & Galvão C. Classification, evolution, and species groups within the Triatominae. Acta Trop 2009; 110:88-100 [ Links ]
5. Galvão C, Carcavallo R, Rocha DDAS, Jurberg J. A checklist of the current valid species of the subfamily Triatominae Jeannel, 1919 (Hemiptera, Reduviidae) and their geographical distribution, with nomenclatural and taxonomic notes. Zootaxa 2003; 202: 1-36. [ Links ]
6. Tartarotti E, Azeredo-oliveira MT, Ceron CR. Phylogenetic approach to the study of triatomines (Triatominae, Heteroptera). Braz J Biol 2006; 66(2B):703-8. [ Links ]
7. Guhl F, Aguilera G, Pinto N, Vergara D. Actualización de la distribución geográfica y ecoepidemiología de la fauna de triatominos (Reduviidae: Triatominae) en Colombia. Biomédica 2007; 27(Supl 1):143-62. [ Links ]
8. Sandoval CM, Pabón E, Jurberg B, Galvao C. Belminus ferroae n. sp. from the Colombian north-east, with a key to the species of the genus (Hemiptera: Reduviidae: Triatominae). Zootaxa 2007; 1443:55-64. [ Links ]
9. Petana WB. American trypanosomiasis in British Honduras X: natural habitats and ecology of Triatoma dimidiata (Hemiptera, Reduviidae) in the El Cayo and Toledo districts, and the prevalence of infection with Trypanosoma (Schizotrypanum) cruzi in the wild-caught bugs. Ann Trop Med Parasitol 1971; 65:169-78. [ Links ]
10. Zeledón R, Solano G, Zuniga A, Swartzwelder JC. Biology and ethology of Triatoma dimidiata (Latreille, 1811) III: habitat and blood sources. J Med Entomol 1973; 10:363-70. [ Links ]
11. Dorn PL, Curtis A, Monroy C. Triatoma dimidiata (Latreille,1811): A review of its diversity across its geographic range and the relationship among populations. Infect Genet Evol 2007; 7:343-52. [ Links ]
12. Stark KR, James AA. The salivary glands of disease vectors. In: Beaty BJ, Marquardt WC, editors. The biology of disease vectors. Colorado: Colorado University Press. 1996;333-48. [ Links ]
13. Ribeiro JM. Role of saliva in blood feeding by arthropods. Annu Rev Entomol 1987; 32:463-78. [ Links ]
14. Montfort WR. Weichsel A, Andersen JF. Nitrophorins and related antihemostatic lipocalins from Rhodnius prolixus and other blood-sucking arthropods. Biochim Biophys Acta 2000; 1482:110-8. [ Links ]
15. Champagne DE, Nussenzveig RH, Ribeiro JMC. Purification, partial characterization and cloning of nitric oxide-carrying heme proteins (nitrophorins) from salivary glands of the blood-sucking insect Rhodnius prolixus. J Biol Chem 1995; 270(15):8691-5 [ Links ]
16. Ribeiro JMC, Hazzard JMH, Nussenzveig RH, Champagne DE, Walker FA. Reversible binding of nitric oxide by a salivary heme protein from a bloodsucking insect. Science 1993; 260: 539-41. [ Links ]
17. Ribeiro JMC, Walker FA. High affinity histamine-binding and antihistaminic activity of the salivary NO-carrying heme protein (nitrophorin) of Rhodnius prolixus. J Exp Med 1994; 180:2251-7. [ Links ]
18. Pereira MH, Souza MEL, Vargas AP, Martins MS, Penido CM, Diotaiuti L. Anticoagulant activity of Triatoma infestans and Panstrongylus megistus saliva (Hemíptera/Triatominae). Acta Trop 1996; 61:255-61 [ Links ]
19. Pineda SS, Melgar S, Dorn PL, Agreda E, Rodas A, Monroy C. Salivary protein profiles distinguish triatomine species and populations of Triatoma dimidiata (Hemiptera: Reduviidae). J Med Entomol 2008; 45(1):52-8. [ Links ]
20. Soares RPP, Sant'Anna MRV, Gontijo NF, Romanha AJ, Diotaiuti L, Pereira MH. Identification of morphological similar Rhodnius species (Hemiptera: Reduviidae: Triatominae) by electrophoresis of salivary heme proteins. Am J Trop Med Hyg 2000; 62(1):157-161. [ Links ]
21. Soares RPP, Gontijo NF, Romanha AJ, Diotaiuti L, Pereira MH. Salivary heme proteins dintinguish Rhodnius prolixus from Rhodnius robustus (Hemíptera: Reduviidae: Triatominae). Acta Trop 1998; 71:285-291 [ Links ]
22. Arévalo A, Carranza JC, Guhl F, Vallejo GA. Patrones electroforéticos de hemoproteínas salivares (nitroforinas) de Rhodnius colombiensis y Rhodnius prolixus (Hemiptera, Reduviidae, Triatominae) Biomédica 2007; 27(Supl 1):137-42 [ Links ]
23. Barbosa SE, Diotaiuti L, Braga EM, Pereira MH. Variability of the salivary proteins of 20 Brazilian populations of Panstrongylus megistus (Hemíptera: Reduviidae: Triatominae). Acta Trop 2004; 92:25-33. [ Links ]
24. Santos A, Ribeiro JM, Lehane M, Figueiredo N, Botelho A, Sant'Anna M, et al. The sialotranscriptome of the blood-sucking bug Triatoma brasiliensis (Hemiptera, Triatominae). Insect Biochem Mol Biol 2007; 37:702-12. [ Links ]
25. Waniek PJ, Castro HC, Sathler PC, Miceli L, Jansen AM, Araujo CA. Two novel defensin-encoding genes of the Chagas disease vector Triatoma brasiliensis (Reduviidae, Triatominae): Gene expression and peptide-structure modeling. J Insect Physiol 2009; 55:840-8. [ Links ]
26. Ramirez CJ, Jaramillo CA, Delgado MP, Pinto NA, Aguilera G, Guhl F. Genetic structure of sylvatic, peridomestic and domestic populations of Triatoma dimidiata (Hemiptera: Reduviidae) from an endemic zone of Boyaca, Colombia. Acta Trop 2005; 93:23-9. [ Links ]
27. Bargues MD, Klisiowicz DR, Gonzalez-Candelas F, Ramsey JM, Monroy C, Ponce C, et al. Phylogeography and Genetic Variation of Triatoma dimidiata, the Main Chagas Disease Vector in Central America, and Its Position within the Genus Triatoma. PLoS Negl Trop Dis 2008; 2(5):e233. doi:10.1371/journal.pntd.0000233 [ Links ]
28. Habibi J, Backus EA, Coudron TA, Brandt SL. Effect of different host substrates on hemipteran salivary protein profiles. Entomologia Experimentalis et Applicata 2001; 98(3): 369-75 [ Links ]
29. Calderón CL, Dorn PL, Melgar S, Chávez JJ, Rodas A, Rosales R, Monroy CM. A Preliminary Assessment of Genetic Differentiation of Triatoma dimidiata (Hemiptera: Reduviidae) in Guatemala by Random Amplification of Polymorphic DNA-Polymerase Chain Reaction. J. Med. Entomol 2004; 41(5): 882-7. [ Links ]