Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807On-line version ISSN 2145-8464
Rev. Univ. Ind. Santander. Salud vol.41 no.3 Bucaramanga Sept./Dec. 2009
esenciales de Lippia origanoides
H.B.K. y componentes mayoritarios
Bibiana Zapata1, Camilo Durán2, Elena Stashenko2, Julieth Correa-Royero1,
Liliana Betancur-Galvis1
1. Grupo de Investigación Dermatológica- Departamento de Medicina Interna. Facultad de Medicina, Universidad de Antioquia,
Medellín-Colombia.
2. Centro de Investigación en Biomoléculas, CIBIMOL. Universidad Industrial de Santander, Bucaramanga, Colombia.
Correspondencia: Liliana Betancur-Galvis. Química, MSc, PhD. Grupo de Investigación Dermatológica, Departamento de
Medicina Interna, Facultad de Medicina, Universidad de Antioquia, Medellín, Colombia. Carrera 51D # 62-29 Laboratorio 283 B.
Teléfono: +4 219 60 64 Fax: +4 219 60 66. E-mail: betancurli@hotmail.com.
Recibido: 1 de octubre de 2009 - Aceptado: 20 de diciembre de 2009
RESUMEN
Introducción: Lippia origanoides H.B.K. (Verbenacea), es una planta aromática conocida comúnmente como "orégano". Los aceites esenciales de 8 muestras de L. origanoides y algunos de sus componentes mayoritarios fueron evaluados in vitro sobre la línea tumoral HeLa y la línea no tumoral Vero para identificar su potencial citotóxico. Materiales y métodos: la concentración inhibitoria cincuenta (IC50) se determinó mediante la técnica fotocolorimétrica del MTT (3-(4,5-Dimetiltiazol-2-il)-2,5-bromuro difeniltetrazolio) y los valores de IC50 se obtuvieron por análisis estadístico mediante regresión lineal simple. El índice de selectividad (IS), definido como la IC50 en células Vero sobre IC50 en células HeLa, fue calculado con el fin de encontrar aceites o componentes con potencial citotóxico selectivo hacia líneas celulares tumorales. Resultados y conclusiones: se determinó por cromatografía de gases y espectrometría de masas GC/MS la composición química de los aceites más citotóxicos. El aceite de L. origanoides que presentó la mayor actividad citotóxica sobre células HeLa con un valor de IC50 de 9,1 ± 1 μg/mL e índice de selectividad de 7,1, fue identificado como quimiotipo trans-β-cariofileno/ρ-cimeno. Los componentes mayoritarios del aceite quimiotipo trans-β-cariofileno/ρ-cimeno fueron: trans-β-cariofileno (11,3%), ρ-cimeno (11,2%), α-felandreno (9,9%), limoneno (7,2%), 1,8-cineol (6,5%) y α-humuleno (6,0%). Los componentes mayoritarios evaluados no mostraron actividad citotóxica relevante sobre células HeLa, sólo el limoneno y β-mirceno presentaron valores de IS, respectivamente, de 6,97 y 3,01. Sin embargo, los valores de IC50 fueron más altos que el del aceite activo. Estos resultados sugieren que la actividad citotóxica de los aceites no se debe sólo a sus componentes mayoritarios, sino a un sinergismo entre sus componentes. Salud UIS 2009; 41: 215-222
Palabras Claves: Citotoxicidad, Vero, HeLa, Lippia origanoides, aceites esenciales, quimiotipos
Cytotoxic activity of essencial oils of Lippia
origanoides H.B.K and its major constituents
ABSTRACT
Introduction: Lippia origanoides H.B.K. (Verbenaceae) is an aromatic plant commonly called as "oregano". Eight essential oils of L. origanoides and some of their main components were evaluated in vitro on tumor cell line HeLa and non-tumor cell line Vero to identify tumoural cytotoxic potential. Materials and methods: Inhibition 50% of cell population (IC50) was determined using the photo-colorimeter technique MTT (3 - (4.5-dimethylthiazol-2-yl)-2,5-difeniltetrazolium bromide). IC50 values were obtained by linear regression analysis. The selectivity index (SI), defined as Vero IC50 on HeLa IC50, it was calculated in order to find oil or major components with selective tumor cytotoxic potential. Results and conclusions: the chemical composition of the oil most cytotoxic was determined by gas chromatography and mass spectrometry GC/MS. The L. origanoides oil identified as chemotype trans-β-caryophyllene/p-cymene showed the highest cytotoxic activity on HeLa cells with IC50 value of 9.1 ± 1 μg/mL and selectivity index of 7.1. The main components were: trans-β-caryophyllene (11.3 ρ-cymene (11.2%), α-phellandrene (9.9%), limonene (7.2%), 1.8-cineol (6.5%) and α-humulene (6.0%). The most of the major components did not show cytotoxic activity on HeLa cells, only limonene and β-myrcene showed IS values of 6.97 and 3.01, respectively. However, the IC50 values were higher than active oil. These results suggest that cytotoxic activities of the oils are not only due to their main components, but to a synergism among its components. Salud UIS 2009; 41: 215-222.
Keywords: Cytotoxicity, Vero, HeLa, Lippia origanoides, essential oil, chemotype
INTRODUCCIÓN
Los productos naturales constituyen una fuente de sustancias con gran actividad biológica, a partir de los cuales se ha obtenido aproximadamente el 60% de los medicamentos antineoplásicos1. Entre estos se encuentran el taxol aislado de la planta Taxus brevifolia, empleado en el tratamiento de cáncer de seno, de ovario y de pulmón; el etopósido derivado semisintético de la epidofilotoxina utilizado en el tratamiento de linfomas, cáncer bronquial y testicular; y la camptotecina proveniente del árbol Camptotheca acuminata que es usada en el tratamiento de tumores sólidos2. En los últimos años, algunos aceites esenciales y sus componentes mayoritarios han sido reportados con actividad citotóxica en células tumorales3-5. El aceite esencial de Cymbopogon flexuosus y su principal componente, el isointermedeol, inhiben la proliferación de células de leucemia promielocitica (HL-60), después de 48h de tratamiento, a una concentración inhibitoria cincuenta (IC50), respectivamente, de 30 y 20 μg/mL3. El eugenol, un componente del aceite esencial de Eugenia caryophyllata, es citotóxico sobre células de leucemia promielocitica humana (HL-60) a una concentración de 23,7 μM4. El citral, uno de los componentes principales del "pasto de limón", mostró actividad citotóxica sobre células de linfoma de monocitos (U937), células de leucemia promielocítica humana (HL-60), células de hepatoma de ratón (RL-12) y células de leucemia de ratón (BS-24-1)5.
Lippia origanoides H.B.K. (Verbenaceae), es una planta aromática conocida comúnmente como "orégano". Las variaciones en las cantidades de los componentes mayoritarios de aceites esenciales de diferentes muestras de L. origanoides, tales como, carvacrol, timol, trans-β-cariofileno, ρ-cimeno, β-mirceno, α-humuleno y γ-terpineno6-7, ha conducido a clasificar los según su composición química en quimiotipos6. En cuanto a la actividad biológica, las hojas y flores de esta planta se usan en infusión para tratar afecciones respiratorias e intestinales6,8. En Colombia, el uso medicinal de infusiones de hojas y flores de otra especie de "orégano", Origanum vulgare, está aprobado por el INVIMA (Instituto Nacional de Vigilancia de Medicamentos y Alimentos) como antiinflamatorio9. Los aceites esenciales de L. origanoides son hasta ahora sólo reportados en la literatura con propiedades antimicóticas y antibacterianas6-7. Además, estudios de actividad citotóxica in vitro, con el fin de identificarlos como posibles agentes antitumorales, no han sido publicados.
En el presente estudio se evaluó el efecto citotóxico de aceites esenciales de ocho muestras de L. origanoides y algunos de sus componentes mayoritarios, sobre la línea tumoral HeLa (células de adenocarcinoma de cérvix humano). Además, se evaluó la citotoxicidad en células no-tumorales, Vero (células de riñón de mono verde africano), con el fin de determinar el índice de selectividad (IS).
MATERIALES Y MÉTODOS
Material vegetal y extracción de aceites esenciales
(AEs)
El material vegetal empleado fue colectado por personal adscrito al Centro de Excelencia CENIVAM, en diferentes lugares de Colombia. La identificación taxonómica de las muestras botánicas, se llevó a cabo en el Instituto de Ciencias Naturales, Facultad de Ciencias, Universidad Nacional de Colombia (Bogotá) por el doctor José Luís Fernández. Los pliegos testigo de cada planta quedaron depositados como muestra permanente en el Herbario Nacional Colombiano.
Los aceites esenciales se extrajeron de 300 g de planta completa, por hidrodestilación asistida por la radiación de microondas (MWHD)10. La extracción se llevó a cabo empleando un equipo de destilación tipo Clevenger con reservorio de destilación Dean Stark y adaptación para calentamiento por radiación de microondas, a través de un horno de microondas convencional KENDO, modelo MO-124, con una potencia de salida 800 vatios y frecuencia de radiación de 2,5 GHz. Al final del proceso de extracción, se agregó sulfato de sodio al aceite extraído, para secar el agua residual. Cada extracción tuvo una duración de 30 minutos.
Análisis cromatográfico del aceite esencial
El análisis cromatográfico de los aceites, fue realizado en el Laboratorio de cromatografía, Centro de Investigación en Biomoléculas, CIBIMOL, Centro de Investigación CENIVAM. Éste se describe de manera breve en Stashenko y col (2004)10. Una alícuota de cada aceite esencial puro (50 μL), junto con el patrón interno (n-tetradecano, 4 μL) se disolvieron en diclorometano hasta el volumen final de 1 mL. Luego, 1 μL de la solución se inyectó al equipo de GC-MS, para su análisis cromatográfico.
La identificación de los componentes presentes en los aceites esenciales de L. alba se llevó a cabo por cromatografía de gases– espectrometría de masas (GC/MS), empleando un cromatógrafo Agilent Technologies 6890 Plus (HP, Palo Alto, California, USA) acoplado a un detector selectivo de masas Agilent Technologies MSD 5973, equipado con un puerto de inyección split/splitless (1:50), un inyector automático Agilent 7863, un sistema de datos HP-MS ChemStation G17001DA (Versión D.00.01.27, 2002), incluyendo las bases de datos NBS 75K, WILEY 138K, NIST 2002 y ADAMS 2004.
Se utilizó una columna capilar apolar de sílice fundida DB-5MS (J & W Scientific, Folsom, CA, EE.UU) de 60 m x 0.25 mm, D.I x 0.25 μm, df con fase estacionaria de 5% fenil – poli (metil siloxano) y una columna polar de sílice fundida DB-WAX (J & W Scientific, Folsom, CA, EE.UU) de 60 m x 0.25 mm, D.I x 0.25 μm, df con fase estacionaria de polietilenglicol. La temperatura del horno se programó desde 45°C, (5 min) hasta 150°C (2 min) a razón 4°C/min luego se incrementó hasta 250°C (5 min) a razón de 5°C/min. Finalmente, la temperatura aumentó a razón de 10°C/min hasta alcanzar 275°C (15 min). Cada extracción tuvo una duración de (30 min).Las temperaturas de la cámara de ionización y de la línea de transferencia se mantuvieron a 230 y 285 °C, respectivamente.
Los espectros de masas y corrientes iónicas reconstruidas (TIC) se obtuvieron en un cuadrupolo, por medio de barrido automático de frecuencia (full scan), a 6 scan s-1, en el rango de masas m/z 40-350. Para la identificación de los compuestos se usaron los espectros de masas e índices de retención de Kováts.
La cuantificación de los componentes presentes en cada aceite esencial extraído e identificado, se llevó a cabo empleando la técnica de estandarización interna, utilizando el n-tetradecano como patrón interno. La concentración, a la cual se llevó el patrón interno en el extracto fue de 3040 ppm.
Monoterpenos
Los monoterpenos: timol, (+) limoneno, (-) limoneno, 1,8-cineol, α-pineno, trans-β-cariofileno, ρ-cimeno, carvacrol, timol, β- mirceno, α-terpineno, γ-terpineno, terpinen-4- ol fueron comprados a Sigma (Chemical Company St Louis, MO, USA). Se prepararon soluciones de los monoterpenos en DMSO a 50 mg/mL y se almacenaron en refrigeración a 4°C hasta su uso.
Actividad citotóxica
La citotoxicidad se evaluó en células de adenocarcinoma de cérvix humano (HeLa ATCC CCL-2) y células de riñón de mono verde africano (Vero ATCC CCL-81) mediante la técnica fotocolorimétrica del MTT (3-(4,5-Dimetiltiazol-2-il)-2,5-bromuro difeniltetrazolio) (Sigma, New Jersey, USA) descrita por Betancur-Galvis y col (2002)11 con algunas modificaciones. Se cultivaron las células HeLa y Vero a una densidad, respectivamente, de 1,25 x 105 y 1,4x105 células/mL en placas de 96 pozos; y se incubaron durante 24 horas a 37°C en atmósfera húmeda con 5% de CO2. Posteriormente, se agregaron 100 μL de cuatro concentraciones entre 25 y 200 μg/mL, por cuadruplicado. Las placas se incubaron por un período adicional de 48 horas a 37°C y finalmente se realizó lectura espectrofotométrica a 570 nm, para la determinación de la concentración inhibitoria cincuenta (IC50). Los valores de IC50 para cada aceite y extracto se obtuvieron por análisis de regresión lineal simple de curvas dosis-respuesta generada con los datos de absorbancia y empleando el paquete estadístico R (Development Core Team, Vienna, Austria, 2008). Los valores de IC50 se expresaron como la media ± desviación estándar (M ± DS). Se calculó el IS de los aceites y monoterpenos (IS = IC50 células Vero/IC50 células HeLa) y se consideró selectiva la muestra que mostró un IS ≥ 3 de acuerdo al criterio utilizado por Prayong y col (2008)12.
RESULTADOS
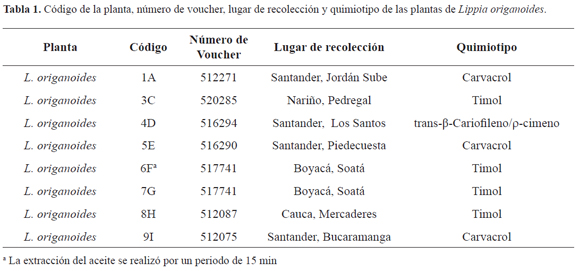
El análisis cromatográfico de los aceites identificó tres quimiotipos: trans-β-cariofileno/ρ-cimeno, timol y carvacrol. La composición química de los quimiotipos evaluados en este estudio ha sido reportada por Stashenko y col (2008)13. En la Tabla 1 se presenta los códigos de los aceites, número de voucher, lugar de recolección y quimiotipo de las plantas de Lippia origanoides.
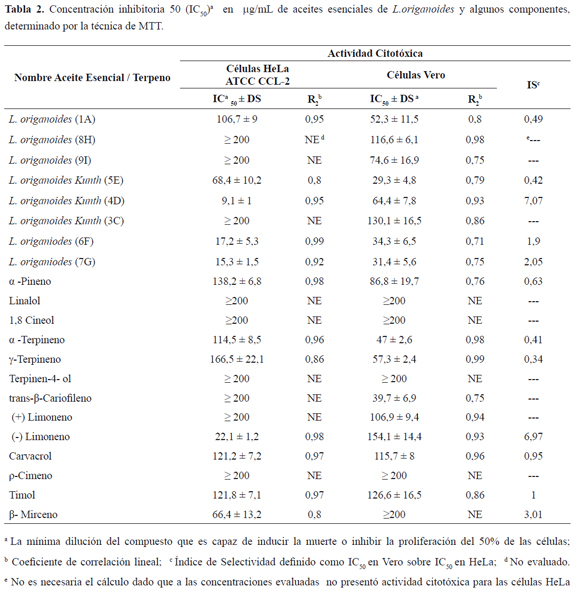
El presente estudio evaluó el efecto citotóxico de ocho aceites esenciales de L. origanoides y sus componentes mayoritarios, sobre la línea tumoral HeLa y la línea no-tumoral Vero, según los criterios del Instituto Nacional de Cáncer de Estados Unidos, el cual considera citotóxico un extracto vegetal con valor de IC50 < 30 μg/mL14. En la Tabla 2 se muestra los valores de IC50 obtenidos para los aceites de L. origanoides y, trece mono-terpenos que hacen parte de los componentes mayoritarios y minoritarios de los diferentes quimiotipos. Los aceites de L. origanoides 1A, 3C, 8H y 9H no fueron citotóxicos, en ambas líneas celulares, mostrando valores de IC50 mayores de 50 μg/mL. Estos aceites correspondieron a los quimiotipos timol y carvacrol. Los aceites 6F y 7G son aceites obtenidos de la misma planta, con la diferencia en su tiempo de extracción. Como se puede observar en la Tabla 2, los valores de IC50 de los aceites 6F y 7G son muy similares, siendo más citotóxicos sobre la línea celular HeLa que en la línea no-tumoral Vero. Ambos aceites, quimiotipo timol, mostraron un efecto de dosis dependiente, con valores de coeficiente de regresión lineal (R2) de 0,7. El aceite 5E fue mas citotóxico en la línea no-tumoral que en las células HeLa. Finalmente, el aceite que mostró mayor actividad citotóxica fue el aceite 4D, con un valor de IC50 de 9,1 ± 1 μg/mL y un índice de selectividad de 7,1. Además, el valor de R2, tanto para la citotoxicidad en células HeLa como en Vero, fueron lo más altos entre los aceites evaluados.
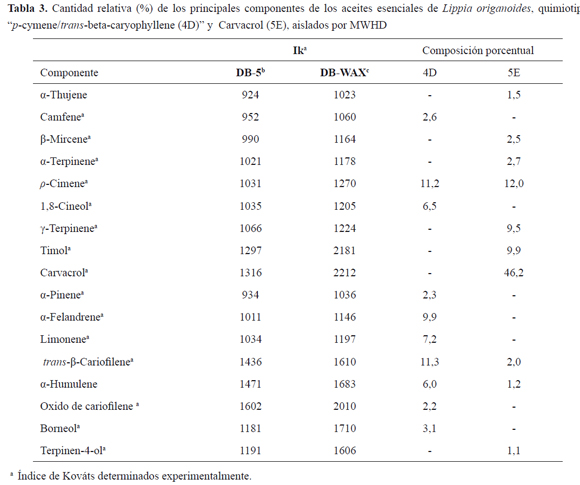
Con el fin de correlacionar la actividad de los aceites con los componentes mayoritarios, se caracterizó la composición química de los aceites 4D y 5E, correspondiente al aceite más activo y el menos activo. El análisis de GC/MS identificó 40 componentes (datos no mostrados). En la Tabla 3 sólo se registran 17 componentes con concentración relativa porcentual mayor de uno por ciento. Los componentes están ordenados según el tiempo de elución en las columnas DB-5MS y DB-WAX, con sus índices de retención y cantidades relativas (%). El aceite quimiotipo trans-β-cariofileno/r-cimeno (4D) mostró la siguiente composición, en sus componentes mayoritarios: trans-β-cariofileno (11,3%), ρ-cimeno (11,2%), α-felandreno (9,9%), limoneno (7,2%%), 1, 8-cineol (6,5%) y α-humuleno (6,0%). El aceite quimiotipo carvacrol (5E) mostró la siguiente composición, en sus componentes mayoritarios: carvacrol (46,2%), ρ-cimeno (12,0%), timol (9,5%), γ-terpineno (9,5%), β- mirceno (2,5%), α-terpineno (2,7%) y trans-β-cariofileno (2%). En la Tabla 2, se muestra la actividad citotóxica de estos componentes. Los monoterpenos, componentes mayoritarios, no mostraron actividad citotóxica en ninguna de las dos líneas evaluadas, solo el (-) limoneno mostró actividad citotóxica en las células HeLa, con un valor de IC50 de 22,1 ± 1,2 μg/mL e índice de selectividad de 6,97. El respectivo isómero óptico (+) limoneno no fue citotóxico. El β- mirceno tubo un IS de 3,1, pero el valor IC50 fue de 66.4 ± 13 μg/mL.
DISCUSIÓN
L. origanoides H.B.K. es una planta aromática perteneciente a la familia Verbenaceae, reconocida, tradicionalmente, por sus propiedades farmacológicas14-15. L. origanoides es un arbusto de hasta 3 m de altura, que crece en forma silvestre en América Central, el norte de América del Sur y de las Antillas14-15. Las investigaciones sobre la actividad biológica de esta especie, cobran importancia, debido a sus múltiples usos: como condimento, por su contenido alto en timol y carvacrol; y en infusiones de flores y hojas para aplicaciones etnofarmacológicas6,8. En México, es conocido popularmente como orégano silvestre y es utilizado en la cocina como un sustituto del orégano común, L. graveolens Kunth6. En Colombia, se encuentra en altitudes entre 500 y 800 m, en varios departamentos de la región Andina y en el norte de la península de la Guajira13. Stashenko y col (2008)13 han identificado en Colombia la presencia de tres quimiotipos: trans-β-cariofileno/ρ-cimeno, timol y carvacrol.
En el presente estudio se evaluó el efecto citotóxico in vitro en la línea tumoral HeLa (células de adenocarcinoma de cérvix humano) y la línea no-tumoral Vero, de ocho aceites esenciales obtenidos de plantas de L. origanoides, con el fin de identificar un posible uso antitumoral.
Entre los aceites esenciales reportados con actividad citotóxica, están los aceites aislados de las plantas Zanthoxylum schinifolium16, Melaleuca alternofolia17 y Eugenia cariophyllata4; así como algunos componentes mayoritarios de sus aceites esenciales como el eugenol4, 1,8-cineol18, terpinen 4-ol17, limoneno19 y el citral5, los cuales han mostrado actividad citotóxica sobre líneas celulares de leucemias mieloides, linfoides, cáncer de hígado, melanoma y cáncer de cérvix.
Moteki y col (2002)18 reportaron efecto citotóxico del monoterpeno 1,8-cineol, en el cual se indujo fragmentación del DNA en las líneas celulares de leucemia humana Molt 4B y HL-60, a concentraciones de 0,7 μg/mL; por el contrario no induce fragmentación del DNA en linfocitos provenientes de voluntarios sanos, mostrando así un efecto selectivo sobre las líneas tumorales Molt 4B y HL-60. En nuestro estudio, sin embargo, no se encontró actividad citotóxica del 1,8-cineol en células de adenocarcinoma de cérvix humano.
El aceite de Melaleuca alternofolia, es reportado como citotóxico e inductor de apoptosis en células de melanoma (M14 WT) y células de melanoma resistentes a adriamicina (M14 ADR), después de 48 horas de tratamiento, a una concentración de 0,02% V/V17. El componente principal, el terpinen 4-ol, al igual que el aceite, provoca daño morfológico, fragmentación del DNA y apoptosis en células M14 ADR a una concentración de 0,01% V/V17. En nuestro estudio, la actividad citotóxica del terpinen 4-ol no pudo ser evidenciada. Estos resultados obtenidos, de no actividad, para 1,8-cineol y terpinen 4-ol, comparado con la citotoxicidad reportada por Moteki y col (2002)18 y Calcabrini y col (2004)17, puede ser debido a un efecto citotóxico específico, respectivamente, hacia las células tumorales, Molt 4B, HL-60, M14 WT y M14 ADR.
Es de resaltar, en nuestro estudio, la actividad citotóxica del aceite quimiotipo trans-β-cariofileno/ρ-cimeno (4D), de composición: trans-β-cariofileno (11,3%), ρ-cimeno (11,2%), α-felandreno (9.9%) y limoneno (7,2%), con valores de IC50 de 9.1 ± 1 μg/mL, evaluado por la técnica del MTT, e índice de selectividad de 7.1. El (-) limoneno, uno de los componentes mayoritarios del aceite mostró valores de IC50 de 22,1 ± 1,2 y IS de 6.9, similares a los obtenidos en el aceite 4D. La actividad citotóxica del limoneno ha sido reportada por varios autores19-21. Rabi y Bishayee (2009)20, evaluaron la actividad citotóxica, por 48h, utilizando la técnica del MTT, del (-) limoneno sobre células de cáncer de próstata (DU-145) y células no-tumorales epiteliales de próstata (PZ-HPV-7), mostrando, respectivamente, valores de IC50 de 2,8 mM y 9,4 mM. El efecto del (-) limoneno fue dosis dependiente, y éste potenció la actividad citotóxica inducida por el medicamento docetaxel sobre la células DU-145. Estudios clínicos en fase II/I, están siendo llevados a cabo para demostrar su potencial actividad antitumoral22-23. Este es el primer estudio en el cual se evalúa la actividad citotóxica en células HeLa de aceites esenciales provenientes de la planta L. origanoides. El índice de selectividad alto del aceite, y el valor de IC50 bajo, sugiere que la actividad citotóxica hacia las células de adenocarcinoma de cérvix humano, no se debe sólo a sus componentes mayoritarios, como el limoneno, ya que la presencia de sus isómeros estructurales determinan actividades contrapuestas, sino a un sinergismo entre componentes mayoritarios y minoritarios. Próximos estudios, estarán encaminados a evaluar la actividad de este aceite con medicamentos que se encuentran actualmente en uso para tratamiento de cáncer de cérvix, con el fin de evaluar su potencial para inducir sinergismo en la citotoxicidad selectiva a células tumorales.
AGRADECIMIENTOS
Los resultados de este artículo se derivan del proyecto RC 432-2004 financiado por el Instituto colombiano para el desarrollo de la ciencia y la tecnología-COLCIENCIAS, Bogotá, Colombia.
CONFLICTOS DE INTERESES
Los autores no tienen conflictos de intereses que declarar.
REFERENCIAS
1. Cowan MM. Plant products as antimicrobial agents. Clin Microbiol Rev 1999; 12: 564-582. [ Links ]
2. Cragg G and Newman D. Plants as a source of anticancer agents. Journal of Ethnopharmacology 2005; 100: 72-79. [ Links ]
3. Kumar A, Malik F, Bhushan S, Sethi VK, Shahi AK, Kaur J, Taneja SC, Qazi GN, Singh J. An essential oil and its major constituent isointermedeol induce apoptosis by increased expression of mitochondrial cytochrome c and apical death receptors in human leukaemia HL-60 cells. Chem Biol Interact 2008; 171: 32-347. [ Links ]
4. Yoo CB, HanK T, Cho KS, Ha J, Park HJ, Nam JH, Kil UH, Lee KT. Eugenol isolated from the essential oil of Eugenia caryophyllata induces a reactive oxygen species-mediated apoptosis in HL-60 human promyelocytic leukemia cells. Cancer Lett 2005; 225: 41-52. [ Links ]
5. Dudai N, Weinstein Y, Krup M, Rabinski T, Ofir R. Citral is a new inducer of caspase-3 in tumor cell lines. Planta Med 2005; 71: 484-488. [ Links ]
6. Oliveira DR, Leitao GC, Bizzo HR, Alviano DS, Alviano CS, Leitão SG. Chemical and antimicrobial analysis of essential oil of Lippia origanoides H.B.K. Food Chemistry 2007; 101:236-240. [ Links ]
7. Dos Santos FJ, Lopes JA, Cito GL, Oliveira EH, de Lima SG de Reis F. Composition and biological activity of essential oils from Lippia origanoides H.B.K. Journal of Essential Oil Research 2004; 16: 504-506. [ Links ]
8. Garcia-Barriga HG. Flora Medicinal de Colombia, Botánica Médica. 2da edición. Bogota: Tercer Mundo, 1992 p. 508. [ Links ]
9. Fonnegra R, Jimenez S. Plantas medicinales aprobadas en Colombia. 2da edición. Medellín: editorial Universidad de Antioquia, 2006 p. 368. [ Links ]
10. Stashenko EE, Jaramillo BE, Martinez JR. Comparison of different extraction methods for the analysis of volatile secondary metabolites of Lippia alba (Mill.) N.E. Brown, grown in Colombia, and evaluation of its in vitro antioxidant activity. J Chromatogr A 2004; 1025: 93-103. [ Links ]
11. Betancur-Galvis LA, Morales GE, Forero JE, Roldan J. Cytotoxic and antiviral activities of Colombian medicinal plant extracts of the Euphorbia genus. Mem Inst Oswaldo Cruz 2002; 97: 541-546. [ Links ]
12. Prayong P, Barusrux S, Weerapreeyakul N. Cytotoxic activity screening of some indigenous Thai plants. Fitoterapia 2008; 79: 598–601. [ Links ]
13. Stashenko E, Ruiz C, Muñoz A, Castañeda M, Martínez J. Composition and Antioxidant activity of Essential Oils of Lippia origanoides H.B.K. grown in Colombia. Natural products communications 2008; 3: 563-566. [ Links ]
14. Hennebelle T, Sahpaz S, Joseph H, Bailleul F. Ethnopharmacology of Lippia alba. J Ethnopharmacol 2008; 116: 211-222. [ Links ]
15. Pascual ME, Slowing K, Carretero E, Sánchez D, Villar A. Lippia: traditional uses, chemistry and pharmacology: a review. Journal of Ethnopharmacology 2001; 76: 73-99. [ Links ]
16. Paik SY, Koh KH, Beak SM, Paek SH, Kim JA. The essential oils from Zanthoxylum schinifolium pericarp induce apoptosis of HepG2 human hepatoma cells through increased production of reactive oxygen species. Biol Pharm Bull 2005; 28: 802-807. [ Links ]
17. Calcabrini A, Stringaro A, Toccacieli L, Meschini S, Marra M, Colone M, Salvatore G, Mondello F, Arancia G, Molinari A. Terpinen-4-ol, the main component of Melaleuca alternifolia (tea tree) oil inhibits the in vitro growth of human melanoma cells. J Invest Dermatol 2004; 122: 349-360. [ Links ]
18. Moteki H, Hibasami H, Yamada Y, Katsuzaki H, Imai K, Komiya T. Specific induction of apoptosis by 1,8-cineole in two human leukemia cell lines, but not a in human stomach cancer cell line. Oncol Rep 2002; 9: 757-760. [ Links ]
19. Ji J, Zhang L, Wu YY, Zhu XY, Lv SQ, Sun XZ. Induction of apoptosis by d-limonene is mediated by a caspase-dependent mitochondrial death pathway in human leukemia cells. Leuk Lymphoma 2006; 47: 2617-2624. [ Links ]
20. Rabi T, Bishayee A. d -Limonene sensitizes docetaxel-induced cytotoxicity in human prostate cancer cells: Generation of reactive oxygen species and induction of apoptosis. J Carcinog 2009; 8:9. [ Links ]
21. Kawamori T, Tanaka T, Hirose Y, Ohnishi M, Mori H. Carcinogenesis 1996; 17(2): 369-72. [ Links ]
22. Vigushin DM, Poon GK, Boddy A, English J, Halbert GW, Pagonis C, Jarman M, Coombes RC. Phase I and pharmacokinetic study of D-limonene in patients with advanced cancer. Cancer Research Campaign Phase I/II Clinical Trials Committee. Cancer Chemother Pharmacol 1998; 42(2): 111-7. [ Links ]
23. McNamee D. d-Limonene trial in cancer. Lancet 1993; 342: 801-5. [ Links ]