Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807On-line version ISSN 2145-8464
Rev. Univ. Ind. Santander. Salud vol.41 no.3 Bucaramanga Sept./Dec. 2009
farmacológica obtenidos por
biotransformación de geraniol y pineno
Jennifer Pilar Rojas Llanes1, Janeth Aide Perea Villamil1, Claudia Cristina Ortiz López2
1. Centro de Investigación en Ciencia y Tecnología de Alimentos –CICTA, Escuela de Química, Universidad Industrial de Santander
2. Grupo de Investigación en Bioquímica y Microbiología. Escuela de Bacteriología y Laboratorio Clínico, Universidad Industrial
de Santander, Bucaramanga, Colombia.
Correspondencia: Janeth Aide Perea Villamil PhD. Química. Universidad Industrial de Santander. Docente Escuela de Química.
Directora del CICTA, km 2 Vía Refugio Piedecuesta. Telefax: 6550804, Sanatander, Colombia.
E-mail: aperea@uis.edu.co
Recibido: 20 de octubre de 2009 - Aceptado: 14 de diciembre de 2009
RESUMEN
Se presenta una revisión sobre los diferentes estudios reportados para la biotransformación de los monoterpenos geraniol y pineno, destacando la producción de compuestos naturales con aplicaciones farmacéuticas, y citando los resultados obtenidos en el Centro de Investigación en Ciencia y Tecnología de Alimentos de la Universidad Industrial de Santander. La biotransformación de geraniol empleando células de plantas, hongos y bacterias conduce a la producción de diferentes compuestos, entre los cuales sobresale el ácido geránico, reconocido por sus propiedades anticancerígenas. A partir del (R)-(+)-α-pineno y utilizando células de diferentes microorganismos se han producido principalmente verbenona y verbenol, compuestos usados como materiales de partida para sintetizar productos antitumorales. Salud UIS 2009; 41: 251-258
Palabras Claves: Biotransformación, geraniol, pineno, ácido geránico, verbenona, verbenol
Compounds with potential pharmacological application
obtained by geraniol and pinene biotransformation
ABSTRACT
This paper presents a review on the studies reported for the biotransformation of the monoterpenes geraniol and pinene, emphasizing in the production of natural compounds with pharmaceutical applications, and showing results obtained in the Research Center in Science and Technology Food of the Industrial University of Santander. The bioconversion of geraniol using plant cells, fungi and bacteria leads to the production of different compounds, among which outstands the geranic acid, recognized for its anticancer properties. From (R)-(+)-α-pinene and using cells from different organisms have been principally produced verbenona and verbenol compounds used as starting materials to synthesize anti-tumor products. Salud UIS 2009; 41: 251-258.
Keywords: Biotransformation, geraniol, pinene, geranic acid, verbenone, verbenol
INTRODUCCIÓN
El interés en la obtención de compuestos naturales ha aumentado la investigación acerca de la producción biotecnológica de estas sustancias1. Estos productos pueden extraerse del material vegetal, pero algunos de los compuestos presentes en las plantas, que exhiben excelentes propiedades ya sea como agentes aromatizantes, saborizantes o como productos farmacéuticos, no están disponibles en cantidades industriales. Por este motivo se hace necesaria su síntesis a partir de precursores con mayor disponibilidad y menor valor comercial, empleando biocatalizadores para conservar la denominación de "natural"2, debido a que la Administración de Alimentos y Medicamentos de Estados Unidos ha definido como "sustancias naturales", únicamente a aquellas que pueden obtenerse por procesos físicos, enzimáticos o microbianos a partir de precursores aislados de la naturaleza1.
Entre los sustratos utilizados con fines biocatalíticos se encuentran los terpenos, que constituyen el grupo más grande de metabolitos secundarios en las plantas, con cerca de 22 mil estructuras conocidas hasta ahora3. Entre ellos se encuentran los monoterpenos, que con más de 400 estructuras4 constituyen sustratos disponibles como material de partida para la producción biotecnológica de compuestos naturales, con aplicaciones en las industrias alimenticia, farmacéutica y cosmética, mejorando su valor comercial.
El geraniol y el pineno son monoterpenos empleados en procesos de biotransformación que pueden ser utilizados para la producción de compuestos con aplicaciones farmacológicas. A partir del geraniol y utilizando células de Saccharomyces cerevisiae5, Rhodococcus sp. GR36 y Cucurbita maxima7, se ha obtenido ácido geránico; y utilizando como sustrato el (R)-(+)-α-pineno se han producido principalmente verbenol y verbenona, empleando como biocatalizadores células de hongos: Penicillium solitum8, Aspergillus niger2,9,10, Hormonena sp.11 y Botrytis cinerea12; de bacterias: Pseudomonas spp.13; y de plantas: Psychotria brachyceras, Rauvolfia sellowii14 y Picea abies15,16,17.
El objetivo del presente artículo es mostrar una revisión sobre los diferentes estudios publicados para la biotransformación de los monoterpenos geraniol y (R)-(+)-α-pineno, enfatizando en la producción de compuestos naturales con aplicaciones farmacéuticas, e incluyendo resultados obtenidos en el Centro de Investigación en Ciencia y Tecnología de Alimentos de la Universidad Industrial de Santander.
Biotransformaciones
Las biotransformaciones son modificaciones químicas sobre sustratos exógenos naturales o sintéticos empleando células o enzimas, para producir compuestos con mayor actividad biológica y valor agregado. Las biotransformaciones son importantes en síntesis orgánica para la producción de químicos finos y precursores quirales que no pueden sintetizarse eficientemente por otros métodos18,19. Adicionalmente, constituyen una alternativa económica ya que se realizan en condiciones moderadas de pH y temperatura. Su aplicación permite realizar procesos de tecnología limpia porque no implican el uso de solventes tóxicos o carcinogénicos, pueden generar productos de manera más eficiente y natural20, y permiten superior regio y estereoselectividad3.
Actualmente existe una tendencia creciente hacia la aplicación de procesos de biotransformación para la obtención de moléculas complejas de interés industrial, especialmente en el sector farmacéutico, donde son requisitos fundamentales las propiedades de selectividad y especificidad en un proceso de síntesis21,22.
La estereoselectividad es un tema trascendente en farmacología, debido a que la actividad de un medicamento depende del enantiómero presente. Un compuesto se considera "enantiómero puro" cuando está en exceso del 98%. Aunque la mayoría de productos farmacéuticos son racémicos, usualmente solo uno de los enantiómeros presenta la actividad biológica deseada; el otro puede ser inactivo o incluso tener actividad nociva. La US FDA estableció su política frente al tema desde el año 1992, definiendo que, en una droga quiral, deben ser estudiados los efectos biológicos de ambos enantiómeros23.
En los procesos de biotransformación se emplean células completas o enzimas obtenidas a partir de diferentes organismos, en forma soluble o inmovilizada en ambos casos. Sin embargo, si la presencia de otras enzimas no genera un impacto negativo sobre la pureza del producto, el uso de células completas es más económico, debido a que los procesos de aislamiento y purificación de enzimas son costosos. Además, las membranas celulares protegen las enzimas de fuerzas de cizalla y permite aumentar la estabilidad, ya que la remoción de una enzima de su ambiente de membrana ocasiona una pérdida parcial o total de su actividad. De otra parte, la serie de reacciones enzimáticas llevadas a cabo en las células pueden ser difíciles de realizar in vitro debido al número de cofactores implicados20.
En la mayoría de publicaciones, la biotransformación de terpenos se ha hecho con células completas, principalmente de bacterias (41%), seguidas por células de hongos (35%), plantas (11%), cianobacterias (4%) y microalgas (4%). Únicamente en el 7% de los estudios se emplean enzimas aisladas3.
Biotransformación de geraniol
El geraniol (E-3,7-dimetilocta-2,6-dien-1-ol) es un alcohol terpénico encontrado en los aceites esenciales de rosa, geranio, citronela y palmarosa. En algunas especies de palmarosa constituye el 90% del aceite24. Para la biotranformación de geraniol se han empleado bacterias, hongos y células vegetales.
Respecto al uso de bacterias, en la biotransformación de geraniol se ha utilizado una cepa de Rhodococcus sp. GR3 aislada del suelo, siendo el ácido geránico [ácido (2E)-3,7-dimetilocta-2,6-dienóico] el único producto de la reacción. El geraniol se agregó al 1% v/v después de 3 días de crecimiento de la bacteria en un medio de sales minerales que contenían dextrosa y peptona, a temperatura óptima de 30 °C. Se realizaron cinéticas de saturación y se alcanzó un rendimiento final del 50% después de 96 h de biotransformación. Mayores concentraciones de sustrato causaron menores rendimientos de conversión debido a los efectos tóxicos del geraniol. No se observó degradación del producto usando esta bacteria6. El compuesto obtenido es reconocido por sus propiedades anticancerígenas, debido a que induce la apoptosis y la actividad agonista retinoide7.
La biotransformación de geraniol con Pseudomonas incognita produce 6-metil-5-hepten-2-ona25, un intermediario de gran valor en la producción de aromatizantes. Se emplea como saborizante natural, ya que posee un sabor reminiscente a pera. Se han reportado varias patentes para su síntesis química, partiendo de diferentes sustratos y utilizando temperaturas elevadas y catalizadores de paladio, pero los rendimientos son relativamente bajos y el producto así obtenido no puede considerarse natural26,27,28,29.
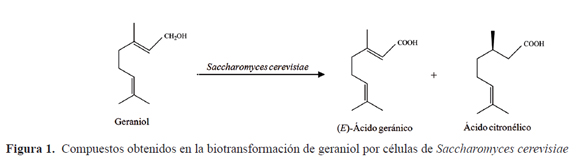
En cuanto a la biotransformación de geraniol con hongos, se destaca el bioproceso patentado a escala industrial para la producción de ácido geránico utilizando la levadura Saccharomyces cerevisiae. Bajo condiciones aeróbicas y pH alcalino, el geraniol fue enantioselectivamente oxidado a (E)-ácido geránico (85%) y (+)-ácido citronélico (15%) (Figura 1). El ácido geránico alcanzó una concentración máxima de 3,6 g/L después de 48 h de reacción5. En la Tabla 1, se presentan los hongos que han sido utilizados para la biotransformación de geraniol y los productos obtenidos en cada caso.
Respecto a las células vegetales, se han utilizado cultivos de Cucurbita maxima que transforman el geraniol en ácido geránico (5% de cantidad relativa)7.
Las células en cultivo suspendido de Catharanthus roseus llevaron a cabo la hidroxilación de geraniol en las posiciones alílicas y redujeron los dobles enlaces y los grupos cetona. Después de 2 días de incubación el geraniol fue convertido en 10-hidroxigeraniol, 10-hidroxinerol y 10-hidroxicitronelol (Figura 2), con rendimientos del 41,8%, 25,3% y 32,9%, respectivamente. La hidroxilación de geraniol fue en la posición del C-10, indicando selectividad. Además, habían varias posiciones alílicas disponibles, y la reducción del doble enlace ocurrió en la posición 2,3 en los productos identificados, indicando nuevamente selectividad36. Se ha identificado la enzima responsable de llevar a cabo estas hidroxilaciones, la geraniol 10-hidroxilasa (G10H), una monooxigenasa del grupo citocromo P45037. Los compuestos obtenidos son precursores de los alcoholes monoterpen-indólicos ajmalicina y serpentina, utilizados en el tratamiento contra la hipertensión, arritmias cardíacas y problemas de circulación sanguínea en el cerebro38.
Biotransformación de pineno
Después del limoneno, el pineno es el monoterpeno más abundante y el principal componente del aceite de trementina, obtenido de las resinas de plantas coníferas y como un subproducto de la industria del papel39,40.
La industria de fragancias y saborizantes consume aproximadamente 30000 toneladas de pinenos por año, los cuales se usan para producir un amplio rango de productos. El 84% de los derivados de los pinenos se producen por síntesis química39.
Las biotransformaciones de pineno se han llevado a cabo empleando bacterias, hongos y células vegetales. Entre las bacterias utilizadas, una cepa recombinante de Escherichia coli BL2141 llevó a cabo la oxifuncionalización del α-pineno a óxido de α-pineno, verbenol y mirtenol. En este caso, se alcanzó una concentración total de productos de 1 g/L, después de sólo 4 h de reacción, siendo el máximo valor reportado para la transformación de este sustrato.
También se ha reportado la obtención de verbenol (35% de rendimiento), acetato de dihidrocarveol (20%) y verbenona (10%) a partir de (+)-α-pineno empleando células de Pseudomonas putida, mientras que con el (-)-α-pineno y (-)-β-pineno no hubo biotransformación13.
En otro estudio se utilizó la cepa Pseudomonas sp. PIN, aislada del suelo y adaptada al sustrato en cultivos enriquecidos con α- y β-pineno, utilizados como la única fuente de carbono y energía. Los productos de biotransformación de α-pineno fueron identificados como limoneno, ρ-cimeno, α-terpinoleno, alcanfor, terpinen-4-ol, α-terpineol, endo-borneol y ρ-cimeno-8-ol40,42.
Algunas bacterias termófilas aeróbicas como Bacillus pallidus también presentan alta capacidad transformadora de α-pineno para la obtención de metabolitos como β-pineno, limoneno, pinocarveol, pinocarvona, mirtenol, mirtenal, carveol y carvona43.
Utilizando una cepa mutante de Pseudomonas fluorescens NCIMB 11671 se han producido mirtenol y mirtenal44. La biotransformación de α-pineno con esta cepa se ha estudiado desde los años 80s45.
Respecto a la biotransformación de α-pineno con hongos, en la Tabla 2 se muestran los diferentes trabajos realizados utilizando células fúngicas y los compuestos obtenidos en cada caso, siendo la verbenona y el verbenol los productos más abundantes.
En cuanto a las células vegetales, para la biotransformación de α-pineno se emplearon como catalizadores cultivos de Psychotria brachyceras y Rauvolfia sellowi y se encontró que Psychotria brachyceras solo actuó sobre el (-)-α-pineno produciendo trans-verbenol y (-)-verbenona, mientras que Rauvolfia sellowi actuó sobre el (-)-α-pineno y el (+)-α-pineno, produciendo trans-verbenol y (-)-verbenona a partir del (-)-α-pineno; y trans-verbenol y (+)-verbenona a partir del (+)-α-pineno14. En la Figura 3 se indican los mayores porcentajes de rendimiento y los días en los que se obtuvieron.
Se han reportado biotransformaciones eficientes de ambos enantiómeros de α-pineno empleando células vegetales de Picea abies inmovilizadas en alginato. Los productos principales fueron cis/trans verbenol y verbenona. La transformación empleando células vegetales libres ha demostrado ser más rápida que el empleo de células inmovilizadas15,16,17.
Se investigó la biotransformación del 2-pineno empleando suspensiones de células de las plantas Nicotiana tabacum y Catharanthus roseus. Los cultivos tuvieron la capacidad de introducir grupos funcionales oxigenados, como hidroxi y epoxi; la epoxidación ocurrió estéreo y enantioselectivamente, mientras que la hidroxilación se llevó a cabo regioselectivamente en la posición alílica del doble enlace carbono-carbono48. Como puede observarse, en la biotransformación de α-pineno se obtiene una amplia gama de productos, sin embargo, los más promisorios por su valor agregado y por sus propiedades farmacéuticas son el verbenol y la verbenona, cuyo costo promedio es de USD 3500/kg9 y USD 3000/kg10, respectivamente, mientras que el precio del α-pineno es de USD 4/kg10. La (+)-verbenona se utiliza como material de partida en síntesis asimétrica como precursor quiral en la preparación del diterpeno antitumoral taxol, usado en el tratamiento de cáncer de seno y ovario49. La (-)-verbenona se emplea como material de partida para preparar análogos del ácido γ-aminobutírico (GABA)14. La verbenona es el principal componente del aceite esencial de Spanish verbena (28,9%)50. La verbenona extraída es costosa e insuficiente para su demanda. Se han reportado varios sistemas para la oxidación alílica de α-pineno, pero debido al mecanismo de radicales de esta reacción no se ha encontrado un sistema selectivo al verbenol y verbenona. El verbenol y la verbenona se han sintetizado empleando catalizadores de cobre, cromo, rutenio y titanio51, pero los productos así obtenidos no pueden considerarse naturales.
Trabajos de biotransformación realizados en la
Universidad Industrial de Santander
En el Centro de Investigación en Ciencia y Tecnología de Alimentos –CICTA- de la Universidad Industrial de Santander –UIS-, se han llevado a cabo trabajos de biotransformación de diferentes monoterpenos como limoneno, citronelol, geraniol y (R)-(+)-α-pineno, empleando como catalizadores células de Aspergillus niger, Penicillium digitatum, Rhodococcus erythropolis y Rhodococcus opacus, y los productos obtenidos dependen del microorganismo y el medio de cultivo utilizado para la biotransformación. Por ejemplo, empleando la cepa Aspergillus niger DSM 821, se obtuvieron α-terpineol y ρ-mentano-1,8-diol como productos principales, con borneol y fenchol como productos minoritarios a partir del (R)-(+)-α-pineno en el medio de cultivo PDA (Potatoe Dextrose Agar). De otra parte, en medio PDB (Potatoe Dextrose Broth) sólo se obtuvo α-terpineol37, mientras que en otro estudio, utilizando el medio líquido Czapek, los productos obtenidos fueron canfeno, β-pineno, α-terpineol, verbenona y trans-sobrerol. Estos mismos estudios se realizaron con la cepa bacteriana Rhodococcus opacus DSM 44313 en el medio TSB (Triptone Soy Broth) y el producto principal fue el cis-verbenol. En cuanto al geraniol, se ha empleado la bacteria Rhodococcus opacus para la obtención de ácido geránico como producto principal52.
CONCLUSIONES
Se han publicado varios estudios en los que evalúan la biotransformación de sustratos económicos y biodisponibles como los monoterpenos, y específicamente del geraniol y el α-pineno, empleando células de plantas, hongos y bacterias, con el fin de obtener compuestos naturales de valor agregado.
Los procesos de biotransformación de geraniol conducen a la producción de diferentes compuestos, pero el más interesante por sus propiedades anticancerígenas es el ácido geránico, que se ha obtenido utilizando como biocatalizadores células de Saccharomyces cerevisiae, Cucurbita maxima y Rhodococcus sp. GR3.
La biotransformación de α-pineno con diferentes microorganismos permite la formación de distintos compuestos. Sin embargo, en la mayoría de casos se obtienen verbenol y verbenona, compuestos que se utilizan como materiales de partida para la síntesis de importantes productos farmacéuticos.
AGRADECIMIENTOS
Ministerio de Agricultura y Desarrollo Rural por el financiamiento del proyecto (contrato 2007V3400-134-612).
CONFLICTO DE INTERESES
Las autoras manifestamos que no tenemos conflictos de intereses.
REFERENCIAS
1. Serra S, Fuganti C, Brenna E. Biocatalytic preparation of natural flavours and fragrances. Tr Biotechnol 2005; 23(4): 193-198. [ Links ]
2. Rozembaum HF, Patitucci ML, Antunes OAC, Pereira N. Production of aromas and fragrances through microbial oxidation of monoterpenes. Braz J Chem Eng 2006; 23(03): 273-279. [ Links ]
3. De Carvalho CCR, Da Fonseca MMR. Biotransformation of terpenes. Biotechnol Adv 2006; 24: 134-142. [ Links ]
4. Van Der Werf M, Swarts HJ, De Bont JAM. Rhodococcus erythropolis DCL14 Contains a novel degradation pathway for limonene. Appl Environ Microbiol 1999; 2092-2102. [ Links ]
5. Whitehead IM, Ohleyer E. Process for the production of carboxylic acids from alcohols using Saccharomyces. 1997; US P. 5.599.700. [ Links ]
6. Chatterjee T. Biotransformation of geraniol by Rhodococcus sp. strain GR3. Biotechnol Appl Biochem 2004; 39: 303-306. [ Links ]
7. Nagaki M, Imaruoka H, Kawakami J, Kouichi S, Kitahara H, Sagami H, et al. Biotransformation of prenyl alcohols by cultured cells of Cucurbita maxima. J Mol Catal B: Enz 2007; 47: 33-36. [ Links ]
8. Pescheck M, Mirata MA, Brauer B, Krings U, Berger RG, Schrader J. Improved monoterpene biotransformation with Penicillium sp. by use of a closed gas loop bioreactor. J Ind Microbiol Biotechnol 2009; 36-827-836. [ Links ]
9. Vidya CM, Agrawal R. Production of verbenol, a high valued food flavourant from a fusant strain of Aspergillus niger. Appl Microbiol Biotechnol 2003; 62: 421-422. [ Links ]
10. Agrawal R, Joseph R. Bioconversion of alpha pinene to verbenone by resting cells of Aspergillus niger. Appl Microbiol Biotechnol 2000; 53: 335-337. [ Links ]
11. Van Dyk MS, Van Rensburg E, Moleleki N. Hydroxylation of (+)limonene, (-)α-pinene and (-)β-pineno by a Hormonema sp. Biotechnol Lett 1998; 20(4): 431-436. [ Links ]
12. Farooq A, Tahara S, Choudhary MI, Rahman AU, Ahmed Z, Baser KHC, et al. Biotransformation of (-)-α-pinene by Botrytis cinerea. Z Naturforsch 2002; 57: 686-690. [ Links ]
13. Divyashree MS, George J, Agrawal L R. Biotransformation of terpenic substrates by resting cells of Aspergillus niger and Pseudomonas putida isolates. J Food Sci Tech 2006; 43(1): 73-76. [ Links ]
14. Limberger RP, Aleixo AM, Fett-Neto AG, Henriques AT. Bioconversion of (+)-and (-)-alpha-pinene to (+)-and (-)-verbenone by plant cell cultures of Psychotria brachyceras and Rauvolfia sellowii. Electron J Biotechnol 2007; 10(4): 500-507. [ Links ]
15. Vanek T, Halik J, Vankiva R, Valterova I. Formation of trans-verbenol and verbenone from α-pinene catalysed by immobilised Picea abies cells. Biosci Biotechnol Biochem 2005; 69: 321-325. [ Links ]
16. Lindmark M, Isaksson D, Vanek T, Valterova I, Hogberg HE, Sjodin K. Transformation of terpenes using a Picea abies suspension culture. J Biotechnol 2004; 107: 173-184. [ Links ]
17. Lindmark M, Isaksson D, Sjodin K, Hogberg HE, Vanek T, Valterova I. Transformation of α-pinene using Picea abies suspension culture. J Nat Prod 2003; 66: 337-343. [ Links ]
18. Pinheiro L, Marsaioli AJ. Microbial monooxygenase applied to fragrance compounds. J Mol Catal B: Enz 2007; 44: 78-86. [ Links ]
19. Valadez R, Castelo F, Ferreira R, Guy A. A membrane bioreactor for biotransformations of hydrophobic molecules using organic solvent nanofiltration (OSN) membranes. J Membr Sci 2008; 317: 50-64. [ Links ]
20. Giri A, Dhingra V, Giri CC, Singh A. Biotransformation using plant cells, organ cultures and enzyme systems: current trends and future prospects. Biotechnol Adv 2001; 19: 175-199. [ Links ]
21. Straathof AJJ, Panke S, Schmid A. The production of fine chemicals by biotransformations. Curr Opin Biotechnol 2002; 13: 548-556. [ Links ]
22. Pollard DJ, Woodley JM. Biocatalysis for pharmaceutical intermediates: the future is now. Trends Biotechnol 2006; 25: 66-73. [ Links ]
23. Schulze B, Wubbolts MG. Biocatalysis for industrial production of fine chemicals. Curr Opin Biotechnol 1999; 10: 609-615. [ Links ]
24. Sell C. A fragant introduction to terpenoid chemistry. Cambridge: The Royal Society of Chemistry. 2003: p. 410. [ Links ]
25. Demyttenaere J, De Kimpe N. Biotransformation of terpenes by fungi. Study of the pathways involved. J Mol Catal B: Enz 2001; 11: 265-270. [ Links ]
26. Aquino F, Bonrath W, Crevatin A. Process for the preparation of methylheptenone. 2008. US. P. 7.319.172. [ Links ]
27. Krill S, Krethz S, Schneider A. Preparation of 6-methylheptanone. 2003. US. P. 6.605.746. [ Links ]
28. Ember G. Preparation of 6-methyl-5-hepten-2-one. 1973. US. P. 3.864.403. [ Links ]
29. Halder N, Frick H. Preparation of methylheptenone. 1973. US. P. 3.911.019. [ Links ]
30. Wolken WAM, Van Der Werf MJ. Geraniol biotransformation–pathway in spores of Penicillium digitatum. Appl Microbiol Biotechnol 2001; 57: 731-737. [ Links ]
31. Demyttenaere JCR, De Pooter HL. Biotransformation of citral and nerol by spores of Penicillium digitatum. Flavour Fragr J 1998; 13: 173-176. [ Links ]
32. Demyttenaere JCR, Herrera MC, De Kimpe N. Biotransformation of geraniol, nerol and citral by sporulated surface cultures of Aspergillus niger and Penicillium sp. Phytochemistry 2000; 55: 363-373. [ Links ]
33. Demyttenaere JCR, De Pooter HL. Biotransformation of geraniol and nerol by spores of Penicillium italicum. Phytochemistry 1996; 41: 1079-1082. [ Links ]
34. Madyastha KM, Krishna NSR. Regiospecific hydroxylation of acyclic monoterpene alcohols by Aspergillus niger. Tetrahedron Lett 1988; 29(5): 579-580. [ Links ]
35. Bock G, Benda I, Schreier P. Microbial transformation of geraniol and nerol by Botrytis cinerea. Appl Microbiol Biotechnol 1988; 27: 351-357. [ Links ]
36. Hamada H, Yasumune H, Fuchikami Y, Hirata T, Sattler I, Williams HJ, et al. Biotransformation of geraniol, nerol and (+)-and (-)-carvone by suspension cultured cells of Catharanthus roseus. Phytochemistry 1997; 44(4): 615-621. [ Links ]
37. Collu G, Unver N, Anja MG, Looman P, Van Der Heijden R, Verpoorte R, et al. Geraniol 10-hydroxylase, a cytochrome P450 enzyme involved in terpenoid indole alkaloid biosynthesis. FEBS Lett 2001; 508: 215-220. [ Links ]
38. Loyola V.; et al. Biosíntesis de los alcaloides indólicos. Una revisión crítica. Revista de la Sociedad Química de México 2004; 48: 67-94. [ Links ]
39. Toniazzo G, De Oliveira D, Dariva C, Oestreicher EG, Antunes OAC. Biotransformation of (-)-β-pinene by Aspergillus niger ATCC 9642. Appl Biochem Biotechnol 2005; 121: 837-844. [ Links ]
40. Yoo SK, Day DF. Bacterial metabolism of α- and β- pinene and related monoterpenes by Pseudomonas sp. strain PIN. Proc Biochem 2001; 36: 925–932. [ Links ]
41. Schewe H, Holtmann D, Schrader J. P450BM-3-catalyzed whole-cell biotransformation of α-pinene with recombinant Escherichia coli in an aqueous-organic two-phase system. Appl Microbiol Biotechnol 2009; 83:849-857. [ Links ]
42. Yoo SK, Day DF, Cadwallader KR. Bioconversion of α- and β- pinene by Pseudomonas sp. strain PIN. Proc Biochem 2001; 36: 925-432. [ Links ]
43. Savithiry N, Gage D, Fu W, Oriel P. Degradation of Pinene by Bacillus pallidus BR425. Biodegradation 1998; 9: 337-341. [ Links ]
44. Colocousi A, Saqib KM, Leak DJ. Mutants of Pseudomonas fluorescens NCIMB 11671 defective in the catabolism of α-pinene. Appl Microbiol Biotechnol 1996; 45: 822-830. [ Links ]
45. Best DJ, Floyd C, Magalhaes A, Burfield A, Rhodes PM. Initial enzymatic steps in the degradation of alpha-pinene by Pseudomonas fluorescens NCIMB 11671. Biocatalysis 1987; 1: 147-159. [ Links ]
46. Castellanos, F. Biotransformación de limoneno, α-pineno y aceites esenciales de naranja y mandarina empleando Aspergillus niger. Tesis de posgrado. Universidad Industrial de Santander. 2007. 120 p. [ Links ]
47. Limberger RP. Chemical composition of essential oil from Myrciinae (Myrtaceae) and terpenoids biotransformation. Caderno de Farmácia 2001; 118: 34-35. [ Links ]
48. Hirata T, Ikeda Y, Izumi S, Shimoda K, Hamada H, Kawamura T. Introduction of oxygenated functional groups into 3-carene and 2-pinene by cultured cells. Phytochemistry 1994; 37(2):401-403. [ Links ]
49. Maksimchuk NV, Melgunov MS, Mrowiec-Bailon J, Jarzebski AB, Kholdeeva OA. H2O2-based allylic oxidation of α-pinene over different single site catalysts. J Catal 2005; 235(1): 175-83. [ Links ]
50. Ravid U, Putievsky E, Katzir I, Lewinsohn E, Dudai N. Identification of (1R)(+)-verbenone in essential oils of Rosmarinus officinalis L. Flav Frag J 1997; 12(2):109-112. [ Links ]
51. Barrera RJ, Alarcón EA, González LM, Villa AL, Montes C. Síntesis de carveol, carvona, verbenol y verbenona. Ingeniería y Competitividad 2008; 10(1):43-63. [ Links ]
52. Rojas JP, Perea JA, Ortiz CC. Evaluación de la biotransformación de geraniol y (R)-(+)-α-pineno empleando células de Rhodococcus opacus DSM 44313 y Aspergillus niger DSM 821. Bucaramanga: Tesis de Maestría en Química. Universidad Industrial de Santander, 2009. p. 46-77. [ Links ]