Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807On-line version ISSN 2145-8464
Rev. Univ. Ind. Santander. Salud vol.42 no.1 Bucaramanga Jan./Apr. 2010
a sistema nervioso central en pacientes
con diagnóstico de leucemia linfoide
aguda. Resultados de una serie de casos
en el Hospital Universitario de Santander
Ernesto Rueda, Liliana Patricia Montero, Luis Alfonso Díaz.
Grupo Paidos, Departamento de Pediatría, Escuela de Medicina, Facultad de Salud, Universidad Industrial de Santander,
Bucaramanga, Colombia.
Correspondencia: Ernesto Rueda Arenas, MD, Grupo Paidos, Departamento de Pediatría, Hospital Universitario de Santander,
Carrera 33 # 28-126, 4° piso, Bucaramanga, Colombia. E-mail: ernesto@uis.edu.co
Recibido: 1 de marzo de 2010 - Aceptado: 30 de marzo de 2010
RESUMEN
Introducción: La leucemia linfoide aguda (LLA) es la neoplasia más común en niños; el 5-10 % presentan recaídas a sistema nervioso central (SNC), un factor de mal pronóstico. Objetivo: Describir los resultados obtenidos en una unidad de oncología pediátrica con el protocolo POG 9061 modificado, en pacientes con LLA y recaída aislada a SNC. Metodología: Cohorte de los pacientes atendidos en el Hospital Universitario de Santander (HUS). Se estimó la sobrevida libre de evento (SLE) y la sobrevida total (ST), así como las alteraciones resultantes del protocolo. Se incluyeron 15 pacientes atendidos entre enero/93 y marzo/07; el último diagnóstico de recaída al SNC se hizo en noviembre/04. Resultados: El 66,6 % de las recaídas se dieron antes de 18 meses luego de remitir la LLA. Dos pacientes abandonaron el protocolo, uno de los cuales falleció; dos o más fallecieron luego de terminar el protocolo. La ST a cinco años fue de 85,6 % (IC95 % 53,3-96,2), mientras que la SLE de 84,9 % (IC95 % 51,2-96,0 %). La complicación más frecuente fue mielosupresión; no hubo alteraciones de la función renal y solo una ligera elevación de las pruebas de función hepática. Las causas de hospitalización fueron principalmente infecciones. El coeficiente intelectual de los pacientes posterior a la aplicación del protocolo indicaba deficiencia leve en el 45,4 % de ellos. Conclusiones: La sobrevida, el tipo y la frecuencia de complicaciones, son similares a las encontradas a nivel mundial, lo que es relevante dada la alta proporción de pacientes con recaída precoz luego de remisión de la LLA. Salud UIS 2010; 42: 7-17
Palabras Claves: Leucemia linfoide, terapia, recurrencia local de neoplasia, vincristina, daunorrubicina
POG 9061 protocol to treat isolated central nervous
system recurrence in patients with acute lymphoid
leukemia at Hospital Universitario de Santander
ABSTRACT
Introduction: Acute lymphoblastic leukemia (ALL) is the most frequent neoplasm in children. Relapses to central nervous system (CNS) Appears in 5-10 % of the ALL patients and is a bad prognostic factor. Objective: To describe the results obtained with modified POG 9061 protocol in a pediatric oncology unit. Methodology: Survival analysis was made and main complications caused by protocol were analyzed in a retrospective cohort with all of patients attended for ALL with isolated relapse to CNS. Results: Fifteen patients attended from 1993 to 2007 were included; 66.6 % CNS relapses were early to 18 mounts following ALL remission. Two patients left protocol, with one death; there were another two deaths among other patients. Five year global survival rate was 85.6 % (95 %CI 53.3-96.2 %), and event-free survival rate was 84.9 % (95 %CI 51.2-96.0 %). The most frequent complication was mielosupression; renal function alteration was not observed, with a light elevation of hepatic function tests. Infection was the main hospitalization cause. Conclusions: Survival rates and complications (type and frequency) are similar to the other studies. This finding is relevant because half of the patients had early CNS relapse after ALL remission. Salud UIS 2010; 42: 7-17.
Keywords: Lymphoid leukemia, local neoplasm recurrence; vincristine, daunorrubicine
INTRODUCCIÓN
La leucemia linfoide aguda (LLA) es la neoplasia más común en niños; constituye el 35 % de todos los cánceres de la edad pediátrica y el 75 % de los casos de leucemia infantil1, 2. Antes de la incorporación de la terapia profiláctica a sistema nervioso central (SNC), las recaídas en este sitio eran los mayores impedimentos para la cura2. Hoy en día, estas recaídas solo se presentan en el 5-10 % de los pacientes en tratamiento, pero su presencia, al igual que hace varios años, continúa presagiando un pobre pronóstico para el paciente3-10. La búsqueda de medidas terapéuticas que permitan ser más efectivas en el manejo de las recaídas a SNC en pacientes con LLA representa uno de los desafíos investigativos más importantes en la actualidad.
En los últimos 20 años ha habido un notable avance en la sobrevida libre de eventos adversos entre los pacientes con tratamiento de LLA, llegando a una tasa de curación mayor del 70 % del total de pacientes tratados7-11, lo que se ha logrado gracias al trabajo de varios grupos cooperativos a nivel mundial2, 10-14. El propósito de estas investigaciones es encontrar el tratamiento que cause el mínimo de reacciones adversas, reduzca las intervenciones médicas (transfusiones de hemoderivados, dosis de radioterapia, número de hospitalizaciones, necesidad tratamiento antibiótico) y mantenga una adecuada calidad de vida en dichos pacientes15, 16.
El Grupo de Oncología Pediátrica (Pediatric Oncology Group), de los Estados Unidos, puso en marcha en 1990 el protocolo POG 9061 para el manejo de esta complicación; en este protocolo se aumentó el tiempo de quimioterapia sistémica y se redujo la cantidad de radiación craneal aplicada, responsable de la mayoría de secuelas, logrando una sobrevida libre de eventos a 4 años de 71,3 %1.
En este trabajo, se describen los resultados obtenidos en un grupo de pacientes con LLA y recaída aislada a SNC, atendidos entre enero de 1999 y marzo de 2007 en el Servicio de Oncología Pediátrica del Hospital Universitario Ramón González Valencia, ahora Hospital Universitario de Santander (HUS), y que hubiesen terminado el tratamiento.
METODOLOGÍA
Este es un estudio descriptivo de cohorte con recolección retroprospectiva de la información. Se incluyeron todos los pacientes con diagnóstico de LLA y recaída aislada a SNC. Los pacientes estaban clasificados como LLA L1 y L2, con categorización del riesgo en alto y estándar17. Se consideró paciente con recaída al SNC a todo aquel con LLA que presentara sintomatología neurológica, hallazgos en el citoquímico de líquido cefalorraquídeo (LCR) de más de 5 células mononucleares posterior a centrifugación, citología positiva o ambos. A estos pacientes se les aplicó el protocolo POG 90611, modificándolo para subsanar el hecho de que en Colombia no hay disponibilidad de mercaptopurina endovenosa, administrándola por vía oral con la misma dosificación e intervalo de tiempo (Tabla 1). Antes del inicio del protocolo se tomaron pruebas de función hepática (transaminasas, fosfatasa alcalina) y renal (nitrógeno ureico y creatinina), así como cuadro hemático; posteriormente se repitieron estos exámenes en cada una de las fases del protocolo para ver su evolución. Igualmente se registraron síntomas, procesos patológicos diagnosticados, hospitalizaciones requeridas, número de transfusiones y el tipo de hemoderivados utilizados. Se consideró remisión cuando se hallaron dos punciones lumbares sucesivas sin blastos, mientras que se consideró falla al tratamiento después de siete aplicaciones de medicación intratecal sin conseguir este resultado. Al terminar el tratamiento se les aplicó la Escala de Inteligencia para el Nivel Escolar Revisada (WISC-R), por parte de una psicóloga entrenada para ello18.
La información se consignó en una base de datos hecha en Epi Info 6.04d (Centers for Disease Control and Prevention; World Health Organization, 1993). El análisis de la información se realizó con STATA 9.0 (StataCorp, 2005), por medio de mediana, promedio y proporciones según fuera el tipo de variable. Se estimó la función de supervivencia a 5 años con el método de Kaplan–Meier, tanto para la sobrevida libre de evento (SLE) como la sobrevida total (ST), incluyendo la estimación de su intervalo de confianza del 95 % (IC95 %), así como la tasa de incidencia de muerte y nueva recaída por cada 10.000 días de seguimiento.
RESULTADOS
Características de los pacientes
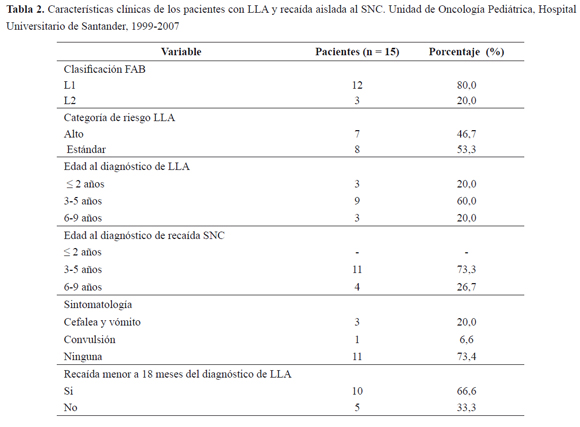
Desde enero de 1998, fecha en la que se hizo diagnóstico de LLA del primer paciente con recaída aislada a SNC incluido en este trabajo, a diciembre de 2004, en la unidad de Oncología Pediátrica del HUS se atendieron 173 pacientes con LLA tipo L1 y L2; 22 no completaron tratamiento para su patología en la institución.
De los pacientes en manejo por la unidad de oncología, 19 tuvieron recaída a SNC, 15 de ellos en forma aislada, cumpliendo todos los criterios de inclusión. El primer diagnóstico de recaída se hizo en octubre de 1999 y el último en noviembre de 2004. De estos, nueve (60,0 %) eran mujeres, diez (66,6 %) residían en zona urbana; once (73,3 %) vivían en Santander, tres (20,0 %) en Arauca y uno (6,7 %) en Bolívar; once (73,3 %) pacientes estaban afiliados al régimen subsidiado de seguridad social en salud.
La mediana de edad al momento del diagnóstico de LLA era 3,6 años, mientras la edad al momento del diagnóstico de recaída aislada a SNC era de 5,0 años. La mayoría de los pacientes tenían diagnóstico de LLA L1 con riesgo estándar, tal como se ve en la (Tabla 2). El tiempo entre la remisión de la LLA y la recaída aislada al SNC osciló entre 2 y 36 meses, siendo menor a 18 meses en el 66,9 % de los pacientes; tan solo uno de ellos había recibido radioterapia previo a la recaída. Aunque todos los pacientes tenían citología de LCR positiva al momento del diagnóstico, un 73,3 % no presentaba sintomatología.
Respuesta al tratamiento
El tiempo necesario para negativizar el LCR osciló entre 3 y 7 semanas, con promedio de 3,6 semanas. Al finalizar la fase de inducción, 14 de los 15 pacientes (93,3 %) tenía LCR negativo; un paciente requirió siete semanas para ello.
Dos niños abandonaron el protocolo por decisión propia y de su familia; uno de ellos falleció posteriormente con recaída a médula ósea y sepsis. De los que completaron el protocolo, dos fallecieron, uno por recaída a medula ósea a los 17 meses después de terminado el tratamiento (la única recaída entre los pacientes que finalizaron el tratamiento). El otro paciente falleció a los siete días de terminado el protocolo y en remisión completa dados los estudios realizados ocho días antes; el paciente ingresó al HUS en falla respiratoria. Los padres no permitieron realizar autopsia.
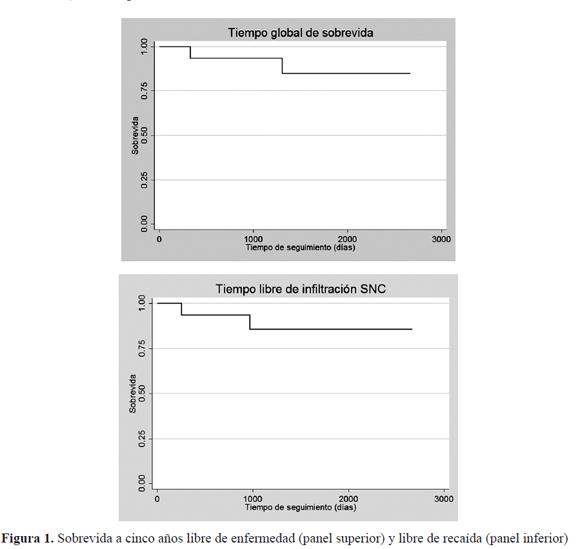
El estimado a cinco años de la ST de esta serie de pacientes fue de 85,6 % (IC95 % 53,3 a 96,2), con una densidad de incidencia de 8,2 fallecimientos por cada 10.000 días de seguimiento (IC95 % 1,4 a 33,1); la SLE a 5 años fue de 84,9 % (IC95 % 51,2 % a 96,0 %) con incidencia acumulada de 8.4 recaídas por cada 10.000 días de seguimiento (IC95 % 1,4 a 33,7); en la (Figura 1) se aprecian los estimados de Kaplan-Meier de la sobrevida de ambos indicadores.
Toxicidad
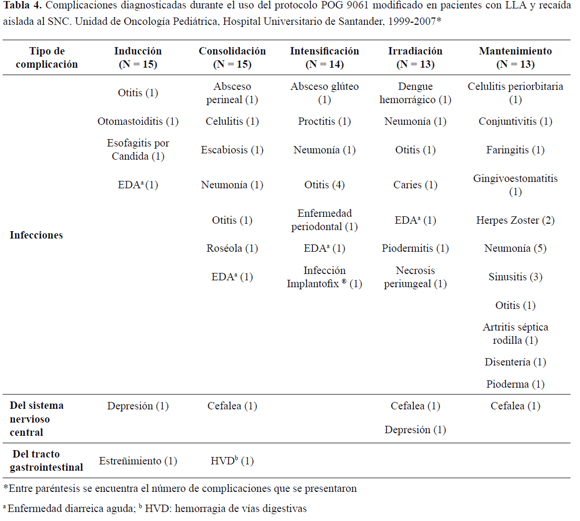
La reacción adversa más común en todas las fases del tratamiento fue la mielosupresión, con presencia de 386 episodios de neutropenia (68,5 % de todas las reacciones adversas), de las cuales 49 eran febriles (12,6 %). La mayoría de los episodios de mielosupresión se presentaron en la fase de mantenimiento, donde se vieron afectados el 92,3 % de los pacientes; el promedio por paciente de estos episodios fue de 22 eventos. La segunda complicación más frecuente fue la anemia (45 episodios) y trombocitopenia (25 episodios), siendo necesario administrar glóbulos rojos empaquetados compatibles en 36 ocasiones y plaquetas en 20 oportunidades (Tabla 3>Tabla 3).
La mayoría de los signos y síntomas que se presentaron como evento adverso del tratamiento correspondieron al tracto gastrointestinal, el respiratorio y síntomas constitucionales. Las entidades que con más frecuencia se vieron como complicación durante el tratamiento fueron de naturaleza infecciosa en todas las fases del protocolo; le siguieron en frecuencia problemas del SNC y del aparato gastrointestinal (Tabla 4). Se presentaron 32 hospitalizaciones por efectos adversos a lo largo del tiempo de aplicación del protocolo, con un promedio por paciente de 2,3 eventos. Ningún paciente desarrolló segundas neoplasias.
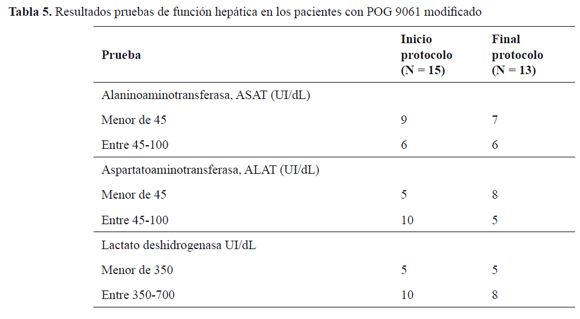
En las pruebas de función renal y hepáticas no hubo alteraciones clínicamente significativas. Los valores de creatinina estuvieron siempre dentro de límites normales en todos los pacientes, entre 0,30 y 0,70 mg/dL al inicio del protocolo y entre 0,22 y 0,63 mg/dL al finalizarlo. Seis pacientes (40,0 %) presentaron un ligero incremento de AST entre 45 y 100 UI/dL al inicio del protocolo, mientras que al final estaban en esos niveles seis de los trece pacientes que terminaron (46,2 %); a su vez, 10 (66,7 %) de los pacientes que iniciaron tenía ligero incremento de ALAT (entre 45 y 100 UI/dL), teniendo solo 5 (38,5 %) de los que terminaron iguales niveles; finalmente, 10 (66,7 %) de los pacientes que iniciaron tenían niveles elevados de lactato deshidrogenasa (350-700 UI/dL), frente a ocho de los trece que terminaron (61,5 %).
En once pacientes fue posible aplicar la escala de inteligencia para el nivel escolar revisada (WISC-R), encontrándose en cinco de ellos deficiencia mental leve (45,4 %), en dos deficiencia mental moderada (18,2 %) y los dos restantes con puntuación normal o por debajo de lo normal pero sin ser patológica.
DISCUSIÓN
La literatura muestra un descenso en los casos de recaídas a SNC desde que se incorporó la profilaxis a este nivel en los protocolos de manejo de la leucemia linfoide aguda1,7-9, particularmente luego del uso de dosis elevadas de metrotaxato intratecal19-24, cambiando la incidencia y patrones de presentación, aunque en algunos países persiste el problema25, 26. Es así como desde noviembre de 2004 a la fecha de terminar este informe (octubre de 2008) no se han presentado nuevos casos de recaída aislada a SNC en nuestra institución.
Los estudios de niños con recaídas a SNC han mostrado remisión entre el 10 % y el 70 % de los pacientes tratados1, 3, 7-9, con secuelas importantes sobre SNC producto de las dosis de radioterapia utilizadas27-9. Por lo anterior, en los últimos años se han diseñado protocolos de tratamiento en los cuales se hace intensificación de la terapia sistémica con drogas que tengan buena penetración al SNC, retardando la iniciación de la radioterapia y disminuyendo la dosis de la misma, logrando SLE a 4 años del 71,1 % como en el POG 90611.
En este trabajo se muestra que es posible tener una ST y SLE similar a las de los grupos internacionales de oncología pediátrica1, 7-10, siendo necesario para interpretar estos resultados que el 46,7 % de los pacientes tenían LLA de alto riesgo y que el 66,7 % habían tenido la recaída en los primeros 18 meses posteriores al diagnóstico. La posible explicación de estos buenos resultados pese a tener factores de mal pronóstico (riesgo alto y recaída antes de 18 meses), es que las dosis fraccionadas de metotrexato por vía oral que se administran con dicho protocolo no parecen proteger adecuadamente el SNC, aunque sí parecieran proteger contra recaída medular30.
En cuanto a la toxicidad del protocolo POG 9061 modificado, se puede apreciar que no hay alteración en las pruebas de función renal, aunque es necesario tener en cuenta que la prueba utilizada en esta evaluación solo mide en forma gruesa la función glomerular. Cabe recalcar que los pacientes se encontraban eutróficos al momento de realizar el examen. La función hepática estaba levemente alterada al finalizar el tratamiento en cerca de la mitad de los pacientes que lo finalizaron; sin embargo, desde el inicio del protocolo estas pruebas se encontraban alteradas, con reducción de los valores al terminar (Tabla 5).
La mielosupresión fue la principal reacción adversa, como se ha observado en los otros estudios1, 7 y de esta, la neutropenia es la más frecuente. A su vez, el WHISC-R muestra un deterioro cognitivo significativo en muchos pacientes, haciendo la salvedad que en ninguno de ellos se tenía evaluación de su nivel de inteligencia por esta prueba o alguna similar, antes del inicio del protocolo. Estos datos llaman la atención hacia la toxicidad de los medicamentos quimioterápicos y de la radioterapia sobre el SNC, siendo necesario clasificar muy estrictamente el riesgo del paciente, reemplazar la radioterapia por dosis extendidas de metotrexato intratecal y cuando sea absolutamente necesaria la irradiación, disminuir las dosis de la misma hasta 1200 a 1800 cGy11, 14. Igualmente se debe estudiar al paciente previo al inicio del tratamiento para establecer el déficit existente a fin de iniciar desde este momento un manejo adecuado. Por otro lado hay que tener en cuenta otros factores que influyen en estos resultados como el hecho de que el 45 % de los pacientes provienen de zona rural, sin acceso adecuado a educación formal y con padres en igual condición.
Los resultados obtenidos en este protocolo, donde la mayoría de los pacientes presentaron recaída temprana a SNC (antes de 18 meses de la remisión de la LLA), son satisfactorios, con sobrevida global y libre de evento a cinco años superior al 80 %, mejores incluso a los publicados en julio de 2006 por el Grupo de Oncología Pediátrica de los Estados Unidos, Protocolo 9412, en el cual se disminuyó la radioterapia craneal a 18 Gy sin radioterapia espinal (si la recaída fue después de 18 meses) y con prolongación de la quimioterapia sistémica 6 meses más, con lo cual se lograron tasas de remisión del 71%7.
Con el avance en los tratamientos para las patologías oncológicas en pediatría se estima que en un futuro cercano la tasa de curación de la LLA en la infancia alcanzará cifras del 90%31 y se estima que para el 2010 por cada 250 adultos habrá uno que sobrevivió a un cáncer en su infancia32, por lo que es de suma importancia encontrar el tratamiento que cause la mayor sobrevida con el mínimo de reacciones adversas. Un ejemplo de esas innovaciones es la esperanzadora utilidad del trasplante de medula ósea para tratar los niños con recaída aislada al SNC de mal pronóstico33, 34.
CONSIDERACIONES ÉTICAS
Previo al desarrollo de este estudio, se obtuvo consentimiento informado escrito de los padres para poder acceder a la información consignada en las historias clínicas. Este trabajo fue aprobado previamente por el Comité de Ética en Investigación de la Facultad de Salud de la Universidad Industrial de Santander.
CONFLICTOS DE INTERÉS
Los autores declaran que no hay conflictos de interés en este trabajo.
REFERENCIAS
1. Ritchey AK, Pollock BH, Lauer SJ, Andejeski Y, Barredo J, Buchanan GR. Improved survival of children with isolated CNS relapse of acute lymphoblastic leukemia: a pediatric oncology group study. J Clin Oncol 1999; 17:3745-37452. [ Links ]
2. Silverman LB, Declerck L, Gelber RD, Dalton VK, Asselin BL, Barr RD, et al. Results of Dana-Farber Cancer Institute Consortium protocols for children with newly diagnosed acute lymphoblastic leukemia (1981-1995). Leukemia 2000; 14:2247-2256. [ Links ]
3. Winick NJ, Smith SD, Shuster J, Lauer S, Wharam MD, Land V, et al. Treatment of CNS relapse in children with acute lymphoblastic leukemia: a Pediatric Oncology Group study. J Clin Oncol 1993:271-278. [ Links ]
4. Henze G, Fengler R, Hartmann R, Kornhuber B, Janka-Schaub G, Niethammer D, et al. Six year experience with a comprehensive approach to the treatment of recurrent childhood acute lymphoblastic leukemia (ALL-REZ BFM 85): A relapse study of the BFM group. Blood 1991; 78:1166-1172. [ Links ]
5. Mandell LR, Steinherz P, Fuks Z. Delayed central nervous system (CNS) radiation in childhood CNS acute lymphoblastic leukemia: Results of a pilot trial. Cancer 1990;66:447-450. [ Links ]
6. Gaynon PS, Trigg ME, Heerema NA, Sensel MG, Sather HN, Hammond GD, et al. Children's Cancer Group trials in childhood acute lymphoblastic leukemia: 1983-1995. Leukemia 2000; 14:2223-2233. [ Links ]
7. Barredo J, Meenakshi D, Lauer SJ, Billett A, Marymont MA, Pullen J, et al. Isolated CNS relapse of acute lymphoblastic leukemia treatment with intensive systemic chemotherapy and delayed CNS radiation: a pediatric oncology group study. J Clin Oncol 2006;24:3142-3149. [ Links ]
8. George SL, Ochs JJ, Mauer AM, Simone JV. The importance of an isolated central nervous system relapse in children with acute lymphoblastic leukemia. J Clin Oncol 1985; 3:776-781. [ Links ]
9. Ortega JA, Nesbit ME, Sather HN, Robinson LL, D´Angio GJ, Hammond GD. Long-term evaluation of a CNS prophylaxis trial--treatment comparisons and outcome after CNS relapse in childhood ALL: a report from the Children's Cancer Study Group. J Clin Oncol 1987;5:1646-1654. [ Links ]
10. Ribeiro RC, Rivera GK, Hudson M, Mulhern RK, Hancock ML, Larry Kun, et al. An intensive re-treatment protocol for children with an isolated CNS relapse of acute lymphoblastic leucemia. J Clin Oncol 1995; 13:333-338. [ Links ]
11. Pui CH, Evans WE. Treatment of acute lymphoblastic leukemia. N Engl J Med 2006; 354:166-178. [ Links ]
12. Kumar P, Kun LE, Hustu HO, Mulhern RK, Hancock ML, Coffey D, et al. Survival outcome following isolated central nervous system relapse treated with additional chemotherapy and craniospinal irradiation in childhood acute lymphoblastic leukemia. Int J Radiat Oncol Biol Phys 1995; 31:477-483. [ Links ]
13. Land VJ, Thomas PR, Boyett JM, Glicksman AS, Culbert S, Castleberry RP, et al. Comparison of maintenance treatment regimens for first central nervous system relapse in children with acute lymphocytic leukemia. A Pediatric Oncology Group study. Cancer 1985; 56:81-87. [ Links ]
14. Schrappe M, Reiter A, Ludwig WD, Harbott J, Zimmermann M, Hiddemann W, et al. Improved outcome in childhood acute lymphoblastic leukemia despite reduced use of anthracyclines and cranial radiotherapy: results of trial ALL-BFM 90. Blood 2000; 95: 3310-3322. [ Links ]
15. Winick NJ, Carroll WL, Hunger SP. Childhood Leukemia New advances and challenges. N Engl J Med 2004; 351:601-603. [ Links ]
16. Clarke M, Gaynon P, Hann I, Harrison G, Masera G, Peto R, et al. CNS-directed therapy for childhood acute lymphoblastic leukemia: Childhood ALL Collaborative Group overview of 43 randomized trials. J Clin Oncol 2003; 21:1798-1809. [ Links ]
17. Smith M, Arthur D, Camitta B, Carroll AJ, Crist W, Gaynon P et al. Uniform approach to risk classification and treatment assignment for children with acute lymphoblastic leukemia. J Clin Oncol 1996; 14:18-24. [ Links ]
18. Rosselli M, Matute A, Ardila A, Botero VE, Tangarife GA, Echeverri SE, et al. Evaluación Neuropsicológica Infantil (ENI): una batería para la evaluación de niños entre 5 y 16 años de edad. Estudio normativo colombiano. Rev Neurol 2004; 38: 720-731. [ Links ]
19. Gu LJ, Li J, Xue HL, Tang JY, Chen J, Zhao HJ, et al. Clinical outcome of children with newly diagnosed acute lymphoblastic leukemia treated in a single center in Shanghai, China. Leuk Lymphoma 2008; 49:488-494. [ Links ]
20. Tsuchida M, Ohara A, Manabe A, Kumagai M, Shimada H, Kikuchi A, et al. Long-term results of Tokyo Children's Cancer Study Group trials for childhood acute lymphoblastic leukemia, 1984-1999. Leukemia 2010; 24:383-396. [ Links ]
21. Krishnan S, Wade R, Moorman AV, Mitchell C, Kinsey SE, Eden TO, et al. Temporal changes in the incidence and pattern of central nervous system relapses in children with acute lymphoblastic leukaemia treated on four consecutive Medical Research Council trials, 1985-2001. Leukemia 2010; 24:450-459. [ Links ]
22. Möricke A, Zimmermann M, Reiter A, Henze G, Schrauder A, Gadner H, et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia 2010; 24:265-284. [ Links ]
23. Schmiegelow K, Forestier E, Hellebostad M, Heyman M, Kristinsson J, Söderhäll S, et al. Long-term results of NOPHO ALL-92 and ALL-2000 studies of childhood acute lymphoblastic leukemia. Leukemia 2010; 24:345-354. [ Links ]
24. Pui CH, Pei D, Sandlund JT, Ribeiro RC, Rubnitz JE, Raimondi SC, et al. Long-term results of St Jude Total Therapy Studies 11, 12, 13A, 13B, and 14 for childhood acute lymphoblastic leukemia. Leukemia 2010; 24:371-382. [ Links ]
25. Pattern of relapsed disease in childhood all: experience from a single tertiary care center in North India. Kulkarni KP, Marwaha RK, Trehan A, Bansal D. Pediatr Hematol Oncol 2009; 26:398-406. [ Links ]
26. Badell I, Muñoz A, Estella J, Fernández-Delgado R, Javier G, Verdeguer A, et al. Long-term results of two consecutive trials in childhood acute lymphoblastic leukaemia performed by the Spanish Cooperative Group for Childhood Acute Lymphoblastic Leukemia Group (SHOP) from 1989 to 1998. Clin Transl Oncol 2008; 10:117-124. [ Links ]
27. Anderson VA, Godber T, Smibert E, Weiskop S, Ekert H. Cognitive and academic outcome following cranial irradiation and chemotherapy in children: A longitudinal study. Br J Cancer 2000; 82:255-262. [ Links ]
28. Van Dongen-Melman JEWM, De Groot A, Van Dongen JJM, Verhulst FC, Hählen K. Cranial irradiation is the major cause of learning problems in children treated for leukemia and lymphoma: A comparative study. Leukemia 1997; 11:1197-1200. [ Links ]
29. Eiser C, Hill JJ, Vance YH. Examining the psychological consequences of surviving childhood cancer: systematic review as a research method in pediatric psychology. J Pediatr Psychol 2000; 25:449-460. [ Links ]
30. Winick N, Shuster JJ, Bowman WP, Borowitz M, Farrow A, Jacaruso D, et al. Intensive oral methotrexate protects against lymphoid narrow relapse in childhood B-precursor acute lymphoblastic leukemia. J Clin Oncol 1996; 14:2803-2811. [ Links ]
31. Pui C-H, Relling MV, Sandlund JT, Downing JR, Campana D, Evans WE. Rationale and design of Total Therapy Study XV for newly diagnosed childhood acute lymphoblastic leukemia. Ann Hematol 2004; 83(Suppl 1):124-126. [ Links ]
32. Bleyer WA. The impact of childhood cancer on the United States and the world. CA Cancer J Clin 1990; 40:355-367. [ Links ]
33. Harker-Murray PD, Thomas AJ, Wagner JE, Weisdorf D, Luo X, DeFor TE, et al. Allogeneic hematopoietic cell transplantation in children with relapsed acute lymphoblastic leukemia isolated to the central nervous system. Biol Blood Marrow Transplant 2008; 14:685-692. [ Links ]
34. Eapen M, Zhang MJ, Devidas M, Raetz E, Barredo JC, Ritchey AK, et al. Outcomes after HLA-matched sibling transplantation or chemotherapy in children with acute lymphoblastic leukemia in a second remission after an isolated central nervous system relapse: a collaborative study of the Children's Oncology Group and the Center for International Blood and Marrow Transplant Research. Leukemia 2008; 22:281-286. [ Links ]