Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807On-line version ISSN 2145-8464
Rev. Univ. Ind. Santander. Salud vol.42 no.3 Bucaramanga Sept./Dec. 2010
Tumor fusocelular hialinizante con
rosetas gigantes. Reporte de un caso
Tumor fusocelular hialinizante
Ernesto García Ayala1, Carlos A. García Ramirez2, Mario A. Melo-Uribe1, Paula A. Barajas-Solano1
1. Universidad Industrial de Santander, Bucaramanga, Colombia
2. Hospital Universitario de Santander, Bucaramanga, Colombia
Correspondencia: Ernesto García, MD, Patólogo, Departamento de Patología, Universidad Industrial de Santander, Hospital Universitario de Santander,
Facultad de Salud, Carrera 32 N° 29-31, Colombia E-mail: egarcia@uis.edu.co, paoleja128_3@hotmail.com.
Recibido: 30 de noviembre de 2010- Aceptado: 13 de diciembre de 2010
RESUMEN
Introducción: El tumor fusocelular hialinizante con rosetas gigantes es una neoplasia constituida por dos componentes histológicos, uno celular con elementos fusiformes, y el segundo representado por islas bien delimitadas casi acelulares, llenas de material hialino, rodeadas de células redondas u ovales, las cuales muestran un perfil inmunohistoquímico inusual, e histogénesis incierta. Objetivo: Instruir a los patólogos y clínicos sobre este tumor, su forma de presentación y diagnósticos diferenciales. Metodología y resultados: Se presenta el caso de una mujer de 42 años con masa ubicada en región inguinal, de crecimiento progresivo (1 año), que se reseca quirúrgicamente anatomía patológica informó un tumor fusocelular hialinizante con rosetas gigantes, según hallazgos morfológicos e inmuno histoquímicos, en correlación con su localización y cuadro clínico. Conclusión: Se hace necesario ampliar el conocimiento sobre esta entidad y de esta forma obtener una adecuada evaluación de sus criterios pronósticos histológicos, comportamiento clínico y tratamiento. Salud UIS 2010; 42: 282-286
Palabras Clave: Tumor fusocelular hialinizante con rosetas gigantes, fibrosarcoma, sarcoma fibromixoide de bajo grado, inmunohistoquímica
Hyalinizing spindle cell tumor with giant rosettes. Case report.
ABSTRACT
Introduction: The hyalinizing spindle cell tumor with giant rosettes is a neoplasia characterized by both histologic components, one of which is cellular, with spindle-shaped elements and the second represented by well defined almost acellular islands filled with hyaline material surrounded by round to oval cells, which shows an unusual immunohistochemical profile and uncertain histogenesis. Objective: Educate pathologists and clinicians about this tumor, its presentation and differential diagnosis. Methods and results: A case of a 42 year old woman with a mass located in the inguinal region, with progressive growth (1 year), surgically resected and histopathology reported as Hyalinizing spindle cell tumor with giant rosettes according to morphological, immunohistochemical findings correlates with its location and clinical. Conclusion: It is necessary to expand awareness about this condition and thus obtain a proper assessment of histological prognostic criteria, clinical behavior and treatment. Salud UIS 2010; 42: 282-286
Keywords: Hyalinizing spindle cell tumor with giant rosettes, grade fibromyxoid sarcoma, Immunohistochemistry
INTRODUCCIÓN
El tumor fusocelular hialinizante con rosetas gigantes (TFHRG) es un tumor fibroso poco frecuente de los tejidos blandos profundos, que fue descrito en 1997 por Lane y Cols1 en una serie de 19 casos. Es una neoplasia constituida por dos componentes histológicos. Uno de los cuales es celular, con elementos fusiformes, y el segundo está representado por islas bien delimitadas casi acelulares, llenas de material hialino, caracterizadas por estar rodeadas de células redondas u ovales, las cuales muestran un perfil inmunohistoquímico inusual2.
La mayor parte de los pacientes con un TFHRG tiene entre 20 y 40 años y los varones se afectan con casi la misma frecuencia que las mujeres3. Todos los casos publicados hasta el momento se han comportado de forma indolente, aunque en algunos casos poco frecuentes, lo han hecho de forma agresiva, con metástasis precoces y tardías5,6,7. Debido a las notables similitudes en las características histológicas, moleculares y clínicas del TFHRG con el sarcoma fibromixoide de bajo grado, actualmente existen pruebas suficientes para apoyar la idea que el TFHRG es un subgrupo del mismo4 y por tanto esta entidad se encuentra clasificada actualmente por la OMS como una variante del sarcoma fibromixoide de bajo grado. De igual forma, su identificación y diagnostico temprano son variables importantes en el pronóstico de la enfermedad debido a su alta tendencia a recurrir de forma local y a distancia, siendo importante instruir a los patólogos y clínicos sobre este tumor, su forma de presentación y diagnósticos diferenciales.
A continuación se describe un caso de TFHRG en una mujer de 42 años de edad, y se discute su probable origen, relación con el sarcoma fibromixoide de bajo grado, comportamiento clínico y tratamiento.
CASO CLÍNICO
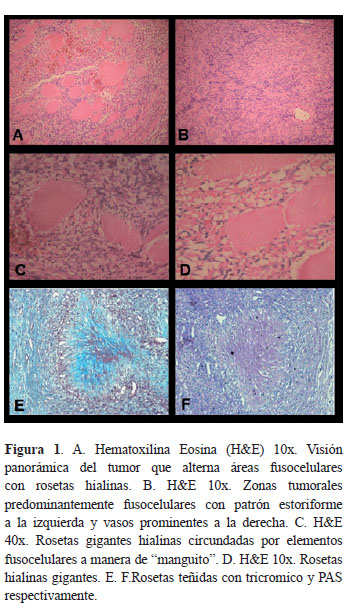
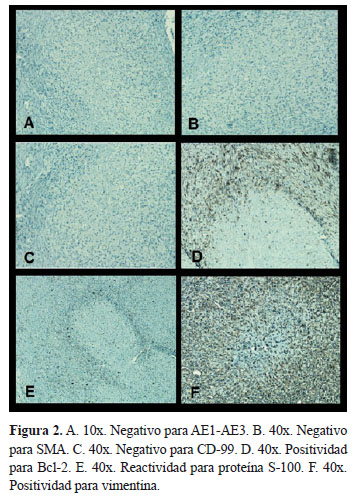
Mujer de 42 años con masa ubicada en región inguinal derecha de crecimiento progresivo (1 año), indolora, móvil, no fija a planos profundos ni dolorosa; la piel suprayacente era macroscópicamente normal. Se reseca quirúrgicamente y el examen macroscópico muestra masa oval irregular, amarillenta, bien delimitada, de consistencia firme, con superficie de corte homogénea. Mide 6,8x5,3 cm en sus dimensiones mayores cruzadas. Los cortes microscópicos de rutina obtenidos por inclusión en parafina y coloreados con hematoxilina-eosina evidencian lesión tumoral de origen mesenquimal en la cual alternan áreas celulares constituidas por elementos entre ovales y fusiformes de extremos ovalados, dispuestos en un patrón arquitectural que predominantemente forma haces cortos, que alternan con áreas estoriformes y que recuerdan en algunas zonas cuerpos de Verocay, que rodean numerosas rosetas hialinas de mediano y gran tamaño, bien delimitadas y circundadas por elementos celulares similares a los anteriormente descritos y dispuestos focalmente a manera de "manguito". También se reconocen zonas mixoides y se destaca focalmente presencia de vasos sanguíneos de pequeño calibre (Figura 1, Fotos A, B, C, D). Los estudios de histoquímica (tricromico y PAS) destacaron las rosetas gigantes hialinas (Figura 1, Fotos E y F). Los estudios de inmunohistoquímica fueron negativos para queratinas, actina de musculo liso, y CD 99; y fuertemente positivo para bcl-2, vimentina y S-100 (Figura 2, Fotos A, B, C, D, E).
DISCUSIÓN
El TFHRG es una neoplasia poco frecuente, más común en adultos jóvenes de mediana edad, caracterizado histológicamente por formación de rosetas gigantes con núcleos de colágeno distribuidos a lo largo de este y por su estroma fibromixoide. El término "tumor fusocelular hialinizante con rosetas gigantes" es una forma descriptiva de nombrar esta neoplasia, basada en las características microscópicas del tumor, ya que su histogénesis continua siendo controversial. Muchos estudios ultraestructurales favorecen la teoría en la cual se plantea que las células tumorales se originan a partir de fibroblastos con o sin diferenciación miofibroblástica focal, independiente de si están o no asociados con rosetas1,7,8. Sin embargo, las células tumorales con características dendríticas, de células de schwan y neuroendocrinas también se han descrito1, 9,10. El núcleo de colágeno en el centro de las rosetas tiene hallazgos ultraestructurales de colágeno nativo normal11, y en algunos casos, se ha descrito la posibilidad que estos elementos se generen por coalescencia de células fusiformes alrededor de vasos hialinizados anormales12.
El síntoma de presentación más frecuente es una masa indolora y profunda, que aumenta de tamaño de forma progresiva y puede llevar de meses a años en consultar. Este tumor se localiza sobre todo en las extremidades, particularmente el muslo. Otras zonas afectadas menos frecuentemente incluyen la pared torácica, la axila, la cabeza y el cuello, el epiplón, la pelvis y el mediastino13, 14.
La mayor parte de los ejemplos de TFHRG se originan en el musculo esquelético, aunque algunos parecen centrarse en el tejido subcutáneo, como en este caso, con afectación muscular mínima o nula. Recientemente Billings y cols han descrito un grupo importante de estos tumores con afectación de la dermis15. El tamaño de la lesión se encuentra en un rango de 1,5 a 13 cm, de forma redonda a oval, bien circunscritas por una pseudocápsula delgada. Aunque está bien delimitado desde el punto de vista macroscópico, es frecuente encontrar extensa infiltración microscópica de los tejidos blandos circundantes; posibilidad esta ultima que debe ser tenida en cuenta cuando se planea la extirpación quirúrgica de la lesión. Presenta una consistencia firme y la superficie de corte es homogénea, blanco- amarillenta con áreas brillantes focales por la acumulación de sustancia fundamentalmente mixoide. En algunos casos se han descrito cambios degenerativos quísticos, pero no hemorragia o necrosis por coagulación tumoral.
El rasgo más característico de esta neoplasia desde el punto de vista histopatológico es la presencia en un número variable de estructuras grandes a modo de rosetas, que se confunden íntimamente con el estroma fusiforme o hialinizado circundante, constituidas por un núcleo central de colágeno eosinofilo brillante y birrefringente, que se encuentra dispuesto de forma centrifuga desde el centro y se rodea de células redondeadas a ovoides con citoplasma claro a eosinofilo, con atipia nuclear leve o nula y sin mitosis. Otras características incluyen presencia de depósito de hemosiderina, degeneración quística, calcificación, metaplasia ósea y condroide e inflamación crónica periférica. Aunque la microscopia de rutina con técnica de inclusión en parafina y coloración con Hematoxilina-eosina sugiere que los depósitos en el núcleo de las rosetas están conformados con colágeno tipo IV, las tinciones de inmunohistoquímica fallaron en marcarlo, (aunque si fueron muy positivas entre las células fusiformes del estroma tumoral) y los pocos estudios que han realizado microscopía electrónica mostraron características más coherentes con colágeno tipo I y no con el tipo IV clásicamente descrito2.
Los estudios de inmunohistoquímica realizados al TFHRG han informado resultados variables. El inmunofenotipo del TFHRG es bastante parecido al descrito en el sarcoma fibromixoide de bajo grado. Los hallazgos más consistentes son la positividad de vimentina en ambos tipos celulares, las células fusiformes del estroma y las células alrededor de las rosetas, las cuales a veces también expresaron proteína S-100, CD57, PGP 9,5 y enolasa neuronal especifica. La expresión de vimentina demuestra que las células tumorales se originan a partir de células mesenquimales más relacionadas con los fibroblastos8, 9, pero la razón para la expresión de proteína S-100, CD57, NSE y PGP 9,5, aunque permanece desconocida, sugiere más un fenotipo neural. En el presente caso en concordancia con lo anteriormente descrito se destaco positividad intensa para la vimentina, e igualmente para S-100.
Los primeros estudios citogenéticos que fueron realizados al sarcoma fibromixoide de bajo grado demostraron un cromosoma supernumerario en anillo, que se encontraba formado por material de los cromosomas 7 y 16, el cual fue detectado mediante hibridación genómica comparada16. En los trabajos realizados posteriormente se ha confirmado la presencia de una traslocacion característica en la cual participa el gen FUS del cromosoma 7 y el gen CREB3L2 del cromosoma 1617,18. Teniendo en cuenta las características clínicas e histológicas que comparten el TFHRG con el sarcoma fibromixoide de bajo grado, se han realizado estudios citogenéticos a favor que se trata de tumores relacionados, evidenciando que esta misma traslocacion se encuentra en los casos de TFHRG, lo cual confirma la teoría que ambos tumores guardan una estrecha relación19.
La escisión extensa de la lesión asociado a seguimiento prolongado a fin de detectar recurrencia local y a distancia de la enfermedad, especialmente en los pulmones, es la mejor opción de tratamiento. No se sugieren la quimioterapia adyuvante ni la radioterapia debido a la naturaleza de crecimiento lento del tumor. El pronóstico es más favorable con los tumores que se detectan pronto y son extirpados de forma agresiva con márgenes quirúrgicos adecuados. De igual forma es importante resaltar que ni el tamaño del tumor, ni la presencia de zonas de alto grado en el tumor se asocian con un mayor riesgo de recidiva local y metástasis12.
Aunque originalmente se consideraron entidades distintas, el sarcoma fibromixoide de bajo grado y el TFHRG se incluyen ahora como parte de un mismo espectro histológico, es decir, ambos se ubican dentro del espectro de los sarcomas fibromixoides de bajo grado, con un curso más indolente de lo que se había informado anteriormente. Las razones para considerarlo así son: edad de presentación y localización anatómica parecida, estroma fusocelular idéntico, que incluye la presencia ocasional de fibrosarcoma de grado intermedio y la identificación de la misma traslocacion característica t(7;16)19,20.
Sin embargo, algunos autores critican esta posición si se tiene en cuenta que en algunos casos se ha documentado diferenciación de células de schwan, histiocitos o células neuroendocrinas de manera ocasional en las rosetas del TFHRG y que no se encuentran en el sarcoma fibromixoide de bajo grado. Por otra parte, las características poco comunes de la invasión vascular y necrosis isquémica ocasionalmente encontrados en el sarcoma fibromixoide de bajo grado no se han descrito en TFHRG21.
Los tumores TFHRG se pueden confundir con otros tumores que forman rosetas de colágeno gigantes, como el neurilemoma parecido al neuroblastoma, variante extremadamente rara pero histológicamente diferente del Schwannoma benigno, en el que las rosetas tienen un núcleo de colágeno rodeado de pequeñas células de Schwann redondeadas y diferenciadas22. De igual forma algunos casos poco frecuentes de osteosarcoma contienen áreas de rosetas similares a las descritas en el TFHRG, pero en estos casos el centro corresponde a un material parecido a osteoide, con calcificación central frecuente y rodeado de células con más pleomorfismo nuclear que el observado en los TFHRG. Las zonas fusocelulares de esta lesión pueden parecerse a la Fibromatosis pero en esta lesión existe una celularidad mas uniforme con disposición fascicular franca y no se evidencian las estructuras tipo roseta.
En resumen, la presentación de este caso de TFHRG busca resaltar la importancia de esta neoplasia poco frecuente de tejidos blandos, estimulando su abordaje adecuado y reconocimiento oportuno, especialmente por patólogos, quienes deben tener presentes las características clave para su diagnóstico apropiado, considerando el potencial de recidiva y metastásico con el que cuenta esta lesión a pesar de su morfología aparentemente benigna.
AGRADECIMIENTOS
Nuestros agradecimientos mas sinceros a la Universidad Industrial de Santander y al Hospital Universitario de Santander, instituciones que han sido apoyo fundamental en el desarrollo académico de los autores, y en la realización de este artículo.
CONFLICTOS DE INTERÉS
Los autores manifiestan que no se presentó conflicto de interés alguno durante la ejecución de este trabajo.
REFERENCIAS
1. Lane KL, Shannon RJ, Weiss SW. Hyalinizing spindle cell tumor with giant rosettes. A distinctive tumor closely resembling low-grade fibromixoid sarcoma. Am J Surg Pathol 1997; 21 (12): 1481-1488. [ Links ]
2. Bejarano PA, Padhya TA, Smith R, Blough R, et al. Hyalinizing spindle cell tumor with giant rosettesA soft tissue tumor with mesenchymal and neuroendocrine features an immunohistochemical, ultrastructural, and cytogenetic analysis. Arch Pathol Lab Med 2000; 24: 1179-1184. [ Links ]
3. Enzinger, F. M., and Weiss, S. W.: Soft Tissue Tumors, pp. 6-7. St. Louis, C. V. Mosby, 1983. [ Links ]
4. Goodlad JR, Mentzel T, Fletcher CD. Low grade fibromyxoid sarcoma: clinicopathological analysis of eleven new cases in support of a distinct antity. Histopathology 1995; 26: 229. [ Links ]
5. Chang E, Lee A, Lee E, Shin O, Kang C, Kim JM, Chu YC. Hyalinizing spindle cell tumor with giant rosettes with pulmonary metastasis after a long hiatus: a case report. J Korean Med Sci 2004 Aug; 19(4): 619-623. [ Links ]
6. O'Sullivan MJ, Sirgi KE, Dehner LP. Low-grade fibrosarcoma (hyalinizing spindle cell tumor with giant rosettes) with pulmonary metastases at presentation: case report and review of the literature. Int J Surg Pathol 2002 Jul; 10(3): 211-216. [ Links ]
7. Woodruff JM, Antonescu CR, Erlandson RA, Boland PJ. Low-grade fibrosarcoma with palisaded granulomalike bodies (giant rosettes): report of a case that metastasized. Am J Surg Pathol 1999 Nov; 23(11): 1423-1428. [ Links ]
8. Nielsen GP, Selig MK, O'Connell JX, et al. Hyalinizing spindle cell tumor with giant rosettes: a report of three cases with ultrastructural analysis. Am J Surg Pathol 1999; 23:1227-1232. [ Links ]
9. Bejarano PA, Padhya TA, Smith R, et al. Hyalinizing spindle cell tumor with giant rosettes – a soft tissue tumor with mesenchymal and neuroendocrine features: an immunohistochemical, ultrastructural, and cytogenetic analysis. Arch Pathol Lab Med 2000; 124: 1179-1184. [ Links ]
10. De Pinieux G, Anract P, Le Charpentier M, et al. A case of hyalinizing spindle cell tumor with giant rosettes in the presacral region. Immunohistochemical and ultrastructural study. Ann Pathol 1998; 18: 488-491. [ Links ]
11. Ludvikova M, Michal M, Zamecnik M. Hyalinizing spindle cell tumors with giant rosette-like structures. Pathol Res Pract 1998; 194: 577-81. [ Links ]
12. Folpe AL, Lane KL, Paull G, et al. Low-grade fibromyxoid sarcoma and hyalinizing spindle cell tumor with giant rosettes: a clinicopathologic study of 73 cases supporting their identity and assessing the impact of high-grade areas. Am J Surg Pathol 2000; 24:1353-1360. [ Links ]
13. Galetta D, Cesario A, Magaritora S, et al. Primary mediastinal hyalinizing spindle cell tumor with giant rosettes. Ann Thorac Surg 2004; 77: 2206. [ Links ]
14. Koishi A, Gomibuchi H, Inoue J, et al. Hyalinizing spindle cell tumor with giant rosettes of the omentum. J Obstet Gynaecol Res 2003; 29: 388-391. [ Links ]
15. Billings SD, Giblen G, Fanburg-Smith JC. Superficial low-grade fibromyxoid sarcoma (Evans tumor): a clinicopathologic analysis of 19 cases with a unique observation in the pediatric population. Am J Surg Pathol 2005; 29: 204-210. [ Links ]
16. Mezzalini A, Sozzi G, Nessling M, et al. Low grade fibromyxoid sarcoma: a further low-grade soft tissue malignancy characterized by a ring chromosome. Cancer Genet Cytogenet 2000; 122: 144-148. [ Links ]
17. Storlazzi CT, Mertens F, Nascimento A, et al. Fusion of the FUS and BBF2H7 genes in low grade fibromyxoid sarcoma. Hum Mol Genet 2003; 12: 2349-2358. [ Links ]
18. Panagopoulos I, Storlazzi CT, Fletcher C, et al. The chimeric FUS/CREB3L2 gene is specific for low-grade fibromyxoid sarcoma. Gene Chromosome Can 2004; 40: 218-228. [ Links ]
19. Reid R, deSilva C, Paterson L, Ryan E, Fisher C. Low-grade fibromyxoid sarcoma and hyalinizing spindle cell tumor with giant rosettes share a common t(7;16)(q34;p11) translocation. Am J Surg Pathol 2003; 27: 1229-1236. [ Links ]
20. Hornick JL, Fletcher CDM. Soft tissue perineurioma: clinicopathologic analysis of 81 cases including those with atypical histologic features. Am J Surg Pathol 2005; 29: 845-858. [ Links ]
21. Scolyer RA, McCarthy SW, Wills EJ, et al. Hyalinizing spindle cell tumour with giant rosettes: report of a case with unusual features including original histological and ultrastructural observations. Pathology 2001; 33: 101-107. [ Links ]
22. Goldblum JR, Beals TF, Weiss SW. Neuroblastoma-like neurilemoma. Am J Surg Pathol 1994; 18: 266-273. [ Links ]