Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807On-line version ISSN 2145-8464
Rev. Univ. Ind. Santander. Salud vol.43 no.3 Bucaramanga Oct./Dec. 2011
Actividad antiinflamatoria
de flores y hojas de
Caesalpinia pulcherrima L. (Swartz)
Germán Eduardo Matiz1, Luis Alberto Franco O.1, Javier Rincón2
1. Departamento de Farmacia, Facultad de Ciencias Farmacéuticas Universidad de Cartagena
2. Departamento de Farmacia, Facultad de Ciencias, Universidad Nacional de Colombia, Sede Bogotá.
Correspondencia: Germán Eduardo Matiz M. Ph.D. Departamento de Farmacia, Facultad de Ciencias Farmacéuticas Universidad
de Cartagena, Grupo de Investigación en Tecnología Farmacéutica, Cosmética y de Alimentos –GITFCA- gmatizm@unicartagena.edu.co.
Telefax: (5)6698323
Recibido: 21 de Octubre de 2011- Aceptado: 3 de Noviembre de 2011
RESUMEN
Introducción: Partes aéreas de la planta Caesalpinia pulcherrima L. (Swartz) han sido usadas en medicina tradicional al sur del Departamento de Cundinamarca para el tratamiento de afecciones inflamatorias. Objetivo: Evaluar la actividad antiinflamatoria de flores, hojas y frutos verdes de Caesalpinia pulcherrima para cuantificar su actividad antiinflamatoria en modelos murinos de inflamación aguda y subcrónica. Metodología: Este estudio cuantificó la actividad antiinflamatoria de diferentes extractos de tejidos aéreos de esta especie encontrada en Colombia por dos modelos de inflamación aguda, el edema auricular inducido por TPA (acetato de 12-O-tetradecanoil-forbol) y el edema plantar inducido por carragenina; así como el modelo de inflamación sub-crónico de granuloma inducido por pellet de algodón. Resultados: Los extractos de flores mostraron la mayor actividad antiinflamatoria en el modelo del TPA, en tanto que las hojas fueron más efectivas en disminuir el granuloma, en el modelo del pellet de algodón. No se observó ninguna actividad antiinflamatoria de ningún extracto en el modelo de carragenina. Los frutos verdes no mostraron actividad en ningún modelo. Conclusión: Los resultados demostraron la efectividad que el uso etnobotánico le atribuye a esta planta. Los extractos activos obtenidos mostraron el potencial uso de esta planta en la fabricación fitoterapéuticos efectivos. Salud UIS 2011; 43 (3): 281-287
Palabras Clave: Caesalpinia, agentes antiinflamatorios, ésteres del forbol, edema, carragenina, granuloma
Anti-inflammatory activity of flowers and leaves
of Caesalpinia pulcherrima L. (Swartz)
ABSTRACT
Introduction: Aerial parts of Caesalpinia pulcherrima L. (Swartz) have been used in traditional medicine in southern Cundinamarca Department for the treatment of inflammatory diseases. Objective: Evaluate the antiinflammatory activity of flowers, leaves and green fruits of the plant to quantify inflammatory activity of acute and subchronic murine inflammation models. Methodology: This study quantified the anti-inflammatory activity of different extracts of aerial tissues of this species for two models of acute inflammation, the ear edema induced by TPA (12-O-tetradecanoyl-phorbol-13-acetate) and plantar edema induced by carrageenan, as well as the sub-chronic inflammation model of granuloma induced by cotton pellet. Results: The flower extracts proved to have the largest anti-inflammatory activity in the TPA model, while the leaves were more effective in reducing the granuloma in the cotton pellet model. There was no anti-inflammatory activity of any extract carrageenan model. The green fruits showed no activity in any model. Conclusion: The results demonstrated the effectiveness of the ethnobotanical use attributed to this plant. The active extracts obtained showed the potential use of this plant in making safe and effective phytomedicines. Salud UIS 2011; 43 (3): 281-287
Keywords: Caesalpinia, antiinflammatory agents, phorbol esters, carrageenan, granuloma
INTRODUCCIÓN
Caesalpinia pulcherima L. (Swartz), es un arbusto originario de la América tropical, ampliamente distribuido en la región tropical de África y Asia, empleado tanto como planta ornamental como por sus propiedades terapéuticas en medicina tradicional1. En Colombia se le conoce como clavellina. Numerosos trabajos han reportado diversas actividades biológicas, entre ellas actividad antituberculosa en extractos de raíces2, actividad antiviral contra varios tipos de herpes y adenovirus3, moderada actividad antiespasmódica4, y antiinflamatoria y analgésica en extractos de éter de petróleo de hojas5-6. Actividad antioxidante mediada por sistemas enzimáticos y no enzimáticos fue reportada en flores de esta especie7. Estudios fitoquímicos han reportaron la presencia de ?-sitosterol, lupeol, ácido gálico, quercetina, rutina y sacarosa8-9, diterpenoides, cesaldecarina A, espatulenol, cariofileno y fitol10-17. También se han aislado varios metoxibenzoatos y flavonoides, algunos activos contra diversas bacterias y hongos18-20. Pulcherrinas con posible actividad antiinflamatoria han sido aisladas de las raíces21. Varios elagitaninos encontrados en la corteza podrían explicar las propiedades abortivas y emenagogas que se atribuyen a la especie22. Peltoginoides aislados del tallo demostraron actividad citotóxica20. Adultos mayores del municipio de Agua de Dios, sur del Departamento de Cundinamarca, usan tradicionalmente flores y hojas de esta especie en infusión alcohólica aplicadas tópicamente para el tratamiento sintomático del dolor y la inflamación producidos por la artritis reumatoidea. Esta actividad se confirmó empleando modelos biológicos in vivo agudos y subcrónicos de actividad antiinflamatoria, encontrando resultados que convierten a esta planta en muy promisoria para el desarrollo de fitopreparados eficientes y seguros en el tratamiento de la inflamación.
MATERIALES Y MÉTODOS
Material Vegetal
Aproximadamente 2000 gramos de flores, hojas y frutos inmaduros de C. pulcherrima fueron recolectados en el municipio de Agua de Dios. Un voucher del espécimen (COL-493856) fue depositado en el Herbario Nacional Colombiano. Cien gramos de cada material vegetal material seco y pulverizado de cada órgano fueron extraídos por maceración con etanol al 96% y luego concentrados hasta una consistencia pastosa; con el fin de confirmar la actividad antiinflamatoria empleando el modelo murino de edema auricular inducido por TPA. Una vez confirmada tal actividad, nuevo material (de la misma colecta) fue sometido a sucesivas extracciones por maceración exhaustiva usando cuatro solventes de polaridad incremental: Eter de petróleo (EP), cloroformo (CHCl3), metanol (MeOH) y agua (Liof), con el fin de separar los componentes por polaridad, y evaluar cada fracción separadamente. Los extractos orgánicos se concentraron mediante rotaevaporación a vacío, siempre a una temperatura inferior a 35°C hasta obtener un material pastoso. El extracto acuoso fue liofilizado. Cuatro fracciones fueron obtenidas de las flores (CPFEP, CPF-CHCl3, CPF-MeOH, CPF-liof) y cuatro de las hojas (CPH-EP, CPH-CHCl3, CPH-MeOH, CPH-liof). Durante la concentración de las fracciones CPF-EP y CPF-MeOH, se produjeron sendos precipitados (CPFPEP y CPH-PMeOH), los cuales fueron separados y evaluados.
Reactivos
12-O-tetradecanoil-forbol-13-acetato, indometacina, carragenina y polivinil-pirrolidona (PVP-K30) fueron obtenidos de Sigma Chemical Co. (St. Louis, MO, USA). Éter de petróleo, cloroformo y metanol fueron adquiridos de Mallinckrodt Baker, Inc. (Phillipsburg, NY, USA). Todos los solventes y reactivos eran de calidad analítica.
Animales de experimentación
Los experimentos se desarrollaron empleando ratones machos y hembras ICR (10-12 semanas; 25-35 g) y ratas Wistar machos (10-12 semanas; 200-250 g). Los animales fueron mantenidos permanentemente bajo condiciones controladas de temperatura y fotoperíodo (luz entre las 06:00 y las 18:00 horas). Agua y alimento estuvieron disponibles ad libitum. Durante la crianza y los ensayos, los animales fueron tratados de acuerdo con lineamientos descritos en la Ley 84 de 1989 y la Resolución Nº 8430 de 1993 sobre el manejo de animales de laboratorio.
Evaluación de la actividad antiinfl amatoria
Edema auricular inducido por TPA
Tres grupos de 6 ratones privados de alimento 12 horas antes del ensayo, se colocaron separadamente en cajas que correspondieron al Control (TPA), Referencia (indometacina) y Ensayo (extractos y fracciones). De acuerdo con el método descrito por Young et al 23 y Lapa et al24, todas las aplicaciones se hicieron tópicamente en las superfi cies interna y externa de la oreja derecha según el siguiente esquema: Para el grupo Control 2,5 μg de TPA disueltos en 20 μL de acetona; el grupo de Referencia se administró con 1,0 mg de indometacina disuelto en 20 μL de acetona, seguido de la misma dosis de TPA aplicada al grupo control. Los extractos y/o fracciones disueltos en 20 μL de acetona o una mezcla etanol-acetona fueron aplicados a diferentes dosis (según ensayo) entre 0.06 y 1.0 mg por oreja, seguido de la aplicación de la misma dosis de TPA descrita para el Control. Cuatro horas después del tratamiento, los animales fueron sacrifi cados por dislocación cervical. De cada uno se obtuvieron secciones circulares de cada oreja (tratada y no tratada) empleando un saca-bocados, las cuales fueron pesadas en balanza analítica (Sartorius BP 221S). El edema fue medido como la diferencia de peso entre la oreja tratada y la correspondiente no tratada. Los porcentajes de infl amación y de inhibición fueron calculados con las siguientes ecuaciones:
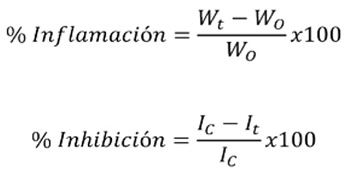
Donde Wt es el peso de la sección de la oreja tratada con el agente irritante, Wo el de la oreja no tratada, Ic equivale al porcentaje de infl amación media del grupo Control, e It el porcentaje de infl amación media de cada grupo tratado.
Edema plantar inducido por Carragenina
Tres Grupos de 6 ratas fueron puestas separadamente privadas de alimento y agua 12 horas antes del experimento25-26. Los animales fueron inyectados con carragenina en solución al 2% (100 μL) en la región sub-plantar de la pata trasera derecha. Los grupos de evaluación fueron administrados oral o intraperitonealmente con 50, 100 o 200 mg/Kg de los extractos 1 hora antes de la inyección de la carragenina. Debido a la baja solubilidad de los extractos, se prepararon co-precipitados de estos con PVP-K30 a fi n de facilitar su dispersión. El grupo Control recibió una dispersión acuosa de PVP-K30 (40 mg/Kg) y el grupo de Referencia fue tratado con indometacina (10 mg/ Kg co-precipitada con PVP-K30; proporción 1:4). El volumen de la pata infl amada fue medido a las 3 y 5 horas después de la administración de carragenina por el método de desplazamiento de volumen usando un pletismómetro electrónico Ugo Basile 7140, y luego calculando la diferencia de volumen entre la pata tratada y la no tratada. Para la administración oral, se empleó un catéter para depositar los extractos o la indometacina directamente al estómago. Los coprecipitados fueron elaborados dispersando los extractos y la PVP-K30 (proporción 1:4) en etanol, y luego secando por rotavaporación a 35°C hasta obtener un material seco. Los co-precipitados fueron dispersados en cantidades medidas de agua justo antes de la administración, para suministrar a los animales la cantidad de extracto del respectivo ensayo en 1 mL de dispersión por kilogramo de peso.
Granuloma inducido por pellet de algodón Tres grupos de 6 ratas ordenadas por peso fueron colocadas separadamente en cajas y en ayuno durante la noche anterior al ensayo(27)24. Los grupos de evaluación fueron tratados con administración oral de 50, 100 o 200 mg/Kg de extractos (coprecipitados) 1 hora antes de la implantación del pellet. Los animales fueron anestesiados por inyección intraperitoneal de una mezcla ketamina (100 mg/Kg) y diazepam (5 mg/Kg)(28)25. Bajo condiciones de asepsia, 1 pellet de algodón estéril de 10 mg de peso fue introducido subcutáneamente hasta el nivel escapular a través de una incisión de 1 cm aproximadamente realizado en la espalda baja del animal. El grupo de referencia fue tratado con indometacina (5 mg/Kg coprecipitada con PVP-K30; proporción 1:4) y el grupo control con una dispersión de PVP-K30. Durante los siguientes 6 días posteriores al implante, se administraron las mismas dosis diarias de coprecipitados de extractos, de indometacina, y dispersión de PVP-K30 a los respectivos grupos. Se dejaron desarrollar los granulomas por espacio de 7 días. En el día 8, los animales fueron sacrificados con un exceso de anestesia (ketamina-barbital). Los granulomas fueron removidos, despojados de tejido suelto, secados por 48 horas a 40°C y pesados en balanza analítica. La diferencia entre el peso del granuloma y el peso original del pellet (10 mg) se consideró como la cantidad de tejido granulomatoso formado.
Análisis de Datos
Los datos se presentan como la media ± ESM (error estándar de la media) del edema producido en cada grupo experimental. El análisis de realizó empleando ANOVA de una vía seguida de la prueba de diferencia significativa de Dunnet. La diferencia significativa se establece en función de la probabilidad (*p<0.05 y **p<0.01)(29)26.
RESULTADOS
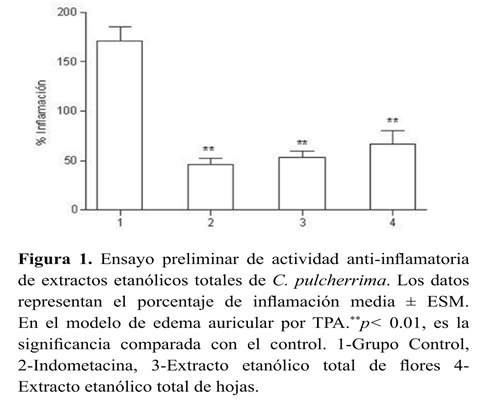
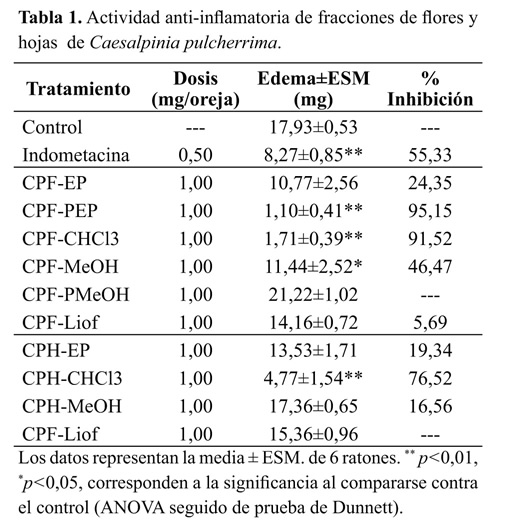
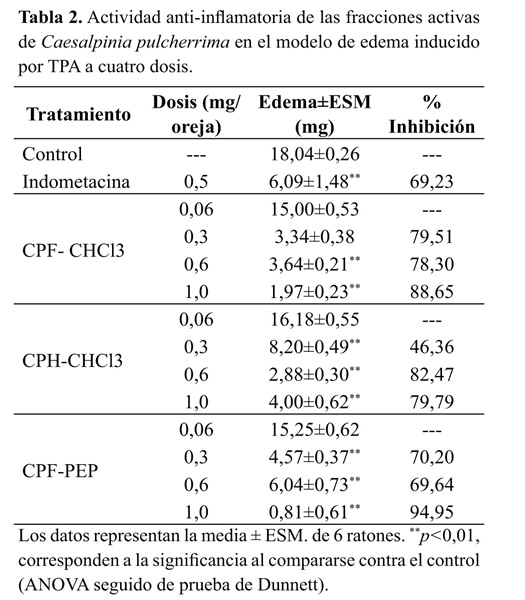
Edema auricular El efecto de los extractos etanólicos totales de C. pulcherrima sobre el edema inducido por TPA, se presenta en la Figura 1. Los extractos de flores y hojas muestran una reducción significativa en el edema producido por el agente irritante en el grupo control, lo que constituye la evidencia preliminar de su actividad anti-inflamatoria. De forma opuesta, el extracto etanólico de frutos inmaduros fue inactivo en este modelo (datos no presentados), razón por la cual este órgano se excluyó de las siguientes etapas del estudio. En la Tabla 1 se presentan los resultados obtenidos por todas las fracciones, donde se destacan los resultados las fracciones CPF-PEP, CPF-CHCL3 y CPH-CHCL3 que alcanzaron niveles de inhibición de la inflamación del 95.15, 91.52 y 76.52% respectivamente. Con base en estos resultados, se diseñó una nueva prueba para evaluar específicamente estas fracciones a diferentes concentraciones (0.06, 0.30, 0.60 y 1.00 mg/oreja), con el fin de establecer el efecto de la dosis sobre la actividad antiinflamatoria. Los resultados se presentan en la Tabla 2. Sobresale la elevada actividad anti-inflamatoria de las fracciones CPF- CHCl3 y CPF-PEP, que a dosis tan bajas como 0.3 mg/oreja, alcanzan protecciones del 79.51 y 70.20% respectivamente, mayores al 69.23% de inhibición alcanzado por la indometacina a la dosis de 0.5 mg/oreja.
Edema plantar
Dado que las fracciones con mayor actividad en el modelo del TPA fueron CPF-CHCl3 y CPH-CHCl3, estas fueron las elegidas para ser evaluadas en el modelo plantar. No obstante los resultados muy promisorios del modelo con TPA, tales fracciones no presentaron ningún nivel de protección en el modelo de edema plantar
Granuloma por pellet de algodón
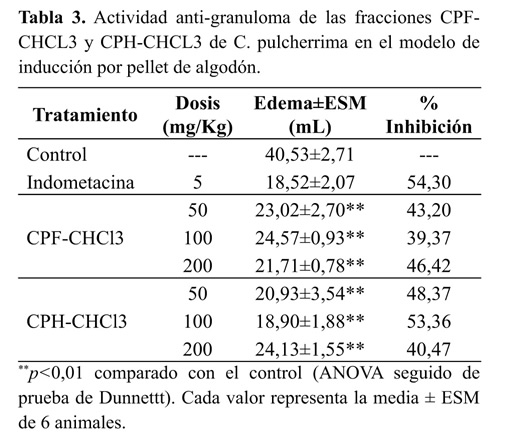
En la Tabla 3 se muestra que todas las fracciones evaluadas inhiben significativamente la formación de granuloma inducido por el pellet implantado. La fracción CPF-PEP no fue evaluada debido a la alta cantidad requerida para desarrollar la prueba. A pesar de las altas dosis de extractos administradas (hasta 200 mg/Kg), durante el desarrollo del ensayo, no se presentaron señales de toxicidad (desorientación, pérdida del equilibrio, diarrea, etc.) en ninguno de los grupos que recibieron los extractos CPF-CHCL3 y CPH-CHCL3. Tampoco se observó toxicidad en el grupo de referencia.
DISCUSIÓN
Caesalpinia pulcherrima es una planta conocida por su actividad antiinflamatoria en la medicina popular, empleada en muchas regiones tropicales alrededor del mundo. Este hecho ha motivado el interés de numerosos investigadores en la búsqueda de los compuestos activos responsables de tal actividad. Rao7 encontró flavonoides inhibidores de la producción de óxido nítrico (NO) y de las citoquinas (TNF)-α y (factor de necrosis tumoral) e interleuquina (IL)-12, ambos mediadores de la inflamación.
De los tres modelos empleados, el edema inducido por TPA mostró la más clara evidencia de la efectividad de C. pulcherrima contra la inflamación. Este modelo parece involucrar o depender de la liberación y metabolismo del ácido araquidónico, así como la interacción de dicho agente flogístico con la proteinquinasa C30, por lo tanto, el efecto inhibitorio de las fracciones evaluadas sugiere la presencia de compuestos activos que bloquean alguna de estas rutas inflamatorias, inhibiendo tales mediadores. Además, la concentración de las fracciones empleadas en este modelo, están muy cercanas a las concentraciones empleadas por compuestos de síntesis usados por vía tópica, como piroxicam y diclofenaco, las cuales corresponden a 0.5% y 1% respectivamente. La concentración de 0.6 mg/oreja de CPH-CHCl3 en 20 μL de solvente, equivale a una solución al 1,6%, que produce una inhibición de la inflamación del 80% en el modelo de TPA, lo que resulta sorprendente para una fracción tan preliminar. Por otra parte, el proceso inflamatorio producido por carragenina inicia con la inducción y liberación de histamina, serotonina y quininas de fase temprana31, así como prostaglandinas, proteasas y lisosomas en fases tardías32. Debido a que la falta de actividad probó no ser una consecuencia de una baja absorción intestinal, los resultados pueden explicarse por la incapacidad de las fracciones de inhibir la liberación o neutralizar ninguna de las dos fases involucradas. El granuloma es una respuesta típica de los procesos inflamatorios crónicos, en los que la reacción aguda no es capaz de eliminar el agente flogístico. Durante la formación del granuloma, ocurre un incremento en el número de fibroblastos y síntesis de colágeno y mucopolisacáridos para aislar dentro del tejido afectado un cuerpo extraño33-34. Las fracciones clorofórmicas de ambos órganos mostraron una significativa actividad antiinflamatoria frente al pellet de algodón que actuó como cuerpo extraño invasor. Esto refleja su eficacia en inhibir la fase proliferativa de la inflamación y refuerza la hipótesis de su acción antiinflamatoria a través de diferentes mecanismos. Kumar et al en 20036 reportaron actividad antiinflamatoria en el extracto etéreo de las hojas de esta especie, en el presente trabajo también se encontró, pero de forma más marcada en flores, y particularmente en un precipitado de su extracto etéreo.
CONCLUSIONES
Los modelos murinos de inflamación empleados en este estudio constituyen un sistema útil de tamizaje y evaluación de potenciales agentes anti-inflamatorios, que proporcionan una información preliminar acerca de los probables mecanismos de acción involucrados. De hecho, fracciones activas de composición compleja, pueden tener elementos de actividad aditiva, sinérgica e incluso antagónica. Este estudio proporciona un soporte científico para el potencial uso de esta planta en el diseño de fitomedicamentos efectivos, seguros y de bajo costo. Estudios complementarios que involucren el aislamiento de nuevos compuestos y diversas pruebas de modelos in vivo e in vitro ayudarán a elucidar el mecanismo de acción y mejorar el uso de esta especie en la medicina popular.
AGRADECIMIENTOS
Los autores agradecen al Departamento de Farmacia de la Facultad de Ciencias de la Universidad Nacional de Colombia y al Grupo de Investigación Principios Bioactivos en Plantas Medicinales por su apoyo en la realización del presente trabajo.
CONFLICTO DE INTERÉS
Los autores declaran que no existe conflicto de intereses en el trabajo realizado.
REFERENCIAS
1. López A, Sánchez JM. Árboles en España. Manual de identificación. Madrid: Mundi-Prensa, 2001: p. 2001. [ Links ]
2. Promsawan N, Kittakoop P, Boonphong S, Nongkunsarn P. Antitubercular cassane furanoditerpenoids from the roots of Caesalpinia pulcherrima. Planta Med. 2003 Aug;69(8):776-7. [ Links ]
3. Chiang LC, Chiang W, Liu MC, Lin CC. In vitro antiviral activities of Caesalpinia pulcherrima and its related flavonoids. J Antimicrob Chemother 2003 Aug;52(2): 194-198. [ Links ]
4. Rodriguez V, Salazar L, Estrada S. Spasmolytic activity of several extracts obtained from some Mexican medicinal plants. Fitoterapia 2003 Dec; 74(7-8): 725-728. [ Links ]
5. Ali MS, Azhar I, Amtul Z, Ahmad VU, Usmanghani K. Antimicrobial screening of some Caesalpiniaceae. Fitoterapia. [Short report]. 1999; 70(3): 299–304. [ Links ]
6. Kumar A, Nirmala V. Investigations of Pet Ether Extract of Caesalpinia Pulcherrima (L.) Swartz leaves extract on analgesic, anti-inflammatory, and antipyretic properties. Nat Product Sci 2003; 9(4): 256-259. [ Links ]
7. Rao YK, Fang SH, Tzeng YM. Anti-inflammatory activities of flavonoids isolated from Caesalpinia pulcherrima. J Ethnopharmacol 2005; 100(3): 249- 253. [ Links ]
8. Padma PR, Sumathi S, Aparna S. Antioxidant status of the flowers of Caesalpinia pulcherrima J Med Arom Pl Sci 2001; 23: 78-83. [ Links ]
9. Rao K, Ravi P. Chemical examination of the flowers of Caesalpinia pulcherrima Sw. Indian J Pharm Sci 1978;40(2): 103-104. [ Links ]
10. Varshney IP, Pal R. Chemical studies of the flowers of Cassia siamea Lamk., Peltophorum ferrugineum Benth and Caesalpinia pulcherrima Sw. Indian J Pharm. 1978; 40(1): 15-16. [ Links ]
11. Che CT, McPherson DD, Cordell GA, Fong HH. Pulcherralpin, a new diterpene ester from Caesalpinia pulcherrima. J Nat Prod 1986 Jul-Aug; 49(4): 561-569. [ Links ]
12. McPherson D, Che C, Cordell GA, Soejarto D, Pezzuto JM, Fong H. Diterpenoids from Caesalpinia pulcherrima. Phytochemistry. 1985;25(1): 167-70. [ Links ]
13. Roach JS, McLean S, Reynolds WF, Tinto WF. Cassane diterpenoids of Caesalpinia pulcherrima. J Nat Prod 2003 Oct; 66(10): 1378-1381. [ Links ]
14. Ragasa CY, Hofilena JG, Rideout JA. New furanoid diterpenes from Caesalpinia pulcherrima. J Nat Prod 2002 Aug; 65(8): 1107-1110. [ Links ]
15. Ragasa CY, Ganzon J, Hofilena J, Tamboong B, Rideout JA. A new furanoid diterpene from Caesalpinia pulcherrima. Chem Pharm Bull (Tokyo). 2003 Oct; 51(10): 1208-1210. [ Links ]
16. Pranithanchai W, Karalai C, Ponglimanont C, Subhadhirasakul S, Chantrapromma K. Cassane diterpenoids from the stem of Caesalpinia pulcherrima. Phytochemistry 2009; 70(2): 300-304. [ Links ]
17. Das B, Srinivas Y, Sudhakar C, Mahender I, Laxminarayana K, Reddy PR, et al. New diterpenoids from Caesalpinia species and their cytotoxic activity. BBioorg. Med. Chem. Lett 2010; 20(9): 2847-2850. [ Links ]
18. Patil AD, Freyer AJ, Webb L, Zuber G, Reichwein R, Bean MF, et al. Pulcherrimins A – D, novel diterpene dibenzoates from Caesalpinia pulcherrima with selective activity against DNA repair-deficient yeast mutants. Tetrahedron 1997; 53(5): 1583-1592. [ Links ]
19. Srinivas KV, Koteswara Rao Y, Mahender I, Das B, Rama Krishna KV, Hara Kishore K, et al. Flavanoids from Caesalpinia pulcherrima. Phytochemistry 2003 Aug; 63(7): 789-193. [ Links ]
20. McPherson D, Cordell G, Soejarto D, Pezzuto JM, Fong H. Peltogynoids und homoisoflavonoids from Caesalpinia pulcherrima. Phytochemistry 1983; 22(12): 2835-2838. [ Links ]
21. Yodsaoue O, Karalai C, Ponglimanont C, Tewtrakul S, Chantrapromma S. Pulcherrins DR, potential anti-inflammatory diterpenoids from the roots of Caesalpinia pulcherrima. Tetrahedron 2011; 67(36): 6838-6846. [ Links ]
22. Awasthi KK, Kumar A, Misra K. Two ellagitannins from the stem bark of Caesalpinia pulcherrima Phytochemistry 1980; 19(9): 1995-1997. [ Links ]
23. Young JM, Wagner BM, Spires DA. Tachyphylaxis in 12-0-tetradecanoylphorbol acetate- and arachidonic acid-induced ear edema. J Invest Dermatol 1983; 80(1): 48-52. [ Links ]
24. Lapa J, Monteiro DT. Métodos farmacológicos para la validación de plantas medicinales. CYTED, 2001: p 61. [ Links ]
25. Winter CA, Risley EA, Nuss GW. Carrageenininduced edema in hind paw of the rat as an assay for antiinflammatory drugs. Proc Soc Exp Biol Med 1962; 111: 544-547. [ Links ]
26. Sugishita E, Amagaya S, Ogihara Y. Antiinflammatory testing methods: comparative evaluation of mice and rats. J Pharmacobiodyn 1981 Aug; 4(8): 565-575. [ Links ]
27. Swingle KF, Shideman FE. Phases of the inflammatory response to subcutaneous implantation of a cotton pellet and their modification by certain anti-inflammatory agents. J Pharm. and Exp. Thera. 1972; 183(1): 226-234. [ Links ]
28. Flecknell P. Laboratory Animal Anaesthesia. Londres: Academic Press, 1996: p 245. [ Links ]
29. Kuehl R. Diseño de Experimentos. 2 edición. México D.F.: Thompson Learning, 2001: p 73-120. [ Links ]
30. Fernández M, de las Heras B, García MD, Sáenz MT, Villar A. New insights into the mechanism of action of the anti-inflammatory triterpene lupeol. J Pharm Pharmacol. 2001;53(11):1533-1539. [ Links ]
31. Crunkhorn P, Meacock SCR. Mediators of the inflammation induced in the rat paw by carrageenin. Br J Pharmacol 1971 42(3): 392-402. [ Links ]
32. Vinegar R, Schreiber W, Hugo R. Biphasic development of carrageenin edema in rats. J Pharm. and Exp. Thera. 1969; 166(1): 96-103. [ Links ]
33. Olajide OA, Awe SO, Makinde JM, Ekhelar AI, Olusola A, Morebise O, et al. Studies on the antiinflammatory, antipyretic and analgesic properties of Alstonia boonei stem bark. J Ethnopharmacol 2000 Jul; 71(1-2): 179-186. [ Links ]
34. Arul V, Miyazaki S, Dhananjayan R. Studies on the anti-inflammatory, antipyretic and analgesic properties of the leaves of Aegle marmelos Corr. J Ethnopharmacol 2005 Jan 4; 96(1-2): 159-163. [ Links ]