Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807
Rev. Univ. Ind. Santander. Salud vol.45 no.3 Bucaramanga Sep./Dec. 2013
Generalidades de Queratitis Micótica
Manuel Fernando Buitrago Torrado1, Juan Enrique Vives Restrepo2,
Alex Samir Fernández Santodomingo3, Francys Samara Manrique Bolívar3, Diego Carrillo Tete3
Forma de citar: Buitrago Torrado MF, Vives Restrepo JR, Fernández Santodomingo AS, Manrique Bolivar FS, Carrillo Tete D. Generalidades de Queratitis Micótica. rev.univ.ind.santander.salud 2013; 45 (3): 55-69
1. MD Oftalmólogo Oncólogo, Departamento de Oftalmología, Escuela de Medicina, Facultad de Salud, Universidad Industrial de Santander, Bucaramanga, Colombia
2. MD Oftalmólogo, Área de Oftalmología, Programa Medicina, Facultad de Salud, Universidad del Magdalena, Santa Marta, Colombia.
3. Médico Interno, Hospital Universitario de Santander, Escuela de Medicina, Facultad de Salud, Universidad Industrial de Santander, Bucaramanga, Colombia
Correspondencia: Alex Samir Fernández S. Calle 32 N°32-70, Bucaramanga, Santander, Colombia, celular: 3013834737, E-mail: guitarsami15@hotmail.com
Recibido: Abril 04 de 2013 Aprobado: Noviembre 02 de 2013
RESUMEN
La queratitis micótica es una importante causa de discapacidad visual en los países desarrollados. En los últimos años ha aumentado su incidencia en países de regiones tropicales, relacionado con el aumento de las conductas de riesgo como el uso indiscriminado de antifúngicos y corticoides oftálmicos en la práctica médica. La confirmación del diagnóstico es necesaria, no sólo en caso de queratitis micótica, sino también en otras enfermedades oculares infecciosas para así iniciar la terapia oportuna y exacta, y evitar el uso innecesario de antimicrobianos. El pronóstico visual de los pacientes dependerá del diagnóstico temprano y el tratamiento médico oportuno.
Palabras Clave: Queratitis micótica, queratomicosis, úlcera corneal, hongo, córnea, antimicótico
Overview of Mycotic Queratitis
ABSTRACT
Fungal keratitis is a major cause of visual disability in developed countries. In recent years its incidence has increased in tropical countries, related with risk behaviors such as indiscriminate use of antifungal and corticosteroid ophthalmic in clinical practice. Diagnostic confirmation is needed, not only in cases of fungal keratitis, but also for other infectious eye diseases, to initiate timely and accurate therapy, and avoid the unnecessary use of antimicrobials. The visual prognosis of patients depends on rapid diagnosis and prompt medical treatment.
Keywords: Mycotic keratitis, keratomycosis, corneal ulcer, fungus, cornea, antimycotic
INTRODUCCIÓN
La queratitis micótica fue una rareza clínica por más de medio siglo y actualmente se ha convertido en una patología distintiva. Leber describió el primer caso de queratitis micótica en 1879 en un paciente que tenía una úlcera corneal causada por Aspergillus spp.
A nivel del aparato ocular, las micosis pueden afectar diferentes partes del ojo y tejidos perioculares. Las que se afectan con mayor frecuencia son la córnea, el humor vítreo y la retina. El término queratitis se indica para cualquier proceso inflamatorio corneal 1, independiente de su origen o su estado de gravedad. La queratitis de causa infecciosa es una causa de morbilidad ocular mundial importante, genera alto riesgo de secuelas oculares como pérdida de la visión y compromiso de la integridad del ojo 2-4. La queratitis micótica es la infección de tipo ulcerativa de la córnea causada por hongos, de inicio clínico insidioso que va desde el contacto con el hongo hasta los días o semanas que puedan transcurrir al inicio de los síntomas 5, 6. Debe incluir necesariamente una úlcera, puesto que los hongos no pueden penetrar un epitelio corneal íntegro; proliferan o penetran en la córnea a través de una abrasión o defecto epitelial persistente. Es infrecuente en países desarrollados y en zonas de clima templado; pero en áreas rurales de regiones de clima tropical y países en vías de desarrollo representan mayor incidencia en las urgencias oftalmológicas, donde son más comunes en personas jóvenes que trabajan en un ambiente rural 7, 8. Sin embargo, se ha observado un aumento de frecuencia de esta condición en la población urbana desde la introducción de los corticosteroides oftálmicos, por lo que ya no es exclusivo de los casos donde se producía inoculación abundante del microorganismo al estroma corneal 9-11. El manejo de la queratitis micótica resulta difícil por algunas razones como dificultades en la identificación del hongo, confusión con otros tipos de queratitis, respuesta lenta o poco satisfactoria al manejo médico disponible en el mercado actual, difícil disponibilidad de los fármacos de primera elección en presentación oftálmica, severidad de las secuelas e incapacidad que producen.
EPIDEMIOLOGÍA
La queratitis fúngica es una causa frecuente de enfermedad corneal en regiones tropicales del mundo12. Se establece que tiene una prevalencia del 6%, observándose un incremento en los últimos 30 años; a nivel mundial representa entre el 4% y el 60% de las úlceras corneales infecciosas 13, 14. Esta amplia distribución resulta de diversos factores como condiciones socioeconómicas, características ambientales, y variaciones geográficas en la latitud y diferencias climáticas 15. El uso de lentes de contacto es la causa más frecuente en países desarrollados, los que están en vía de desarrollo la principal causa es el contacto directo por trauma vegetal y a nivel global es el creciente uso de los corticoides tópicos oculares 11, 16. Es más frecuente en hombres que en mujeres, se han reportado diferentes proporciones para ambos sexos en India (1.6:1), China (1.5:1) y Brasil (6.4:1) 17. En los Estados Unidos su incidencia es mucho menor que en India y China. Por un lado, en zonas húmedas hacia el sur de EEUU un 35% de las queratitis infecciosas son causadas por hongos, mientras que en zonas templadas va desde el 1% al 8%7. Un estudio realizado en India concluye que el 90% de las úlceras micóticas fueron por trauma ocular, de las cuales el 60% corresponden a lesiones de origen vegetal. Más de la cuarta parte de estos pacientes se dedicaban a tareas agrícolas 13.
En relación a otras características demográficas del huésped, se presenta más comúnmente en jóvenes y adultos medios, asociados al trabajo en el campo y agricultura; también en épocas del año donde predomina el clima húmedo 17, 18.
Finalmente, se destaca que en los últimos veinte años ha habido un creciente uso en los lentes de contacto que se relaciona con el aumento de los reportes de queratitis micótica por esta causa 19.
ETIOLOGÍA
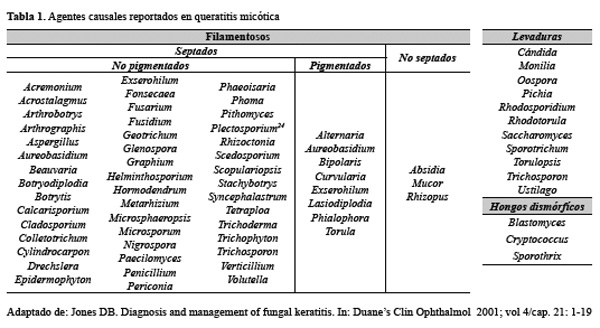
Se han descrito diversos tipos de hongos asociados causalmente con la queratitis micótica (Tabla 1). Los hongos médicamente importantes se clasifican en tres tipos principales basados en sus propiedades macroscópicas:
a. Los hongos filamentosos o mohos, que producen cultivos de tipo algodonoso o plumoso. Se clasifican en septados y no septados. Los más importantes en la producción de úlceras fúngicas son Aspergillus y Fusarium. El A. Fumigatus es la especie de Aspergillus frecuentemente aislada en las queratitis fúngicas; otras especies importantes son A. flavus y A. niger. Los hongos Aspergillus se encuentran en el ambiente, en el suelo y en restos vegetales. Son contaminante habitual en los sistemas de ventilación de los hospitales y la inhalación de sus esporas puede producir una infección pulmonar en pacientes susceptibles.
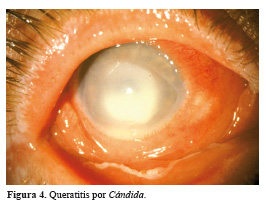
b. Las levaduras, de crecimiento pastoso u opaco cremoso sobre la superficie del cultivo. La levadura mayormente asociada a queratitis es la Cándida. La especie predominante es C. albicans y con menor frecuencia C. parapsilopsis. Las Cándidas se encuentran uniformemente distribuidas en el ambiente; en el hombre se aíslan en piel, tracto gastrointestinal, esputo, área genitourinaria, etc 10.
c. Los hongos dismórficos, que exhiben propiedades de levaduras cuando se cultivan entre 25°C a 30°C. En este grupo se encuentra el Histoplasma que rara vez afecta la córnea.
En general, Fusarium y Aspergillus son los agentes etiológicos más comunes aislados de pacientes con queratitis micótica en los trópicos, mientras que es la Cándida albicans en el caso de regiones templadas 13,20- 22. La mayoría de los informes de úlcera corneal disponible en la literatura son del subcontinente asiático y africano. Casi todos los informes de la India, Nepal, Sri Lanka y Bangladesh indican a Aspergillus como el agente causal más frecuente de queratomicosis seguidos por especies de Fusarium y Cándida. En los países europeos, la queratitis micótica no es común, ya que sólo el 3% del total de los pacientes con úlcera corneal se documenta que son debido a los hongos, y las especies de Cándida son las aisladas generalmente. En los Estados Unidos Fusarium spp. es el patógeno más prevalente, seguido por las especies de Cándida. En los países latinoamericanos, en especial Colombia y Paraguay; Fusarium es el agente más frecuente seguido de Aspergillus 23.
FACTORES DE RIESGO
Como se ha mencionado anteriormente, la queratitis micótica se ha reportado en diferentes partes del mundo, especialmente en áreas tropicales. Se deben considerar los diversos factores ambientales como la lluvia, humedad y viento; puesto que en los climas tropicales húmedos predominan los hongos filamentosos, mientras que en los climas templados las levaduras 25, 26.
El traumatismo ocular con material de origen vegetal o animal inclusive con tierra, es el factor más importante vinculado con el origen de la queratitis por hongos filamentosos. Este factor de riesgo incluye mayormente a la población masculina joven previamente sana, relacionados a los trabajos agrícolas o al aire libre.
Los factores predisponentes menos frecuentes incluyen el uso o abuso previo de corticosteroides tópicos o el uso continuado de antibacterianos tópicos, conjuntivitis alérgica, cirugías oculares y al uso de lentes de contacto 27. Las levaduras por ser oportunistas comprometen las corneas debilitadas por algún factor de riesgo local (ej. secreción insuficiente de lágrimas, cierre defectuoso de parpados) o sistémico (diabetes mellitus, inmunosupresión) 25, 26.
En el estudio realizado por Regina L. Sun y colaboradores en 2007, se evaluaron los factores predisponentes para el origen de la queratitis por cándida, se identificaron 29 casos con promedio de edad de 50 años. Dentro de los resultados se evidenció como condiciones predisponentes los trastornos de la superficie ocular que preceden a la infección, que incluye: queratopatía medicamentosa por corticoide o por radiación, síndrome de Sjögren, degeneración nodular de Salzmann, penfigoide, queratoplastia, y secundario a la queratotomía radial. Se encontraron también pacientes con infección por el virus de inmunodeficiencia humana y pacientes diabéticos dentro de las alteraciones sistémicas mayormente vinculadas con la queratocandidiasis.
FISIOPATOLOGÍA
Para empezar a entender la patología corneal, es necesario recordar de forma breve la anatomía de la córnea:
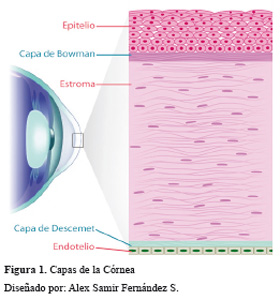
Histológicamente se comprende de 5 capas (Figura 1). La primera es el epitelio, el cual es de tipo escamoso estratificado no queratinizado, consta de 4 a 7 capas de células, que se van aplanando a medida que se hacen más superficiales. Por debajo de ésta se encuentra la membrana de Bowman o lámina anterior, que es una capa acelular constituida por fibras de colágeno localizadas de forma aleatoria; aquí se encuentran las terminaciones nerviosas que dan al epitelio. No se regenera si es dañada. Continúa la capa más gruesa, el estroma. Representa un 90% del espesor total corneal y está formada por fibras de colágeno organizadas paralelamente, lo que otorga la característica de transparencia a la córnea. Por debajo del estroma se encuentra la membrana de Descemet, también conocida como lámina posterior; está formada por varios tipos de colágeno y organizada de forma hexagonal lo que le otorga gran resistencia. Finalmente, el endotelio es la capa más profunda, constituida por una monocapa de células hexagonales incapaces de regenerarse, su función de bombeo mantiene un adecuado estado de hidratación de las capas suprayacentes, también es importante para el mantenimiento de la transparencia de la córnea 9.
El proceso por el que la córnea presenta una reacción inflamatoria está definido por su avascularidad; esto hace que los fenómenos inflamatorios se deriven del limbo esclerocorneal y finalmente termine en la neovascularización corneal. Otra característica principal de la córnea es su transparencia, que se pierde durante las queratitis dado que se altera su adecuada estructura y su balance hidroelectrolítico 27. Por otra parte, los hongos no pueden penetrar en el epitelio corneal intacto y tampoco entran en la córnea desde los vasos epiesclerales límbicos. Necesitan una lesión penetrante o un defecto epitelial previo para entrar en la córnea. Una vez dentro, son capaces de proliferar. La virulencia intrínseca de estos hongos depende no sólo de las sustancias producidas, sino también de la respuesta que genera el huésped 28.
Se plantean dos presentaciones de queratomicosis bien diferenciadas. La primera de ellas es la infección que se da en pacientes sanos quienes presentaron contacto traumático con materias vegetales, en su mayoría relacionada con hongos filamentosos. En este caso los hongos obtienen acceso al estroma corneal a través de un defecto en el epitelio, se multiplican y provocan necrosis de los tejidos y una reacción inflamatoria. La segunda presentación ocurre en individuos con córneas debilitadas, relacionadas por lo general con levaduras 27,28. Los hongos filamentosos proliferan dentro del estroma de la córnea sin la liberación de sustancias quimiotácticas, lo que retrasa la respuesta inmune/inflamatoria en el huésped. En contraste, la Cándida albicans produce fosfolipasa y lisofosfolipasa en la superficie de las blastosporas, facilitando la entrada al tejido. Fusarium solani, que es un hongo virulento capaz (como lo son otros hongos filamentosos), de difundirse dentro del estroma corneal y penetrar en la membrana de Descemet y obtener acceso a la cámara anterior o el segmento posterior.
En relación a los lentes de contacto, el trauma que se asocia con ellos es minúsculo, aunque suficiente como factor de riesgo. La Cándida es la principal en los lentes de contacto terapéuticos y los hongos filamentosos se asocian más con el desgaste de las lentillas.
CLÍNICA
Los síntomas suelen ser inespecíficos, aunque su aparición es más tardía (5-10 días) que en las úlceras corneales bacterianas 25, 29. Teniendo en cuenta los factores de riesgo mencionados es necesario identificar la presencia de enfermedad ocular previa o sistémica relacionada, para lograr un manejo integral.
En general, los principales motivos de consulta en los pacientes con queratitis son el dolor y la disminución de la agudeza visual. Otros síntomas habituales son la hiperemia ciliar en grado variable, blefarospasmo, fotofobia y lagrimeo 27.
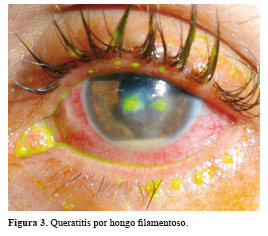
La queratitis por hongos filamentosos puede afectar cualquier parte de la córnea. Se observa como un infiltrado blanco grisáceo por debajo de un epitelio intacto y rugoso, de bordes irregulares muy finos que le dan un aspecto algodonoso, además se acompaña de otras lesiones como bordes hifados que son aquellas líneas que se extienden más allá del borde de la úlcera sobre la córnea normal; lesiones satélites de características similares por su color blanco grisáceo; infiltrados corneales rodeados por un anillo opaco con una zona clara entre los dos conocido como 'anillo inmune'; pliegues de Descemet e iritis leve.
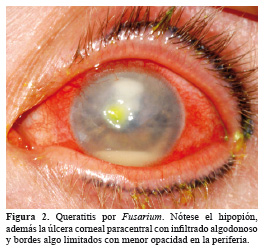
La formación de la placa endotelial y el hipopión ocurre después de la primera semana (Figura 2,3). Cada caso de queratitis micótica, si bien exhibe las características básicas mencionadas, pueden diferir dependiendo del agente etiológico asociado 25. La queratitis causada por Fusarium solani puede destruir completamente el ojo en un par de semanas, ya que la infección suele ser severa con perforación profunda y extensa, incluso puede concurrir un glaucoma maligno. Con las especies de Aspergillus se cree que causan una forma menos severa y no tan rápidamente progresiva de queratitis, que es más susceptible a la terapia antimicótica que la queratitis por Fusarium, sin embargo resultados de otros estudios reportan que la queratitis por Aspergillus conlleva a mayor frecuencia de queratoplastia que la queratitis por Fusarium. La queratitis por especies de Curvularia generalmente se presenta como una infiltración algodonosa superficial, con una progresión lenta y secreción sólo focal.
El cuadro clínico producido por levaduras es diferente y se presenta como una pequeña ulcera oval de bordes bien definidos, rodeada de un anillo amplio y denso con edema e infiltración corneal 26.
DIAGNÓSTICO
El manejo de la queratomicosis depende de la identificación temprana del agente causal. La experiencia del médico es fundamental a la hora de distinguir entre otros tipos de queratitis no infecciosas y de queratitis microbianas, de estas últimas descartar o confirmar que sea por hongos, y posteriormente determinar si es un hongo filamentoso o una levadura. El diagnóstico puede retrasarse por dos razones principales, una es el lento crecimiento del suficiente número de hongos en los medios de cultivo rutinarios y la segunda, por la escasa disponibilidad de material infectado tomado de la córnea, por lo que no siempre es posible la intervención específica temprana, lo que representa mayores secuelas para el paciente.
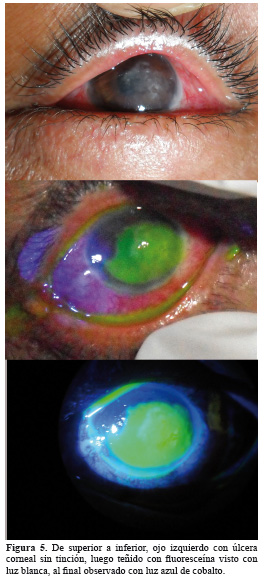
En general, el diagnóstico inicial de la úlcera corneal micótica se basa en la tinción de Gram y Giemsa, que tiñen la pared micótica y el citoplasma respectivamente. La solución KOH (hidróxido de potasio al 10%), también es utilizada en primera línea para visualizar elementos de hongos ya que el KOH digiere parcialmente los componentes proteicos fúngicos. Algunas tinciones tópicas corneales pueden ser usadas para una rápida identificación y delimitación del defecto corneal, como la fluoresceína, y ser observadas de mejor manera en el biomicroscopio con luz de cobalto (Figura 5).
Los recientes avances en las técnicas de biología molecular han abierto la puerta a métodos de confirmación diagnóstica independientes del cultivo. Entre las herramientas más utilizadas están la detección inmunológica, la identificación mediante el uso de metabolitos distintivos y sondas de ácidos nucleicos. Hasta la fecha, algunos casos de queratitis micótica han sido diagnosticados con éxito mediante la reacción en cadena de polimerasa (PCR).
Diagnóstico de Laboratorio
Frotis corneal o Examen directo
El diagnóstico de laboratorio de la queratitis micótica depende del examen de frotis directo del material obtenido del raspado corneal profundo, biopsia corneal, y paracentesis de la cámara anterior. El examen directo de muestras clínicas bajo el microscopio es el primer paso en el diagnóstico de laboratorio. Los reactivos más utilizados son KOH, Giemsa, tinción de Gram, azul de lactofenol, blanco calcoflúor, naranja de acridina, hematoxilina y eosina, entre otros 30, 31; con sensibilidades del 50% al 80%. Permiten indicar presencia de hongos, aunque no identifican su especie.
Cultivo
Los medios más utilizados para el aislamiento de hongos causales incluyen agar sangre, agar chocolate, medio sabouraud sin cicloheximida y caldo de tioglicolato. La mayoría de los hongos pueden ser aislados en 2 a 3 días de incubación, como Cándida, Fusarium y Aspergillus, pero al menos 25% de ellos requieren un período de incubación de hasta 3 semanas. El aislamiento mediante cultivo resulta en muchos casos difícil, debido a la poca disponibilidad de material clínico, es decir, raspado corneal 23. Un paciente que cursa con una posible queratomicosis no da espera a estos tiempos para el inicio de terapia específica, el resultado visual final de estos casos depende de la magnitud del daño tisular presente antes de la iniciación de la terapia, por lo que es conveniente un enfoque alternativo para mejorar el pronóstico global.
Examen histopatológico
El examen histopatológico de tejido se lleva a cabo después de la biopsia, que se basa en tinciones diferenciales como el ácido peryódico de Schiff. La identificación precisa de los elementos fúngicos en secciones de tejido utilizando tinciones convencionales para hongos requiere un conocimiento considerable de su morfología, siendo así difícil para los histopatólogos que no estén familiarizados 23. Otra dificultad de esta técnica son las diferencias sutiles que se puedan presentar entre diferentes especies fúngicas, que puede resultar en una mala clasificación del hongo. Es por esta limitación que el método histopatológico es de uso muy limitado en los casos de queratitis en humanos.
Diagnóstico molecular
Hasta hace 10 años, el diagnóstico de la queratomicosis se realizaba exclusivamente con las tinciones y el cultivo. Actualmente se encuentran disponibles nuevas técnicas diagnósticas. La capacidad para la detección e identificación de material genómico en cualquier tipo de muestra ha permitido el diagnóstico de muchas enfermedades genéticas o infecciosas basado en secuencias de ADN. En la actualidad, el diagnóstico molecular se lleva a cabo en la mayoría de las clínicas oftalmológicas especializadas (directa o indirectamente, enviando las muestras a laboratorios de referencia).
Un estudio reciente comparó la sensibilidad entre el examen directo, cultivo y reacción en cadena de la polimerasa (PCR), resultando en un 66.7%, 59.3% y 92,6% respectivamente 32. Otra técnica que se encuentra en estudio es la disociación de ADN de alta resolución o HRM (por sus siglas en inglés "High Resolution Melting"), que mostró una especificidad y sensibilidad del 100%, identificando así mismo entre especies de hongos filamentosos y levaduras 33. Otro estudio usó por primera vez el inmunoensayo de punto, o dotblot, como prueba diagnóstica en la queratitis micótica, resultando una especificidad y sensibilidad del 100% 34, ubicándose como una prueba de diagnóstico relativamente económica, rápida y de fácil ejecución en laboratorios de baja complejidad. Se espera que en el futuro pueda tener un impacto para el rápido diagnóstico y tratamiento de la queratomicosis.
TRATAMIENTO DE LAS ÚLCERAS
MICOTICAS
Es esencial el inicio rápido de la terapéutica dado que incluso un retraso en término de horas puede afectar el resultado visual final; además no sólo se requiere de un diagnóstico rápido sino también la administración del tratamiento antimicótico apropiado para evitar los daños futuros 23, 35.
Hasta el momento no se cuenta con un patrón de oro para el tratamiento de la queratitis micótica, debido a la baja incidencia de la enfermedad y el número de pacientes con los cuales se cuenta, por lo cual es difícil realizar grandes ensayos clínicos especialmente en los países desarrollados.
Existen diversos medicamentos empleados para el tratamiento de la queratitis micótica, sin embargo este artículo solo incluirá aquellos que han tenido mayor uso en la práctica clínica.
Manejo Farmacológico
El tratamiento de la queratitis micótica se realiza principalmente por medio de agentes antimicóticos. La queratoplastia o el trasplante corneal se reserva por lo general para el tratamiento agudo de perforación corneal y para la rehabilitación visual después de la cicatrización corneal.
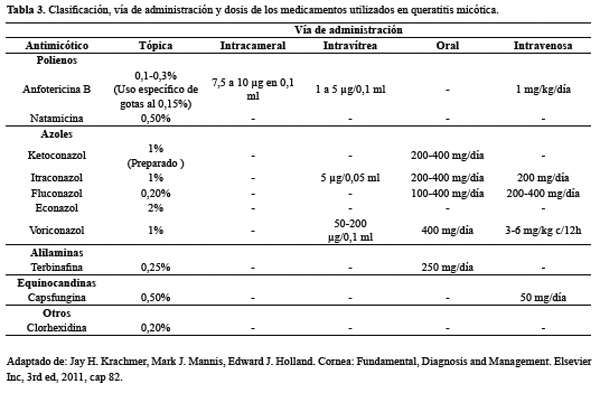
La penetración del hongo hacia las capas profundas de la córnea ensombrece el pronóstico del cuadro, lo que hace necesario que los antimicóticos usados posean una excelente penetración tanto corneal como a nivel intraocular, sin embargo son pocos los que ofrecen este beneficio sin causar una reacción toxica a nivel ocular35. Se ha dispuesto de varios grupos terapéuticos en el manejo (Tabla 3), dentro de los cuales se tienen: polienos (anfotericina B, natamicina, y nistatina), azoles (ketoconazol, miconazol, econazol, fluconazol, itraconazol, voriconazol y posaconazol), alilamina (terbinafina) y equinocandinas (caspofungina) 16, 23, 35, 37.
Los medicamentos antimicóticos sistémicos se recomiendan como tratamiento complementario en casos severos, en donde ya hay una reacción de la cámara anterior. Sin embargo, no se han realizado estudios controlados que demuestren su beneficio 16.
La eficacia clínica de un agente antimicótico depende en gran medida de la concentración alcanzada en el tejido ocular diana. Esto a su vez depende un número de factores incluyendo la masa molecular y la concentración del fármaco, la vía por la que se ha administrado, la duración del contacto con el tejido ocular y la capacidad del compuesto de penetrar en el ojo. Los compuestos con una masa molecular superior a 500 Da, tales como anfotericina B (924,10 Da), natamicina (665,75 Da), o ketoconazol (531,44 Da) apenas pueden penetrar en un epitelio corneal intacto porque la fuerza de fricción reduce cada vez más su difusión 35, 36. Entonces, al considerar esta información y según el estado de la córnea del paciente, se individualizaría el manejo para evitar una falla terapéutica.
De los agentes antimicóticos, la anfotericina B, natamicina, fluconazol y miconazol se han utilizado rutinariamente para tratar la queratitis micótica durante varias décadas, sin embargo, debido a su escasa penetración corneal después de la administración tópica, así como su variable espectro de actividad antifúngica y éxito clínico no demostrado; se presentan grandes limitaciones cuando se trata de evaluar la eficacia clínica de estos medicamentos 35, 38.
A continuación se describen los grupos de fármacos principales ya enunciados:
POLIENOS
Siguen siendo un componente importante como arsenal ocular antimicótico. Su función consiste en unirse directamente al ergosterol, un esterol único presente en las membranas citoplasmáticas de los hongos. La integridad de estas membranas se interrumpe, dando lugar a fugas de aquellos componentes intracelulares esenciales 35.
La extensión del daño a las membranas fúngicas es dosis dependiente, sin embargo, no es posible aumentar la dosis del fármaco más allá de una cierta concentración, ya que puede ser afectada la membrana citoplasmática de las células del huésped (toxicidad de los polienos). La natamicina (pimaricina) y anfotericina B son los polienos de uso actual en el manejo de las micosis oftálmicas.
Anfotericina B
Es fungistático o fungicida, dependiendo de la concentración del fármaco que se utilice y la susceptibilidad de los patógenos 35, 39.
La anfotericina B es el tratamiento de elección para las infecciones sistémicas causadas por Cándida, Aspergillus y Fusarium; se puede administrar por vía intravenosa, tópica, intravítrea e intracameral como manejo para la queratomicosis.
La anfotericina B tópica (0.1 - 0.3%) es el tratamiento estándar para las infecciones oculares debidas a Cándida y hongos similares, mientras que la natamicina (5%) es el tratamiento habitual de los hongos filamentosos tal como Fusarium 25, 35, 36.
Para administrar por infusión intravenosa la anfotericina B se realiza una solución de 0,1 mg/ml en una solución al 5% de dextrosa (la solución salina no puede ser utilizada ya que el fármaco puede precipitarse). La dosis recomendada es de 1 mg/kg/día; dosis menores35 suelen ser ineficaces. Debido a que la tolerancia a la anfotericina B varía mucho entre los pacientes, la dosis se debe ajustar de manera individual; lo más conveniente es dar inicialmente una dosis de prueba baja y aumentar gradualmente.
La toxicidad renal se estima que ocurre en casi el 80% de pacientes tratados con anfotericina B intravenosa 35, por lo cual se debe hacer vigilancia realizando pruebas de función renal. Tras la administración sistémica es frecuente que se presente cefalea, escalofríos, fiebre y anorexia; otros efectos secundarios incluyen anemia moderada, náuseas, vómitos, calambres, manifestaciones gastrointestinales, diarrea y tromboflebitis local en el sitio de infusión 35, 39.
La concentración tópica más comúnmente prescrita para la queratitis micótica son gotas al 0,15% la cual penetra bien en el estroma y puede conseguir suficiente concentración en relación con hongos susceptibles, sin embargo, su penetración a través de la córnea con epitelio intacto es pobre 35, 36, 39; las gotas pueden instilarse cada 30 a 60 minutos, el problema de su uso, es la toxicidad corneal que se puede presentar.
Otras vías de administración:
La inyección intravítrea de la anfotericina B (en cantidades de 1 a 5 μg) se ha recomendado para el tratamiento de la endoftalmitis de origen micótico, sin embargo este modo de administración puede ser altamente destructivo dando lugar a necrosis y desprendimiento de retina. La administración intracameral (7,5 a 10 μg en 0,1 ml) se ha utilizado para tratar micosis intraoculares, incluyendo endoftalmitis 39. La eficacia de estos modos de administración es difícil de evaluar dada la ausencia de evidencia en estudios clínicos controlados 35
Morand y colaboradores en su estudio demostraron los beneficios de una preparación oftálmica a base de anfotericina B liposomal, la cual tenía buena estabilidad incluso cuando se almacenaba a temperatura ambiente, lo que facilitaría su uso 39. Ya se ha demostrado la reducida toxicidad ocular para la inyección intravítrea en conejos y monos, y se esperan los mismos efectos en estudios en humanos esto es debido a la localización de la droga dentro de la bicapa de fosfolípidos con lo cual se limita el contacto con las células epiteliales, reduciendo el daño generadas en las mimas. Así, se obtiene una combinación con toxicidad reducida, una mayor persistencia en el sitio de acción y una mayor concentración de anfotericina B, por lo cual se aumentaría considerablemente el índice terapéutico para el tratamiento de queratitis micoticas 40, sin embargo en el medio no se encuentran estudios que avalen el uso de esta combinación y no se disponen de ensayos clínicos en el momento.
Natamicina
En la actualidad la natamicina es el único agente antimicótico oftálmico de uso tópico aprobado por la FDA y es la droga de elección contra la queratitis por hongos filamentosos sin embargo, la penetración en el estroma corneal es limitada 16, 35-37, 41.
Se ha informado que tiene un amplio espectro de actividad contra varios hongos, incluyendo especies de Fusarium, Aspergillus, Acremonium, Penicillium, Lasiodiplodia, y Cándida 35, 38.
La natamicina es soluble en agua en una suspensión estable al 0.5%, siendo el medicamento de elección en muchos países, especialmente en los desarrollados. Su administración inicial es de una gota cada 1 ó 2 horas, se adhiere bien a la superficie de la córnea y es bien tolerada 38. Solo alrededor del 2% del fármaco es biodisponible tras su aplicación tópica, lo cual complica la utilidad de la natamicina aún más por el hecho de que se asienta sobre la córnea tras la instilación y se degrada fácilmente, reduciendo su efecto.
AZOLES
Interfieren en la síntesis del ergosterol al inhibir la C-14 alfadesmetilasa, enzima acoplada al citocromo P-450 y que transforma el lanosterol en ergosterol. Esta inhibición altera la fluidez y permeabilidad de la membrana y produce inhibición del crecimiento y la replicación celular 35, 36.
Dentro de este grupo se destacan dos clases: los imidazoles y los triazoles los cuales comparten el mismo espectro y mecanismo de acción
Ketoconazol
Fue el primer azol de amplio espectro absorbible por vía oral, con actividad contra Aspergillus, Cándida y Fusarium; actualmente disponible en presentación oral (200 mg) en todo el mundo 35.
La administración a largo plazo de altas dosis de ketoconazol puede provocar impotencia, ginecomastia o alopecia, lo que es problemático teniendo en cuenta la naturaleza de larga duración de la terapia para la queratitis.
La aplicación tópica de ketoconazol al 1% y su fórmula en suspensión han sido utilizadas para la queratitis micótica. Esta preparación es eficaz para inhibir la progresión de las infecciones fúngicas sin evidencia de asociación significativa de toxicidad corneal38. Sin embargo, en la actualidad no es de uso común como terapia inicial.
Itraconazol
Es un antimicótico triazol de amplio espectro, con un alto grado de eficacia contra Aspergillus y otros hongos filamentosos; se absorbe bien tras la administración oral, generalmente bien tolerada, aunque la queja más común es el malestar gastrointestinal 37. Con menor frecuencia se han observado efectos secundarios que incluyen hipertrigliceridemia, hipopotasemia, edema, disminución de la libido y ginecomastia35.
El principal inconveniente de la utilización de itraconazol por vía oral para el tratamiento de infecciones oculares por hongos es su escasa penetración en la córnea, el humor acuoso y humor vítreo; en comparación con el de fluconazol y ketoconazol 35, 36.
Respecto a la administración tópica ocular de itraconazol se ha demostrado que en concentración al 1% es bien tolerada cuando se usa para el tratamiento de la queratitis micótica leve, sin embargo, no ha mostrado efectividad en el tratamiento de queratitis micótica severa, quizás debido a su insuficiente penetración corneal 36.
Guzek y colaboradores demostraron que cuando el itraconazol se disuelve en un vehículo adecuado y se aplica tópicamente a las córneas de conejo, se alcanzan concentraciones aproximadas de 200 a 250 μg/g de tejido corneal. Hasta el momento no se cuenta con informes que demuestren estos resultados, ni de la administración de itraconazol por otras vías como la subconjuntival o la intravítrea en un entorno clínico.
Kalavathy y colaboradores 41 realizaron un estudio donde se evaluó la eficacia clínica de una preparación de gotas oftálmicas con itraconazol disponible comercialmente al 1% en comparación con un régimen terapéutico estándar (gotas de natamicina al 5%) como tratamiento para la queratitis micótica, encontrando una mayor proporción de pacientes tratados con natamicina con respuestas favorables en comparación con aquellos que reciban el itraconazol tópico, y concluyen que la natamicina tópica debe ser considerada como la terapia de elección para la queratitis micótica filamentosa, el itraconazol tópico podría ser utilizado, en particular si las infecciones se deben a Aspergillus spp o Curvularia spp.
Fluconazol
Antifúngico de la familia de los triazoles, tiene una excelente eficacia ante las Cándidas y menor efectividad ante los hongos filamentosos 11. La formulación tópica de fluconazol al 0,2% tiene una penetración ocular mayor que la anfotericina B y la natamicina, así como una baja toxicidad ocular. Algunos autores lo utilizan como primera opción para el tratamiento de las queratitis por Cándida 11, 35
El fluconazol exhibe excelentes propiedades farmacocinéticas a nivel ocular y es clínicamente efectivo en la queratitis por Cándida, sin embargo se han visto efectos inferiores a la natamicina como tratamiento primario de la queratitis por hongos filamentosos 36.
Sonego y colaboradores 42 describieron una respuesta clínica satisfactoria con fluconazol tópico en la queratitis causada por hongos filamentosos, sin encontrar diferencia estadísticamente significativa entre los pacientes tratados con fluconazol tópico solo y los que recibieron una combinación de fluconazol tópico y ketoconazol oral, concluyendo así el poco beneficio adicional de esta terapia combinada.
Yilmaz y Maden 43 en el 2005 realizaron un estudio donde se evaluaba la eficacia de la aplicación subconjuntival de fluconazol ante el fracaso de la terapia intravenosa y oral del mismo, concluyeron que su uso podría ser eficaz para el tratamiento de la queratitis micótica severa, siendo muy útil para evitar la intervención quirúrgica en una fase aguda de la infección. Sin embargo la eficacia de las diversas dosis no se pudo determinar, esto en parte es debido a la muestra poco significativa del estudio.
Econazol
Fármaco antifúngico de uso tópico, derivado del imidazol. Prajna y colaboradores 36 en el 2003 informaron de una preparación tópica de econazol al 2% que fue tan eficaz como la natamicina tópica para tratamiento de la queratitis micótica, sin embargo, los resultados no fueron evaluados con referencia a la severidad de la úlceras o las especies de hongos aislados; de igual manera Prajna y colaboradores et al 44, en otro estudio realizado en el 2004 concluyeron que el uso concomitante de econazol y natamicina al 2% no mostró beneficios adicionales como parte del tratamiento. Hasta el momento no se cuentan con pruebas que indiquen el uso de econazol como terapia de primera elección para manejo de la queratitis micótica.
Voriconazol
Antimicótico triazólico derivado del fluconazol, que se caracteriza por su amplio espectro de acción; se encuentra disponible comercialmente para la administración sistémica, en formulaciones orales e intravenosa 45. Tiene un excelente espectro de actividad antimicótica y es activo contra especies que se sabe que son resistentes a otro tipo de agentes antimicóticos comúnmente usados 38, 46.
El voriconazol ha mostrado tener mayor actividad in vitro que la anfotericina B y el fluconazol ante cepas de Cándida (siendo la más susceptible la C. albicans) y ante cepas de hongos filamentosos como Aspergillus sp, Fusarium sp, Pseudallescheriasp, Penicillium spp, Acremonium spp y otros hongos como Histoplasmacapsulatum, Coccidioidesimmitis, Blastomycesdermatitidis, Scedosporiumapiospermum, Paracoccidioidesbrasiliensis y Cryptococcus neoformans 36, 46, 47.
Su administración sistémica ha demostrado tener buena penetración ocular, encontrándose concentraciones mínimas inhibitorias eficaces en humor vítreo y acuoso tras dos días de tratamiento con voriconazol oral (400 mg/día) 36, 38, 46, 47. La formulación tópica del colirio de voriconazol (3 μg/ml), presenta buena estabilidad y actividad antifúngica. La administración intravítrea de voriconazol (50 μg/ml) ha demostrado ser eficaz frente a las endoftalmitis de origen micótico refractarias, e inocua para las estructuras oculares 38.
Se informa del uso reciente de la inyección intraestromal de voriconazol como método de rescate ante la no respuesta al manejo tópico en casos de ulceras profundas. Prakash y colaboradores 48 realizaron una serie de tres casos en el que encontraron mejor respuesta con este manejo como terapia contra la queratitis micótica con voriconazol (50 μg/0.1 ml), reportando que este tiene una actividad óptima contra hongos que son resistente a la anfotericina B e itraconazol, teniendo un buen perfil de seguridad. Las inyecciones intraestromales de voriconazol ayudaron en la resolución pronta y completa de las úlceras micóticas y concluyen que su uso tópico sumado a la inyección intraestromal podría resultar beneficioso en tales casos, sin embargo hacen falta ensayos clínicos para poder determinar este método como terapia de manejo.
Al-Badriyeh y colaboradores 49 demostraron éxito clínico con el voriconazol tópico al 1% cuando lo utilizaron como terapia de primera línea para el tratamiento de la queratitis por C. albicans, concluyendo que su uso tópico podría reducir los costos, la toxicidad y las interacciones medicamentosas comunes asociadas con las terapias antimicóticas.
Misceláneo de medicamentos:
Caspofungina
Antimicótico sistémico con toxicidad significativamente menor que los azoles. Se ha demostrado que la caspofungina por vía intravenosa no penetra bien en el ojo y, por lo tanto, no se utiliza para queratitis micotica 36
Clorhexidina:
En un estudio realizado en Bangladesh donde se comparó gluconato de clorhexidina al 0,2% con natamicina al 2,5% para el tratamiento de queratitis micótica (fue usada en esta concentración dado que la era comercialmente disponible en Bangladesh) para pacientes que tenían queratitis por Aspergillus spp y por Fusarium spp. Se demostró eficacia superior con el uso de clorhexidina en comparación con la natamicina 35.
Los resultados obtenidos en este estudio son engañosos, ya que la fórmula utilizada de natamicina al 2,5% es una dosis subterapéuticas como tratamiento de las córneas infectadas, lo cual da resultados poco óptimos sobre la eficacia clínica, infiriendo por lo tanto que la natamicina pudiese ser menos eficaz que la clorhexidina frente a especies de Aspergillus y otros hongos filamentosos. Los intentos de utilizar la clorhexidina en el tratamiento de la queratitis micótica en África no han tenido resultados alentadores 35.
Terbinafina:
La terbinafina es una alilamina con actividad antimicótica, que ha sido utilizada con éxito para el tratamiento de la infección por hongos de piel. Su mecanismo de acción consiste en impedir la biosíntesis de ergosterol a través de la inhibición específica y selectiva de la escualenoepoxidasa, interfiriendo con la integralidad de la membrana celular fúngica.
El efecto bactericida o bacteriostático de la terbinafina depende de la concentración utilizada. La terbinafina tiene efecto bacteriostático a concentraciones bajas y acción bactericida con concentraciones altas, se considera muy segura, ya que no inhibe el citocromo P-450, ni afecta a la secreción endocrina.
Varios estudios han sugerido que la terbinafina tiene un amplio espectro de actividad antimicótica pudiendo penetrar eficazmente en la córnea, sin efectos colaterales.
Qing-feng y colaboradores 50 en un ensayo clínico realizado en China, sugieren que la terbinafina tópica al 0,25% es un fármaco eficaz para la queratitis micótica filamentosa, particularmente en casos con úlceras pequeñas y menos profundas, considerándola como fármaco de primera línea en el tratamiento de queratitis micótica filamentosa en los países en desarrollo donde la natamicina no se encuentra disponible.
Hasta el momento a falta de evidencia se necesitan ensayos clínicos para proporcionar una base de pruebas rigurosas para ayudar a guiar el tratamiento de queratitis micótica.
Terapia adyuvante
La queratomicosis comúnmente se complica por la elevación de la presión intraocular asociada secundaria a uveítis. Un ciclopléjico tópico con homatropina o ciclopentolato al 1% facilita la movilidad pupilar y de esta forma evita la formación de sinequias, reduciendo la posibilidad glaucoma por bloqueo pupilar. Para el manejo de la presión intraocular elevada las mejores opciones son un β-bloqueador tópico o un inhibidor de la anhidrasa carbónica 51.
Manejo Quirúrgico
Los pacientes que no responden al tratamiento médico con los fármacos antimicóticos tópicos y orales suelen requerir intervención quirúrgica, incluyendo el trasplante de córnea. Aproximadamente el 15% a 27% de los pacientes requieren intervención quirúrgica 52. Sin embargo, en algunos casos incluso la cirugía corneal no devolverá la visión, lo que resulta en pacientes con ceguera o con alguna deficiencia visual. Por eso se ha enfatizado en un diagnóstico precoz junto al manejo inicial adecuado, fundamental para la recuperación eficiente en la queratitis micótica.
Aproximadamente un tercio de las úlceras corneales micóticas no responden al tratamiento médico, y pueden dar lugar a la perforación de la córnea 51. Los principales objetivos del manejo quirúrgico son el control de la infección y el mantenimiento de la integridad del globo ocular. Posterior a una queratoplastia penetrante la terapia con antimicóticos tópicos sumado con fluconazol o ketoconazol sistémico se debería continuar. El uso de corticosteroides tópicos en el post-operatorio sigue siendo controvertido, sin embargo se deben evitar a principios de este periodo.
Las diversas intervenciones quirúrgicas realizadas en el manejo son:
Raspado corneal: normalmente se realiza como un procedimiento de diagnóstico inicial, no sólo proporciona material para citología y cultivo, sino que también promueve la absorción del fármaco mediante la eliminación de la barrera epitelial.
Desbridamiento: Es la intervención quirúrgica más simple e importante. Esto ayuda en la eliminación de material necrótico, citorreducción de los organismos y la promoción de la penetración del fármaco. Debe repetirse cada 24 a 48 horas.
Recubrimiento conjuntival: Un pequeño número de pacientes se pueden beneficiar de este procedimiento.
La técnica de colgajo o recubrimiento conjuntival es un procedimiento utilizado en casos de adelgazamiento corneal, queratitis infecciosas y traumatismos. Se han descrito diversos tipos de colgajos (parciales y totales) cuyo éxito depende de una depurada técnica quirúrgica 53.
Queratoplastia lamelar: una serie de pacientes se han reportado en la bibliografía los cuales han respondido bien con esta técnica. Los principales objetivos son el control de la infección y el mantenimiento de la estructura integral del globo ocular. Es importante el tiempo para la realización de la queratoplastia. Las principales series retrospectivas describen que se realizó en las primeras cuatro semanas desde la presentación del caso, a causa del fracaso en el manejo médico y en otros por la recurrencia de la infección. Está contraindicada en el tratamiento de la queratitis fúngica activa a menos que sea posible eliminar todo el tejido infectado; de lo contrario, los hongos pueden ser atrapados en el espacio intralaminar, manteniéndolos aislados de la terapia antifúngica tópica y de la respuesta inmune del huésped, lo que conduce a la posibilidad de persistencia de la infección 54.
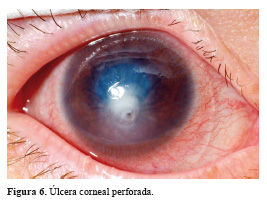
Queratoplastia penetrante terapéutica: está indicado en el tratamiento precoz de la queratomicosis profunda que no responde al tratamiento médico, asociado a perforación corneal inminente (Figura 6). El momento ideal del injerto es de 5 días después del manejo médico intensivo. Esta técnica elimina la infección residual y restaura la integralidad del globo ocular. Después de la operación, los antifúngicos tópicos deben continuarse durante 6 a 8 semanas 55.
CONCLUSIONES
La queratitis micótica es una de las formas más difíciles de queratitis infecciosa para los oftalmólogos desde el punto de vista diagnóstico y de tratamiento. Es causada por un gran número de especies de hongos, siendo en conjunto Cándida, Aspergillus y Fusarium los más frecuentes en el mundo. Se presentan dificultades en el manejo debido a una serie de problemas relacionados con el diagnóstico inicial y la elección temprana del antifúngico específico. Es necesario implementar técnicas moleculares de rápido diagnóstico, dada la baja sensibilidad de las técnicas iniciales como tinciones Gram y Giemsa, y con esto mejorar el pronóstico de la infección. Se recomienda basar el tratamiento definitivo dependiendo al cultivo. Como se concluyen en los diferentes estudios mencionados en el momento no existe medicamento que muestre superioridad al uso de natamicina al 5% por lo tanto hasta que no se realicen nuevos ensayos clínicos, sigue siendo la terapéutica de primera línea en el manejo de la queratitis fúngica. Son necesarios otros estudios sobre la inhibición de esporas, y la eficacia relativa de los fármacos tópicos y sistémicos. Si el hongo es filamentoso, la primera elección es natamicina tópica; si el hongo es no filamentoso, puede administrarse un tratamiento inicial con natamicina seguido de otros tratamientos como anfotericina B, fluconazol o ketoconazol. Si la infección sigue empeorando o se empeora el estado de la cámara anterior, el tratamiento quirúrgico puede estar indicado. Esto incluye queratoplastia terapéutica y, en casos graves, puede ser necesaria la enucleación.
REFERENCIAS
1. Pita D, Fontenla JR, Grau M, Díaz M. (1994). Diccionario terminológico de oftalmología. Madrid: I.M.& C. [ Links ]
2. Allan BDS, Dart JKG. Strategies for the management of microbial keratitis. Br J Ophthalmol. 1995; 79: 777-786. [ Links ]
3. O'Brien TP, Hazlett LD. Pathogenesis of ocular infection. En: Pepose JS, Holland GN, Wilhelmus KR (Eds), Ocular infection & immunity, Mosby- Year Book Inc., EE.UU. 1996; p. 200-214. [ Links ]
4. Pepose JS, Wilhemus KR. Divergent approaches to the management of corneal ulcers. Am J Ophthalmo. 1992; 114: 630-632. [ Links ]
5. Gálvez A, Bengoa A (2001). Queratitis Micótica. En Bengoa A, Gutierrez E y Perez E (Eds.). Atlas de urgencia en oftalmología. (p 152). Barcelona: Ed Glosa. [ Links ]
6. Wilhelmus KR, Robinson NM, Font RA, Hamill MB, Jones D.B. Fungal keratitis in contact lens wearers. Am J Ophthalmol.1988; 106:706-8. [ Links ]
7. Srinivasan M. Fungal keratitis.Curr Opin Ophthalmol. 2004;15:321-327. [ Links ]
8. Seal D, Bron A, Hay J. (1998). Ocular Infection (1ª Ed.). London: Martin Dunitz. [ Links ]
9. Kanski J.(2003). Oftalmología Clínica (5ta Edición). Elsevier. [ Links ]
10. Vaughan D, Asbury T. (2004). Oftalmología General (13va edición); Chile: Manual Moderno. [ Links ]
11. Zloty P. Diagnosis and management of fungal keratitis. American Academy of Ophthalmology. Focal Points 2002; 20: 1-13. [ Links ]
12. Whitcher JP, Srinivasan M, Upadhyay MP. Corneal blindness: a global perspective. Bull World Health Organ, 2001;79: 214-221. [ Links ]
13. Leck, A. K., Thomas, P. A., Hagan, M., Kaliamurthy, J., Ackuaku, E., John, M., et al. Aetiology of suppurative corneal ulcers in Ghana and South India and epidemiology of fungal keratitis. Br J Ophthalmol. 2002;86:1211-1215 [ Links ]
14. Ibrahim MM, de Angelis R, Lima AS, Viana de Carvalho GD, Ibrahim FM, et al. A New Method to Predict the Epidemiology of Fungal Keratitis by Monitoring the Sales Distribution of Antifungal Eye Drops in Brazil. PLoS ONE. 2012; 7(3): e33775 [ Links ]
15. Wilhelmus KR. Climatology of dematiaceous fungal keratitis. Am J Ophthalmol. 2005;140: 1156-1157. [ Links ]
16. Tuli SS. Fungal keratitis. Clin Ophthalmol. 2011; 5:275-279 [ Links ]
17. Nhung P, Thu T, Ngoc L, Ohkusu K, Ezaki T. Epidemiology of Fungal Keratitis in North Vietnam. J Clin Exp Ophthalmol. 2012;3:238 [ Links ]
18. Xie L, Zhong W, Shi W, Sun S. Spectrum of fungal keratitis in north China. Ophthalmology. 2006; 113: 1943-1948. [ Links ]
19. Tuli SS, Iyer SA, Driebe WT. Fungal keratitis and contact lenses: an old enemy unrecognized or a new enemy on the block? Eye Cont Lens. 2007; 33 (6): 415-417. [ Links ]
20. Houang E, Lam D, Fan D, Seal D. Microbial keratitis in Hong Kong: relationship to climate, environment, and contact lens disinfection. Trans R Soc Trop Med Hyg. 2001; 95: 361-7. [ Links ]
21. Ormerod L, Hertzmark E, Gomez D, Stabiner R, Schanzlin D, Smith R. Epidemiology of microbial keratitis in southern California. A multivariate analysis. Ophthalmology.1987;94: 1322-33. [ Links ]
22. Rattanatam T, Heng W, Rapuano C, Laibson P, Cohen E. Trends in contact lens-related corneal ulcers. Cornea. 2001;20:290-4. [ Links ]
23. Shukla P, Kumar M, Keshava G. Mycotic keratitis: an overview of diagnosis and therapy. Mycoses. 2008; 51(3), 183-199. [ Links ]
24. Kamada R, Monden Y, Uehara K, Yamakawa R, Nishimura K. Rare case of fungal keratitis caused by Plectosporium tabacinum. Clinical Ophthalmology. 2012;6 1623-1627. [ Links ]
25. Thomas PA.Fungal infections of the corneal. Eye. 2003; 17:852-862 [ Links ]
26. Sun RL, Jones DB, Wilhelmus KR. Clinical Characteristics and Outcome of Candida Keratitis. Am J Ophthalmol. 2007; 143(6): 1043-1045. [ Links ]
27. Fontenla J, Vázquez X; Grau M, Pita D. Diagnóstico y tratamiento de las queratitis. La Medicina Hoy; 61 (1409). 16-23. Disponible en: http://www.jano.es/ficheros/sumarios/1/61/1409/57/1v61n1409a13022361pdf001.pdf [ Links ]
28. Singh D. (2013). Fungal Keratitis. Department of Ophthalmology, Guru Nanak Dev University. Disponible en: http://emedicine.medscape.com/ article/1194167-overview#a0104. [ Links ]
29. Rymgayłło-Jankowska B, Rakowska E, Haszcz D, Kudasiewicz-Kardaszewska A, Suchodoła- Ratajewicz E, Bielińska A, et al. Fungal infections of the cornea: diagnostics and management. Klinika Oczna. 2007;109:475-8. [ Links ]
30. Gopinathan U, Garg P, Fernandes M, Sharma S, Athmanathan S, Rao GN. The epidemiological features and laboratory results of fungal keratitis: a 10-year review at a referral eye care center in South India. Cornea. 2002; 21: 555-9. [ Links ]
31. Sharma S, Kunimoto DY, Gopinathan U, Athmanathan S, Garg P, Rao GN. Evaluation of corneal scraping smear examination methods in the diagnosis of bacterial and fungal keratitis: a survey of eight years of laboratory experience. Cornea. 2002; 21: 643-7. [ Links ]
32. Ferrer C, Alio JL. Evaluation of molecular diagnosis in fungal keratitis. Ten years of experience. J Ophthalmic Inflamm Infect. 2011; 1:15-22. [ Links ]
33. Goldschmidt P, Degorge S, Benallaoua D, Semoun O, Borsali E, Le Bouter A, et al. New strategy for rapid diagnosis and characterization of keratomycosis. Ophthalmology. 2012;119:945-50. [ Links ]
34. Kuo M, Chang H, Cheng C, Chien C, Fang P, Chang T. A Highly Sensitive Method for Molecular Diagnosis of Fungal Keratitis. Ophthalmology. 2012;119(12):2434-42 [ Links ]
35. Thomas PA. Current perspectives on ophthalmic mycoses. ClinMicrobiol Rev. 2003; 16:730-797. [ Links ]
36. Prajna N, John R, Nirmalan P, Lalitha P, Srinivasan M. A randomised clinical trial comparing 2% econazole and 5% natamycin for the treatment of fungal keratitis. Br J Ophthalmol. 2003;87:1235- 1237. [ Links ]
37. FlorCruz (2008). Medical interventions for fungal keratitis. Cochrane Database Syst Rev. 2008: CD004241. Disponible en: http://www.ncbi.nlm. nih.gov/pubmed/18254043 [ Links ]
38. Badriyeh D, Neoh C, Stewart K, Kong D. Clinical utility of voriconazole eye drops in ophthalmic fungal keratitis. Clin Ophthalmol. 2010;4 391-405 [ Links ]
39. Morand K, Bartoletti A, Bochot A, Barratt G, Brandely M, Chast F. Liposomal amphotericin B eye drops to treat fungal keratitis: Physico-chemical and formulation stability. Int J Pharm. 2007;1;344(1- 2):150-3. [ Links ]
40. Cannon J, Fiscella R, Pattharachayakul S, Garey K, De Alba F, Piscitelli S, et al. Comparative toxicity and concentrations of intravitreal amphotericin B formulations in a rabbit model. Invest Ophthalmol Vis Sci. 2003;44, 2112-2117. [ Links ]
41. Kalavathy C, Parmar P, Kaliamurthy J, Philip V, Ramalingam M, Jesudasan C, et al. Comparison of Topical Itraconazole 1% With Topical Natamycin 5% for the Treatment of Filamentous Fungal Keratitis. Cornea. 2005;24:449-452 [ Links ]
42. Sonego S, Sanchez D, Ayala R, Torres G, Ta C, Barbosa L, et al. Clinical results of topical fluconazole for the treatment of filamentous fungal keratitis. Graefe's Arch Clin Exp Ophthalmol. 2006;244(7):782-7. [ Links ]
43. Yilmaz S, Maden A. Severe Fungal Keratitis Treated With Subconjunctival Fluconazole. Am J Ophthalmol. 2005;140(3):454-8 [ Links ]
44. Prajna P, Nirmalan P, Mahalakshmi R, Lalitha P, Srinivasan M. Concurrent use of 5% natamycin and 2% econazole for the management of fungal keratitis. Cornea. 2004; 23(8), 793-796 [ Links ]
45. Scott LJ, Simpson D, Voriconazole : a review of its use in the management of invasive fungal infections. Drugs. 2007;67(2):269-98. [ Links ]
46. Sponsel W, Chen N, Dang D, Paris G, Graybrill J, Najvar L, et al. Topical Voriconazole as a Novel Treatment for Fungal. Antimicrob Agents Chemother. 2006;50(1): 262-268. [ Links ]
47. Prajna N, Mascarenhas J, Krishnan T, Reddy P, Prajna L, Srinivasan M, et al. Comparison of Natamycin and Voriconazole for the Treatment of Fungal Keratitis. Arch Ophthalmol. 2010;128(6):672-8 [ Links ]
48. Prakash G, Goel M, Jeewan S, Evaluation of Intrastromal Injection of Voriconazole as a Therapeutic Adjunctive for the Management of Deep Recalcitrant Fungal Keratitis. Am J Ophthalmol 2008;146 :56-59. [ Links ]
49. Al-Badriyeh D, Leung L, Davies GE, Stewart K, Kong D. Successful use of topical voriconazole 1% alone as first-line antifungal therapy against Candida albicans keratitis. Ann Pharmacother. 2009;43(12):2103-7 [ Links ]
50. Liang Q, Jin X, Wan X, Sun X. Effect of topical application of terbinafine on fungal keratitis. Chin Med J. 2009;122 (16):1884-1888 [ Links ]
51. Sudan R, Sharma Y. Keratomycosis: clinical diagnosis, medical and surgical treatment. JK Sci. 2003; 5:3-10 [ Links ]
52. Iyer S, Tuli S, Wagoner R. Fungal keratitis: emerging trends and treatment outcomes. Eye Contact Lens. 2006; 32(6):267-71 [ Links ]
53. Lim L, How A, Ang L, Tan D. Gundersen Flaps in the Management of Ocular Surface Disease in an Asian Population. Cornea. 2009;28(7):747-751. [ Links ]
54. Krachmer J, Mannis M, Holland E.(2011) Cornea (3rd ed.). Elsevier Inc. [ Links ]
55. Xie L, Dong X, Shi W. Treatment of fungal keratitis by penetrating keratoplasty. Br J Ophthalmol. 2001;85:1070-1074 [ Links ]