Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807
Rev. Univ. Ind. Santander. Salud vol.47 no.1 Bucaramanga Jan./Apr. 2015
Cría masiva y uso de ninfas de
Rhodnius pallescens, Barber, 1932
(Hemiptera, Reduviidae, Triatominae)
para ensayos biológicoso
Mónica Flórez M1,2,3, Víctor M. Angulo S1,2.
1. Unión Temporal Red Chagas Colombia. Bogotá, Colombia.
2. Grupo-CINTROP, Universidad Industrial de Santander. Piedecuesta, Santander.
3. Universidad Nacional de Colombia. Bogotá, Colombia
Correspondencia: Mónica Flórez. Dirección: Km 2 Sede UIS, Vía El Refugio - Guatiguará, Piedecuesta, Santander, Colombia. Correo electrónico: monicaflorezm@hotmail.com. Teléfono: 57-7-6344000, Ext. 3526.
Recibido: Mayo 19 de 2014 Aprobado: Diciembre 1 de 2014
Forma de citar: Florez M, Angulo VM. Cría masiva y uso de ninfas de Rhodnius pallescens, Barber, 1932 (Hemiptera, Reduviidae, Triatominae) para ensayos biológicos. rev.univ.ind.santander.salud 2015; 47(1): 15-22.
RESUMEN
Introducción: Rhodnius pallescens es una especie silvestre que hace intrusión a las viviendas en zonas en las cuales se han presentado brotes de Chagas agudo en Colombia; y para el estudio de sus características biológicas y el monitoreo de la susceptibilidad o resistencia de poblaciones de campo a insecticidas, se requiere del uso de una gran cantidad de insectos mantenidos en el laboratorio. Objetivo: Establecer condiciones de cría de ninfas de R. pallescens que permitan su mejor aprovechamiento en ensayos biológicos. Metodología: Se utilizó una cepa de laboratorio de R. pallescens proveniente de San Martin (Cesar, Colombia) y se realizaron bioensayos para: estimar el tiempo de alimentación, establecer condiciones de cría, estimar tiempos de desarrollo ninfal y comparar la fecundidad usando dos fuentes de alimentación y varios tipos de soporte. Resultados: 60 minutos de ofrecimiento de alimento permite la alimentación de 95% de las ninfas. El promedio de oviposición diario/hembra fue de 2,7 huevos y no varío significativamente con el consumo de sangre de gallina o ratón. La duración promedio del ciclo de vida desde huevo hasta el estadio ninfa-V fue de 128,6 días. El uso de cartulina negra y plumas dentro de los frascos de cría mejora la oviposición. Ninfas-V alimentadas desde ninfa-I y pesadas a los 5 o 6 días permite un aprovechamiento del 89% de las ninfas. Conclusiones: Los resultados de este trabajo brindan conocimiento para la cría masiva y el uso de ninfas de Rhodnius pallescens en ensayos biológicos.
Palabras clave: Triatominae, ciclo de vida, fecundidad, enfermedad de Chagas, bioensayos.
Mass breeding and use of nymph of Rhodnius pallescens, Barber,
1932 (Hemiptera, Reduviidae, Triatominae) for biological test.
ABSTRACT
Introduction: Rhodnius pallescens is a wild species which makes intrusion into dwellings in areas where there have been acute Chagas disease outbreaks in Colombia. Biologic research on their characteristics, and resistance to insecticides, requires the use of a large insect colony in the laboratory. Objective: To establish optimal breeding conditions of R. pallescens nymphs allowing better use in biological assays. Methodology: A laboratory strain of R. pallescens from San Martin (Cesar, Colombia) was used. Feeding time, breeding conditions, nymphal development times were assessed and fertility using two sources of feeding and different kinds of substrate was compared. Results: Providing food during 60 minutes allowed 95% of nymphs to be fed. The average daily oviposition per female was 2.7 eggs and did not vary significantly with the kind of blood used. The average duration of the life cycle from egg to nymph-V was 128.6 days. Using black cardboard and feathers in breeding jars increased oviposition. Nymphs-V (fed from nymph-I every 15 days) and weigthed at 5 or 6 days allowed the use of 89% of the nymphs. Conclusions: The results of this study allow offering recommendations for mass breeding and use of nymphs of R. pallescens in biological assays.
Keywords: Triatominae, life cycle, fecundity, Chagas disease, biological assay
INTRODUCCIÓN
La principal forma de transmisión al hombre del agente causal de la enfermedad de Chagas se produce por el contacto con las heces contaminadas de insectos hematófagos (Hemiptera, Reduviidae, Triatominae) que se han adaptado a vivir dentro de la vivienda humana y por tanto, los programas de control se han encaminado a su eliminación dentro de esta1. Para tal fin, se utilizan insecticidas piretroides aplicados en el intradomicilio y peridomicilio1. Los programas de control vectorial iniciaron su implementación en 1991 en los países de cono sur y no solo lograron reducir la infestación vectorial en las viviendas, si no que se certificó la eliminación de la transmisión intradomiciliaria de Trypanosoma cruzi por Triatoma infestans, en países como Uruguay, Chile, Paraguay, Argentina y Brasil y, por Rhodnius prolixus en el sur de México, Guatemala, Honduras, Nicaragua, El Salvador y Costa Rica2,3,4. Por otro lado, también existe el riesgo de contacto vectorial con especies silvestres que visitan periódicamente las estructuras construidas por el hombre y eventualmente pueden llegar a adaptarse a éstas5.
Entre las especies que hacen intrusión a la vivienda, Rhodnius pallescens, cobra relevancia porque su comportamiento demuestra una gran capacidad de adaptación a diferentes hábitats y condiciones ambientales, cercanos o dentro de las viviendas y por tanto su presencia constituye un factor de riesgo de contacto con el hombre en forma directa o por la contaminación de alimentos con T. cruzi. Es una especie considerada vector primario del agente causal de la enfermedad de Chagas en Panamá y secundario en Belice, Colombia, Costa Rica y Nicaragua6, con hábitats silvestres (palmas de Attalea butyracea, Coccus nucifera, Jessinea bataua y Elaeis oleífera, refugios de Dasypodidae, mamíferos, nidos de Psitacidae habitados por Didelphis marsuplialis, lugares frecuentados por Bradipodidae y Myrmecophagidae, nidos de Sciuridae y lugares con saurios), reportes de colonización en viviendas y peridomicilios (gallineros, palomares, porquerizas) y atracción a la luz artificial tanto en áreas rurales como urbanas7,8. En Colombia, se ha reportado su presencia en zonas sin poblaciones domiciliadas de Triatominae, donde se han presentado brotes de Chagas agudo por aparente transmisión oral, como en el departamento de Santander9. Uno de estos brotes fue en la zona urbana del municipio de San Vicente de Chucurí donde también se encontró indicios de resistencia a la deltametrina en ésta especie10.
El desarrollo potencial de resistencia a los insecticidas piretroides en las principales especies vectores, T. infestans y R. prolixus11, 12, 13 y en otras como R. pallescens10, creó la necesidad del monitoreo continuo de los cambios temporales en la susceptibilidad y de los mecanismos de resistencia y su evolución en las diferentes especies de Triatominae, con el fin de orientar las acciones adecuadas para el control vectorial en un área determinada. Los servicios de salud locales tienen entre sus actividades hacer éste monitoreo a insecticidas usados para el control de triatomínos en sus regiones y generalmente sus recursos son limitados tanto en materiales, como en personal.
Este tipo de estudios requieren un número considerable de individuos para realizar los ensayos de laboratorio, y por tanto es necesario tener un buen conocimiento de la biología de las especies que ayude a la colonización y cría masiva en condiciones de laboratorio. Así mismo, este conocimiento es necesario para otros estudios biológicos, fisiológicos, morfológicos, de interacción parasito-vector, control biológico, o de evaluación de nuevos compuestos insecticidas naturales o sintéticos.
Por lo anterior nos propusimos evaluar condiciones de cría de R. pallescens, como la estimación del tiempo de alimentación en los frascos de cría, estimación de los tiempos de desarrollo ninfal, comparación de la fecundidad usando dos fuentes de alimentación, comparación de la fecundidad usando diferentes soportes en los frascos de cría y evaluación de condiciones para el uso de ninfas-V estadio que permitan la producción masiva de insectos y su mejor aprovechamiento en ensayos biológicos.
METODOLOGÍA
Material Biológico: Se utilizó una colonia de R. pallescens procedente de la vereda Alto de la Paz en el municipio de San Martin en el departamento de Cesar (Colombia), iniciada en el laboratorio de entomología del CINTROP en Julio de 2001, mantenida sin aportes de material externo, en condiciones de 24-28°C de temperatura (T°), 60-80% de humedad relativa (HR), foto-período 12:12 horas y alimentada con gallina (Gallus gallus) quincenalmente. Para los algunos de los ensayos se utilizaron individuos de dos meses de edad, con el fin de asegurar que las hembras hubieran copulado y pasado por su periodo preovipositorio.
Estimación del tiempo de alimentación: Este bioensayo se realizó para estimar el tiempo de alimentación en un insectario donde los individuos son mantenidos agrupados en frascos y por tanto, la oportunidad de alimentación depende del tamaño de la boca del frasco y de la densidad de individuos. Para esto se tomaron cuatro grupos de 60 ninfas-V, cada uno, y se evaluó el tiempo de ofrecimiento de alimento (G. gallus), a los 30, 40, 50 y 60 minutos, pesando las ninfas antes y después del ofrecimiento. Se utilizaron frascos plásticos de 600 ml con una boca de 10 cm de diámetro.
Estimación de tiempos de desarrollo ninfal: Se tomó una cohorte de 10 hembras y 12 machos de dos meses de edad para la obtención de los huevos. Las ninfas-I se agruparon de acuerdo al día de eclosión dentro de frascos de plástico (3cm de diámetro x 5cm de alto) debidamente etiquetados y con un abanico de cartulina negra de soporte dentro para facilitar el acceso a la fuente de alimento. Se constituyeron dos cohortes de 100 ninfas-I, las cuales se mantuvieron en dos condiciones ambientales en una nevera de icopor, así: 1) 24-26°C (T°), 65% (HR) y 2) 24-26°C (T°), 85% (HR). Para lograr la variación en la humedad relativa se introdujeron frascos con agua que mantuvieran la humedad necesaria. La temperatura y humedad se midieron con un termohigrógrafo OPUS 10. En cada una de las cohortes, las ninfas se fueron separando sucesivamente en otros frascos según el día de muda.
A las ninfas-I se les ofreció sangre de gallina (G. gallus) desde el día de su nacimiento hasta que completaron al menos una alimentación. Luego de la primera ingesta el ofrecimiento fue semanal. Se registraron diariamente, el número de huevos, de individuos muertos, el día y número de ninfas mudadas. Con esta información se establecieron los descriptivos estadísticos del tiempo de desarrollo en días de cada estadio y de la tabla de vida, así: t: tiempo en días. x: Estadio. ax: Número observado de individuos vivos al inicio del estadio x. lx: Número observado de individuos vivos al final del estadio x. Lx: Probabilidad de un individuo al comienzo del estadio x de estar vivo al final de dicho estadio x. mx: Probabilidad de un individuo al principio del estadio x de morir al final de dicho estadio. dx: Número de individuos muertos de la cohorte original durante el intervalo del estadio x, donde dx= lx - lx+1. px: Probabilidad de supervivencia entre el estadio x y x+1, donde 1 -qx = lx+1/lx. qx: Probabilidad de mortalidad entre el estadio x y x+1, donde dx/lx = 1 - (lx+1/lx) = 1 - px. kx: Fuerza de la mortalidad, donde Log10 (ax/ax+1) = Log10 (ax) - Log10 (ax+1). Media: (Σt1+ t2 +…+tn)/lx. SD: Desviación estándar, donde SD=√(t1+ t2 +…+tn -Media)2/lx. Min: Número mínimo de días de un individuo vivo al final del estadio x. Max: Número máximo de días de un individuo vivo al final del estadio x.
Comparación de la fecundidad usando dos fuentes de alimento: Se tomaron dos grupos de 10 hembras y 10 machos de dos a tres meses de edad. A un grupo se les ofreció sangre de gallina (G. gallus) y al otro ratón (Mus musculus). Los insectos se colocaron por parejas en un frasco plástico y las hembras fueron pesadas antes y después de ofrecerles alimento. A los siete días se contaron los huevos en cada uno de los frascos. El ensayo se repitió seis veces. Las hembras que no ingirieron sangre no se tuvieron en cuenta.
Comparación de la fecundidad usando diferentes soportes: Se realizó un bioensayo similar al propuesto por Schilman et al14, cambiando los soportes utilizados. Se evaluaron los soportes usados de rutina (cartulina negra y cartón cartulina) en los frascos de cría y se probaron combinarlos con soportes relacionados con el hábitat natural de los Triatominae como plumas de gallina, hojas de palma y cuero de cabra. Un total de 60 hembras y 60 machos de R. pallescens, de dos a tres meses de edad, fueron puestos por parejas, durante siete días, en frascos plásticos de 8,2 cm de alto x 5 cm de diámetro, cuya boca tenía un tul asegurado con una banda elástica. Las parejas fueron expuestas a seis tratamientos como se describe a continuación: 1. Cartón cartulina (por un lado es cartón y por el otro cartulina blanca). 2. Cartulina negra y cartón cartulina. 3. Cartulina negra. 4. Cartulina negra y hojas de palma (hoja seca de Acrocomia aculeata de 8 cm). 5. Cartulina negra y plumas de gallina (3 plumas de 4 a 5 cm). 6. Cartulina negra y cuero de cabra (pedazo de cuero seco de 3x2 cm). Cada cartón o cartulina fue arreglado en forma de abanico y se le hicieron dos huecos. Cada tipo de soporte tuvo 10 réplicas. Al inicio de cada bioensayo, las hembras fueron pesadas antes y después de ofrecerles sangre de gallina (G. gallus) con el fin de calcular la cantidad de sangre ingerida por cada insecto. A los siete días, los huevos se sacaban y contaban, el frasco se lavaba y se cambiaba el soporte, de modo que cada hembra fue expuesta a todos los soportes con el fin de evitar la variación individual. Según esto, el bioensayo se repitió seis veces por cada soporte.
Evaluación de condiciones para el uso de ninfas-V estadio: Se realizó un ensayo para estandarizar condiciones de cría y el rango de pesos que permitiera el mejor aprovechamiento del número de ninfas-V, teniendo en cuenta el protocolo de la OMS15 y el modificado en el CINTROP-UIS por Reyes y Angulo16. Para esto se tomaron varios lotes de huevos de R. pallescens y los estadios ninfales se criaron desde ninfa-I hasta ninfa-V. Las condiciones de cría y uso de las ninfas-V fueron las siguientes: 1. Ninfas-V (alimentadas desde ninfa-I cada 15 días) alimentadas a los 7 días de ayuno y pesadas a los 7 días (protocolo tradicional). 2. Ninfas-V (alimentadas desde ninfa-I cada 8 días) pesadas a los 5 días de ayuno. 3. Ninfas-V (alimentadas desde ninfa-I cada 8 días) pesadas a los 6 días de ayuno. 4. Ninfas-V (alimentadas desde ninfa-I cada 15 días) pesadas a los 5 días de ayuno. 5. Ninfas-V (alimentadas desde ninfa-I cada 15 días) pesadas a los 6 días de ayuno.
Análisis estadísticos: Las comparaciones entre grupos se hicieron con las pruebas de Chi-cuadrado, ANOVA o Kruskall-Wallis y t o U-Mann-Whitney, según el caso, y el nivel de significancia fue de 95%.
RESULTADOS
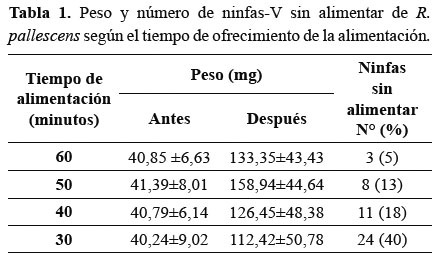
Estimación del tiempo de alimentación. Los resultados obtenidos en este ensayo se muestran en la Tabla 1. De acuerdo a estos, el tiempo de ofrecimiento que garantiza la alimentación del 95% de las ninfas es de 60 minutos, aunque con un tiempo de 50 minutos se logró la alimentación del 87% de las ninfas.
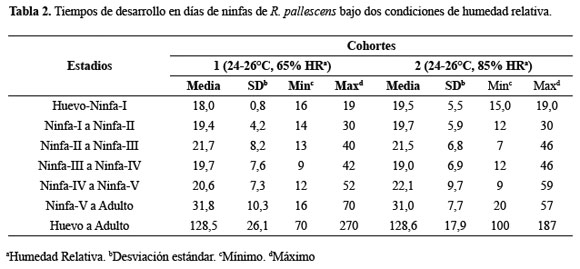
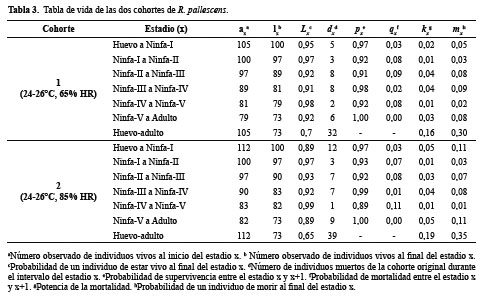
Estimación de tiempos de desarrollo ninfal: En la Tabla 2 se muestran los tiempos de desarrollo desde huevo hasta la terminación del estadio ninfa-V y en la Tabla 3 los valores de la tabla de vida presentado en las dos cohortes de R. pallescens sometidas a condiciones de humedad relativa diferentes. En general, no se observaron diferencias significativas entre las dos cohortes en la media del tiempo de desarrollo. El promedio de oviposición diario/hembra fue de 2,7 huevos. La duración promedio del ciclo de vida desde huevo hasta adulto en R. pallescens fue de 128,6 días, bajo las dos condiciones ambientales. El estadio ninfa-V fue el que presentó mayor duración del tiempo de desarrollo con un promedio de 31 días. Los estadios ninfa-II, III y IV tuvieron la mayor potencia y probabilidad de mortalidad de un individuo al final del estadio x, sin superar el valor de 0,11.
Comparación de la fecundidad usando dos fuentes de alimento: No se observaron diferencias significativas (p=0,8179) al comparar la postura de huevos obtenida con el grupo alimentado con gallina (2,30 huevos/ hembra/día) y el grupo alimentado con ratón (2,24 huevos/hembra/día). Tampoco se encontró relación entre la cantidad de sangre ingerida y el número de huevos puestos.
Comparación de la fecundidad usando diferentes soportes: En total se obtuvieron 6100 huevos de R. pallescens en el ensayo. El promedio de oviposición diario/hembra fue 2,7 ±0,29 huevos. Se encontraron diferencias significativas, entre los soportes 1 (Cartón-cartulina) (p=0,025), 2 (Cartón-Cartulina/Cartulina negra) (p=0,043) y 5 (Cartulina negra-Plumas). De acuerdo a estos resultados utilizar cartulina negra y plumas como soportes en los frascos de cría de esta especie, puede mejorar la fecundidad.
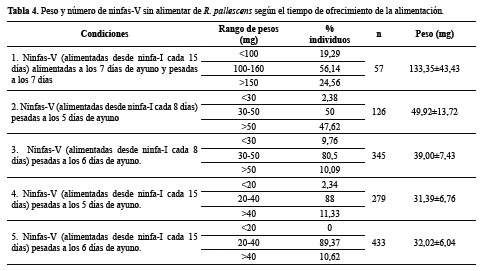
Condiciones para el uso de ninfas de V estadio: En la Tabla 4 se muestra la distribución de Ninfas-V obtenida en cada conjunto de condiciones y el rango de peso. Se observa que la condición número cinco permitiría utilizar el mayor número de ninfas (89%) en un rango de peso de 20 a 40 mg. Este tratamiento tiene como ventaja adicional sobre el protocolo tradicional (tratamiento 1) (p=0,0079), un menor esfuerzo y una disminución en el tiempo de espera para su uso en los bioensayos.
DISCUSIÓN
La biología de Rhodnius pallescens fue estudiada previamente bajo diferentes condiciones (temperatura, humedad relativa, luminosidad y fuente de alimento), encontrando que su ciclo de vida es mucho más corto cuando se alimenta en grupos sobre ratón, que individualmente sobre paloma; sin tener diferencias notables en las condiciones de temperatura y humedad utilizadas17. En este trabajo tampoco se observaron diferencias en los tiempos de desarrollo entre las dos condiciones ambientales evaluadas, sin embargo, su duración (128,5 días) fue similar a la obtenida en los individuos alimentados individualmente sobre ratón (126 días), aunque la probabilidad de estar vivo al final del estadio fue menor. Este comportamiento sugiere que se pueden lograr tiempos de desarrollo más cortos en R. pallescens que se alimenten con sangre de ave (gallina), posiblemente debido a que la frecuencia de alimentación fue semanal y no quincenal.
Las tasas de oviposición diaria de R. pallescens o comparaciones de estas, según la fuente de alimento ofrecida, no se reportan en los trabajos de esta especie8,17,18,19. Las tasas reportadas aquí (2,2 a 2,7 huevos/hembra/día), son similares a las obtenidas por Rhodnius neglectus, los cuales se alimentaron con gallina, o a las de T. infestans, Triatoma brasiliensis, Triatoma sórdida, Panstrongylus megistus y mucho menores que las reportadas para T. dimidiata20,21,22.
En cuanto al bioensayo para estimar el tiempo de ofrecimiento del alimento se ha reportado en otras especies del género Rhodnius que éstos demoran de 3 a 15 minutos en alimentarse a repleción sobre humano o en especies alimentadas sobre ratón como Rhodnius ecuadoriensis los intervalos pueden ser de 14 a 28 minutos23,24. Estas estimaciones de tiempo son de alimentaciones individuales donde no hay competencia por alcanzar el huésped y por tanto, tampoco tiene en cuenta la irritación del huésped, que puede darse por el número de insectos que estén picando. Según los resultados del ensayo realizado en este trabajo, el tiempo necesario para que la mayoría de los insectos de R. pallescens mantenidos en un frasco se alimenten sobre gallina puede ser de hasta una hora; sin embargo, otras evaluaciones son necesarias utilizando diferentes tamaños de frasco y otras densidades de insectos.
Por otro lado, al comparar la fecundidad usando diferentes soportes en el frasco de cría, que pretendía simular algunas características de los sitios que en su ambiente natural elegirían las hembras para la oviposición; se observaron diferencias significativas cuando se usó cartulina negra y plumas de gallina, respecto a los soportes de cartón-cartulina o la combinación de cartón-cartulina y cartulina negra. Este comportamiento, observado en el bioensayo similar realizado en R. prolixus14, es esperado en triatomínos asociados a aves, los cuales utilizan como estrategia de oviposición la postura de huevos pegados a las plumas de sus hospederos, sin embargo, en este caso el estímulo podría deberse a la utilización de una colonia de laboratorio alimentada por varios años sobre gallina.
Las condiciones para el uso de ninfas-V en los estudios de susceptibilidad a insecticidas fueron estandarizadas para R. prolixus y T. infestans15. La evaluación de otra especie de Triatominae, se hace con estos protocolos generalizando según el sexo, como en el caso de R. pallescens, en Panamá, donde Cáceres et al25 utilizaron el estandarizado para R. prolixus. El uso de este protocolo requiere de la espera de varios días (8-13 días) después de la emergencia de las ninfas-V, del esfuerzo de ofrecer alimento para la cual generalmente se usan animales vivos, como gallinas y ratones y esperar que el número necesario de ninfas, al ser pesadas, queden dentro del rango de peso recomendado. Por esta razón, se buscó establecer un protocolo de uso de ninfas-V, en este caso para R. pallescens, que permitiera el uso de la mayor cantidad de ninfas, con un menor tiempo de espera y de esfuerzo. El mejor aprovechamiento de ninfas se encontró con el protocolo cinco que evaluó ninfas alimentadas desde el estadio ninfa-I cada 15 días, y pesadas a los 6 días de ayuno. Los protocolos tres y cuatro también mostraron un buen aprovechamiento de las ninfas-V sobre el protocolo tradicional. La efectividad de los protocolos sugeridos para R. pallescens debe ser probada y comparada para su validación. Un protocolo similar de uso de ninfas-V en ayuno fue estandarizado y utilizado en T. dimidiata para probar el efecto tóxico de la β-cipermetrina, deltametrina y fenitrotión16,26.
Las causas de discrepancia entre lo resultados publicados por los diferentes autores pueden ser debidas a las diferencias climáticas entre insectarios, la dieta uniforme restringida a una sola fuente alimenticia (paloma, roedor, conejo o gallina), la manipulación de los insectos, la endogamia dada después de unas pocas generaciones en el laboratorio o a diferencias en las características biológicas de las poblaciones en las diferentes regiones geográficas; por lo que es necesario realizar estos estudios locales que proveen de un conocimiento básico de la duración del ciclo de vida, fecundidad, fertilidad y dinámica poblacional de las especies de Triatominae que pueda ser aplicado en los insectarios para su cría masiva, ya sea para evaluar la capacidad potencial de colonización, así como en estudios donde se requiere el uso de una gran cantidad de ninfas27.
AGRADECIMIENTOS
El presente trabajo se llevó a cabo en el grupo de investigación CINTROP de la Universidad Industrial de Santander gracias a la financiación de Colciencias-110249326216, la Universidad Industrial de Santander y el programa de Enfermedades Transmitidas por Vectores de la Secretaria Salud de Santander.
CONSIDERACIONES ÉTICAS
El presente trabajo hizo parte del proyecto "Evaluación de la susceptibilidad y o resistencia a insecticidas en triatomínos que hacen intrusión a la viviendas en Colombia" evaluado y avalado por el comité de ética para la investigación científica de la Facultad de Salud de la Universidad Industrial de Santander.
CONFLICTO DE INTERESES
Los autores declaran que no hay conflicto de intereses.
REFERENCIAS
1. Schmuñis G. Status of and cost of Chagas disease worldwide. The Lancet Infectious Dis. 2013;13(4): 283-4. [ Links ]
2. Abad-Franch F, Diotaiuti L, Gurgel-Gonçalves R, Gürtle RE. Certifying the interruption of Chagas disease transmission by native vectors: cui bono?. Mem Inst Oswaldo Cruz. 2013; 108(2): 251-254. [ Links ]
3. Moncayo A, Silveira AC. Current epidemiological trends for Chagas disease in Latin America and future challenges in epidemiology, surveillance and health policy. Mem Inst Oswaldo Cruz. 2009; 104(Suppl. I): 17-30. [ Links ]
4. OMS. Reporte sobre la enfermedad de Chagas. Segunda edición. Buenos Aires: Programa Especial de Investigaciones y Enseñanzas sobre Enfermedades Tropicales (TDR); 2007. [ Links ]
5. Zeledón R, Morales JA, Myriam S, Torres J, Alfaro S, Gutiérrez H, et al. The finding of Rhodnius pallescens Barber, 1932 (Reduviidae: Triatominae) in palm trees (Attalea butyracea) in north Costa Rica. Bol. Mal. Salud Amb. 2006; 46(1): 15-20. [ Links ]
6. OPS. Taller Técnico de Estudio sobre Rhodnius pallescens, su Vigilancia y Control. Panamá: Organización Panamericana de la Salud; 2002. [ Links ]
7. Lent H, Wygodzinsky P. Revision of the Triatominae (Hemiptera, Reduviidae), and their significance as vectors of Chagas disease. Bull Am Mus Nat Hist. 1979; 163(3): 123-520. [ Links ]
8. Jaramillo N, Schofield CJ, Gorla D, Caro-Riaño H, Moreno JEM, Dujardin JP. The Role of Rhodnius pallescens as a vector of Chagas disease in Colombia and Panama. Res Rev Parasitol. 2000; 60(3-4): 75-82. [ Links ]
9. Zambrano P, Cucunubá Z, Montilla M, Flórez A, Parra E, Ramírez A, et al. Brotes de Síndrome Febril Asociado a Miocarditis Aguda Chagásica de Posible Transmisión Oral en el Departamento de Santander, Colombia, diciembre de 2008 a mayo de 2009. IQEN. 2010. 15: 17-6. [ Links ]
10. Reyes M, Flórez M, Angulo VM. Actividad insecticida de la deltametrina en una población de Rhodnius pallescens de la zona urbana de San Vicente de Chucurí, Santander, Colombia. II International Workshop on Chagas Disease, triatomine vectors, Trypanosoma cruzi and Triatoma virus. Cochabamba; 2012. p. 87. [ Links ]
11. Picollo MI, Vassena C, Orihuela PS, Barrios S, Zaidemberg M, Zerba E. High Resistance to Pyrethroid Insecticides Associated with Ineffective Field Treatments in Triatoma infestans (Hemiptera:Reduviidae) from Northern Argentina. J Med Entomol. 2005; 42(4): 637-42. [ Links ]
12. Vassena CV, Picollo MI, Zerba EN. Insecticide resistance in Brazilian Triatoma infestans and Venezuelan Rhodnius prolixus. Med Vet Entomol. 2000; 14(1): 51-5. [ Links ]
13. Zerba EN. Susceptibilty and resistance to insecticides of Chagas disease vectors. Medicina. 1999; 59(Supl. II): 41-46. [ Links ]
14. Schilman PE, Nuñez JA, Lazzari CR. Attributes of Oviposition Substrates Affect Fecundity in Rhodnius prolixus. J Insect Physiol. 1996; 42(9): 837-841. [ Links ]
15. CIPEIN/CONICET. Protocolo de evaluación de efecto insecticida en Rhodnius prolixus. En: Red Latinoamericana de control de triatomínos (RELCOT), eds. Monitoreo de la resistencia a insecticidas en triatomínos en América Latina. Serie: Enfermedades transmisibles. Buenos Aires, Argentina: Fundación Mundo Sano; 2001: p. 61. [ Links ]
16. Reyes M, Angulo VM. Ciclo de vida de Triatoma dimidiata Latreille, 1811 (Hemiptera, Reduviidae) en condiciones de laboratorio: producción de ninfas para ensayos biológicos. Biomédica 2009; 29(1): 119-126. [ Links ]
17. Jurberg J, Rangel E. Ciclo biológico de Rhodnius pallescens Barber, 1932 (Hemiptera, Reduviidae, Triatominae) en laboratório. Mem Inst Oswaldo Cruz. 1984; 79(3): 303-308. [ Links ]
18. Borgerth S, Rocha D, Galvao C, Cunha V, Jurberg J, Carcavallo R. Populational dynamics of Rhodnius pallescens Barber, 1932 under laboratory conditions (Hemiptera, Reduviidae, Triatominae). Mem Inst Oswaldo Cruz. 1999; 94(Suppl. II): 243. [ Links ]
19. Moreno-Mejia J, Valencia F, Jaramillo N, Lages- Silva E, Ramirez L. Biological cycle of Rhodnius pallescens in laboratory conditions. Mem Inst Oswaldo Cruz. 1992; 87(Suppl. II): 217. [ Links ]
20. Rabinovich JE, Nieves EL. Vital Statistics of Triatominae (Hemiptera: Reduviidae) Under Laboratory Conditions: III. Rhodnius neglectus. J Med Entomol. 2011; 48(4): 775-787. [ Links ]
21. Reyes-Novelo E, Ruiz-Piña H, Escobedo-Ortegón J, Barrera-Pérez MA. Biología y ecología de Triatoma dimidiata (Latreille, 1811), algunos aspectos de estudio. Dugesiana 2011; 18(1): 11-6. [ Links ]
22. Perlowagora-Szumlewicz AP. Laboratory colonies of Triatominae, biology and population dynamics. PAHO/WHO Sci Publ. 1975; 318: 63-82. [ Links ]
23. Villacís AG, Arcos-Terán L, Grijalva MJ. Life cycle, feeding and defecation patterns of Rhodnius ecuadoriensis (Lent & León 1958) (Hemiptera: Reduviidae: Triatominae) under laboratory conditions. Mem Inst Oswaldo Cruz. 2008; 103(7): 690-5. [ Links ]
24. Aldana E, Lizano E, Valderrama MRA. Alimentación y defecación en triatomínos del género Rhodnius (Hemiptera: Reduviidae) alimentados con sangre humana. Rev Biol Trop. 2001; 49(2): 693-695. [ Links ]
25. Cáceres L, Rovira JR, Calzada J, Saldaña A. Evaluación de la actividad tóxica de los insecticidas piretroides deltametrina y lambdacihalotrina en dos poblaciones de campo de Rhodnius pallescens (Hemíptera: Reduviidae) de Panamá. Biomédica. 2011; 31: 8-14. [ Links ]
26. Reyes M, Angulo VM, Sandoval CM. Efecto tóxico de β -cipermetrina, deltametrina y fenitrotión en cepas de Triatoma dimidiata (Latreille, 1811) y Triatoma maculata (Erichson, 1848) (Hemiptera, Reduviidae). Biomédica. 2007; 27(Suppl 1): 75-82. [ Links ]
27. Canale D, et al. Bionomics of some species. En: Carcavallo R. Atlas of Chagas´ Disease Vectors in the Americas. Rio de Janeiro: Fiocruz; 1999. p. 839-890. [ Links ]