Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807
Rev. Univ. Ind. Santander. Salud vol.47 no.2 Bucaramanga May/Aug. 2015
Actividad enzimática colinesterasa en
muestras de sangre humana: efecto de
las condiciones de almacenamiento
Olga M Medina P1, Luz H Sánchez R1, Oscar Flórez-Vargas1
1. Universidad Industrial de Santander. Bucaramanga, Colombia
Correspondencia: Oscar Flórez-V. Dirección: Facultad de Salud, Universidad Industrial de Santander, Cra. 32 29-31, piso 5 Of. 5.
Correo electrónico: o.florezvargas@gmail.com. Teléfono: +57 7 634 4000 Ext. 3135
Recibido: Abril 19 de 2014 Aprobado: Enero 26 de 2015
Forma de citar: Medina OM, Sánchez LH, Flórez-Vargas O. Actividad enzimática colinesterasa en muestras de sangre humana: efecto de las condiciones de almacenamiento. Rev Univ Ind Santander Salud. 2015; 47(2): 151-158.
RESUMEN
Introducción: La determinación de la actividad enzimática colinesterasa (ChE) es el principal biomarcador de efecto de la exposición a los plaguicidas organofosforados y carbamatos. Por lo tanto, la estabilidad de la actividad de las ChEs en muestras de sangre es un parámetro pre-analítico importante que necesita ser considerado en términos de la seguridad diagnóstica. Objetivo: Determinar el efecto del tiempo y de la temperatura de almacenamiento sobre la actividad de las ChEs en muestras de sangre humana. Metodología: Muestras de sangre entera y suspensiones de eritrocitos (eritrocitos + solución salina 0.9% proporción 1:1) fueron almacenados a -20°C, 4°C y 25°C. Las determinaciones enzimáticas se realizaron una hora después de la toma de la muestra y se repitieron entre el día 1 hasta el día 90. La actividad enzimática ChE total y Acetil-ChE se determinaron respectivamente mediante el método colorimétrico de Limperos & Ranta y mediante el método potenciométrico de Michel. Resultados: La máxima estabilidad de la actividad ChE total se observó a -20°C hasta por 60 días, además, dicha estabilidad perduró hasta por el tiempo máximo del estudio a 4°C para la Acetil-ChE. Una considerable disminución de la actividad Acetil-ChE se observó después de los días 7 a 25°C y 4 a -20°C. Conclusión: Considerando la seguridad diagnóstica, nosotros recomendamos almacenar las muestras de sangre entera a -20°C por un tiempo máximo de 30 días para la determinación de la actividad ChE total y la suspensión de eritrocitos en 0.9% de NaCl a 4°C por 14 días máximo para la determinación de la Acetil-ChE.
Palabras clave: Colinesterasas; Plaguicidas; Sangre; Estabilidad enzimática.
Cholinesterase enzyme activity in human blood
samples: effects of the store conditions
ABSTRACT
Introduction: Determination of cholinesterase (ChE) enzyme activity is the main biomarker of exposure to pesticides organophosphorus and carbamate. Therefore, the enzyme stability of ChEsin blood samples is an important pre-analytical factor to take into account in the diagnosis. Objective: To determine the effect of storage time and temperature on ChEs enzyme activity in human blood samples. Methodology: Whole-blood samples and erythrocyte suspensions (erythrocyte + 0.9% saline solution; ratio 1:1) were stored at -20°C, 4°C and 25°C. Enzyme activity measurements were performed at one hour after the blood samples have been obtained and then were repeated between days 1 and 90. Total ChE and Acetyl-ChE activities were determined using the Limperos & Ranta colorimetric method and the potentiometric method of Michel respectively. Results: The maximum stability of the total ChE enzyme activity was achieved at -20°C for 60 days and, in the case of Acetyl-ChE, at 4°C for the time the study was conducted. A decrease of Acetyl-ChE activity was shown after 7 days at 25°C and 4 days at -20°C. Conclusion: In terms of diagnosis, we recommend that in order to measure the total ChE activity the wholeblood samples should be stored at -20°C for 30 days, whereas to measure the Acetyl-ChE activity the erythrocyte suspensions in 0.9% NaCl at 4°C for 14 days.
Keywords: Cholinesterases; Pesticides; Blood; Enzyme stability.
INTRODUCCIÓN
Las colinesterasas (ChEs) son enzimas que catalizan la hidrólisis de los ésteres de colina. En humanos y otros mamíferos se distinguen principalmente dos tipos de ChE: acetilcolinesterasa (AChE; EC 3.1.1.7) y butirilcolinesterasa (BChE; EC 3.1.1.8). Estas enzimas se localizan diferencialmente en los tejidos y cumplen importantes funciones fisiológicas; entre estas, la hidrólisis del neurotransmisor acetilcolina en colina y ácido acético en el espacio sináptico. Considerada como la más relevante de ellas porque permite a la neurona colinérgica retornar a su estado de reposo después de la activación; evitando así una sobre-estimulación efectora de los músculos y como consecuencia espasmos musculares que pueden causar la muerte.
La actividad de las ChEs puede ser afectada de manera reversible e irreversible por compuestos químicos que actúan sobre estas enzimas como inhibidores de tipo competitivo o no competitivo. Entre ellos, los plaguicidas, especialmente los organofosforados y carbamatos, se constituyen como los más comunes anticolinesterásicos porque son ampliamente utilizados: en la agricultura para el control de plagas o en los hogares sobre los animales domésticos y/o en los jardines para la eliminación de ectoparásitos e insectos1,2. Sin embargo, y aunque se usen de forma correcta, estos compuestos representan costos sociales, ya que producen efectos nocivos -agudos y crónicos- tanto para la salud humana como para el medio ambiente.
Además cabe mencionar que por su bajo costo en países en desarrollo éstos productos químicos son de fácil acceso3, lo que en parte explica hasta un millón de casos de intoxicación y hasta 20.000 muertes anualmente4. En Colombia, según el Sistema de Vigilancia en Salud Pública (SIVIGILA) en 2008 se reportaron 6.650 intoxicaciones por plaguicidas; 7.405 en 2009; 8.016 en 2010; 9.811 en 2011; y 9.197 en 2012. Constituyéndose como el principal tipo de intoxicación entre las sustancias químicas a diferencia de los países desarrollados, donde el mayor porcentaje de las intoxicaciones son a causa de los medicamentos5.
Debido al efecto directo de los plaguicidas sobre la actividad de las ChEs, la determinación de esta actividad enzimática se ha utilizado no solo como la principal prueba de laboratorio para la vigilancia de la población laboralmente expuesta a los plaguicidas organofosforados y carbamatos6,7, sino también como el principal biomarcador de efecto de estos plaguicidas8-10. Esto es, al menos en parte, porque no se cuenta con un biomarcador de exposición que pueda ser determinado en sangre debido a que estos compuestos son rápidamente hidrolizados, y además a que el valor diagnóstico de su determinación en orina es limitado porque no evalúa la magnitud de la exposición. En este sentido, para la exposición prolongada y a bajas dosis se recomienda medir la actividad AChE, mientras que para la exposición aguda se prefiere la medición de la actividad BChE11.
Existen varios métodos para la medición de la actividad de las ChEs; entre ellos, el método de Michel12 y el método de Limperos & Ranta13 (modificado por Edson14) son los dos más utilizados. El primero se ha consolidado como la prueba de referencia para medir la actividad AChE, mientras que el segundo, por ser un método de diagnóstico rápido y de campo, es frecuentemente utilizado en emergencias médicas así como también en la determinación de la actividad de las ChEs de rutina.
La estabilidad de la actividad de las ChEs en muestras de sangre es un parámetro pre-analítico importante y el cual necesita ser considerado en términos de la seguridad diagnóstica, especialmente en países como Colombia, debido a que en América Latina, Colombia ocupa el tercer lugar, después de Brasil y México, en el consumo de plaguicidas15,16. Factores como el tiempo y la temperatura de almacenamiento desde el momento en que se toma la muestra hasta que se lleva a cabo el procedimiento de laboratorio no están estandarizados, y estos afectan considerablemente la estabilidad de las enzimas. Las variaciones en estos factores se relacionan, por una parte, con el hecho de que generalmente las muestras se toman en áreas distantes del lugar de procesamiento y, por otra parte, a conflictos de costo-beneficio de los laboratorios, lo que implica que las muestras deban almacenarse por un determinado tiempo para ser analizadas.
Adicionalmente, estudios similares se han realizado en muestras de sangre de animales y han encontrado diferencias en la estabilidad enzimática dependiendo de la especie animal. Sin embargo, no se han reportado los efectos de estas variables pre-analíticas en muestras de sangre humana. Por lo tanto, el objetivo de este estudio fue evaluar el efecto del tiempo y de la temperatura de almacenamiento sobre la actividad de las ChEs en muestras de sangre humana.
MATERIALES Y MÉTODOS
Obtención y preparación de las muestras
Un total de cinco personas sanas aceptaron participar voluntariamente en el estudio, previo consentimiento informado. Los criterios de inclusión fueron: no tener diagnóstico clínico de obesidad, no estar en condición clínica de desnutrición, anemia, hepatitis, diabetes o alguna enfermedad de la tiroides, no haber estado expuesto a plaguicidas organofosforados o carbamatos en el último mes y no haber ingerido licor 72 horas antes de la toma de la muestra sanguínea. Con el fin de comprobar el cumplimiento de los requisitos para aplicar al estudio, a los participantes se les hizo una encuesta de carácter clínico y adicionalmente se les midieron variables como peso y talla y se les realizaron pruebas de función hepática (transaminasas), prueba de albúmina para verificar estado nutricional y hemoglobina para descartar anemia. Después de verificar el cumplimiento de los criterios de inclusión se realizó la flebotomía para obtener muestras de sangre en tubos con anticoagulante heparina.
Para la determinación de la actividad ChE total (AChE y BChE), las muestras de sangre se homogenizaron suavemente por inversión y se alicuotaron en volúmenes de a 30 μL en tubos de reacción de 0.5mL. En el caso de la determinación de la actividad AChE, las muestras de sangre se centrifugaron a 2000 rpm durante 15 minutos. Después de descartar el plasma, el paquete globular fue alicuotado en volúmenes de a 200 μL en tubos de reacción de 1.5 mL y lavado dos veces con 400 μL de una solución fresca de NaCl 0.9% centrifugando cada vez a 2500 rpm por 20 minutos. Al final del segundo lavado se descartaron 200 μL del sobrenadante para generar una suspensión de eritrocitos al 50% v/v como se especifica en el protocolo descrito por Michel12. Finalmente, los tubos de reacción que contenían las alícuotas de la sangre entera y la suspensión de eritrocitos fueron almacenados a -20°C, 4°C y 25°C en grupos de a tres por cada temperatura.
La actividad enzimática ChE total y AChE se determinó una hora después de la toma de la muestra de sangre (muestras control) y los análisis se repitieron en las preparaciones almacenadas a las diferentes temperaturas después de 24, 48, 72, 96 y 120 horas, así como también a la primera, segunda y tercera semana, y el primer, segundo y tercer mes. Todas las determinaciones se realizaron por triplicado.
Por otra parte, y para evaluar el efecto del congelamiento y descongelamiento sucesivo de las muestras de sangre, por cada muestra se alicuotaron de manera independiente 150 μL de sangre entera y 450 μL de la suspensión de eritrocitos al 50% v/v en tubos de reacción de 1.5 mL. Después de determinar la actividad enzimática, las muestras se almacenaron a -20°C. Una vez al día durante cinco días consecutivos se realizó el descongelamiento de las muestras a temperatura ambiente durante 15 minutos, después se midió la actividad enzimática ChE total y AChE y por último se congelaron nuevamente para el día siguiente.
Determinación de la actividad enzimática
Actividad enzimática ChE total
La determinación de la actividad ChE total se realizó por el método colorimétrico de Limperos & Ranta modificado por Edson13,14 utilizando el equipo Lovibond® ComparatorSystem 2000+ (TintometerGmbH; Alemania). En tubos de reacción de 1.5 mL, 10 μL de sangre entera fueron adicionados a 500 μL de azul de bromotimol 0.0448% pH 7.20, se mezclaron y se adicionaron 500 μL de perclorato de acetilcolina 0.5%. Inmediatamente, la mezcla se homogenizó por agitación y se transfirió a una celda de cuarzo de 2.5 mm. El cambio de pH debido al ácido acético, producto de la hidrólisis de la acetilcolina por acción de las ChEs se midió al comparar el color de la mezcla con el conjunto de patrones de vidrio coloreados incluidos en el Comparador 2000 y expresados como porcentaje de actividad enzimática. El tiempo de reacción se fijó en 21 minutos: tiempo necesario para hacer virar el azul de bromotimol de verde a amarillo (~pH 6.0), correspondiente al 100% de la actividad de las ChEs. Este tiempo se determinó como el promedio del tiempo utilizado para el mismo fin en 10 muestras de sangre de personas sanas. Controles negativos (se remplazó el perclorato de acetil colina por agua) y positivos (muestras de sangre con 100% de actividad en 21 minutos) fueron utilizados cada vez que se realizaba la prueba.
Actividad enzimática AChE
La determinación de la actividad enzimática de la AChE se realizó por el método potenciométrico de Michel12. En tubos de reacción de 15 mL se lisaron 80 μL de la suspensión de eritrocitos (eritrocitos + solución salina 0.9% proporción 1:1) con 1.92 mL de saponina 0.01%. La lectura del pH inicial se determinó 10 minutos después de mezclar 1 mL del hemolizado con 1 mL de la solución buffer (0.02 M de barbital sódico, 0.004 M de KH2PO4 y 0.6 M de KCl) pH 8.10 a 25°C. Posteriormente se adicionaron 200 μL del sustrato acetilcolina 0.11 M e inmediatamente se incubaron a 25°C por 60 minutos. Transcurrido este tiempo se realizó la lectura del pH final. Todas las lecturas del pH se realizaron por duplicado utilizando pH metro SevenEasy™ (Mettler-Toledo International Inc.; Estados Unidos de América).
La actividad enzimática se expresó como ΔpH/hora mediante la siguiente ecuación:
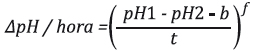
Donde pH1 y pH2 corresponden a los valores del pH inicial y final, respectivamente; t al tiempo de reacción (1 hora); b es el valor de corrección debida a la hidrólisis no enzimática y f es el valor de la variación en el ΔpH/hora. Esta ecuación y la tabla de valores b y ƒ con respecto al pH2 fue publicada por Michel et al12.
Análisis estadístico
El efecto del tiempo y la temperatura de almacenamiento, así como la interacción de estas variables sobre la actividad de las ChEs en muestras de sangre humana fue determinado mediante un análisis de rangos signados de Wilcoxon para datos pareados, comparando en todos los casos con el tiempo inicial (tiempo 0); tiempo que identifica el procesamiento de las muestras de sangre frescas minutos después de la flebotomía. Un valor p< 0.05 para una prueba de una cola fue considerado estadísticamente significativo utilizando el software GraphPad Prism versión 6.04. Por otra parte, un análisis de concordancia entre los resultados obtenidos de las diferentes condiciones de almacenamiento fue realizado mediante el método de Bland & Altman17 utilizando el software MedCal versión 13.1.0.0.
RESULTADOS
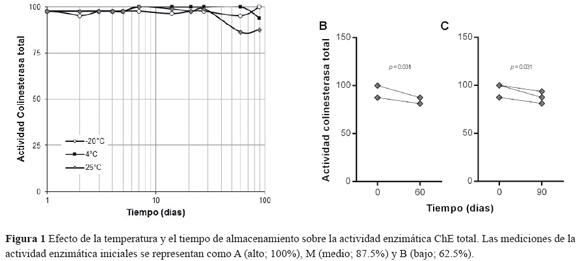
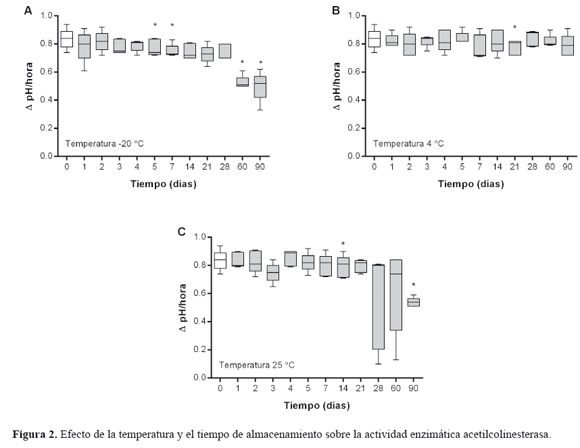
Las variaciones en la actividad enzimática de la ChE total y la AChE se muestran en la Figuras 1 y 2. La mediana y la desviación estándar de la actividad ChE total y AChE en muestras de sangre fresca fue 100 ± 5.59% (rango = 87.5 - 100%) y 0.84 ± 0.07 ΔpH/hora (rango 0.74 - 0.94 ΔpH/hora), respectivamente. No se observaron cambios estadísticamente significativos durante el almacenamiento a -20°C y 4°C para la actividad enzimática ChE; sin embargo a 25°C se observaron cambios significativos a los 60 y 90 días de almacenamiento (Figura 1). En el caso de la actividad AChE la mayor variación se observó en las muestras almacenadas a -20°C y 25°C; las cuales mostraron diferencias estadísticamente significativas (p< 0.05) después de las 120 horas y a 14 días, respectivamente (Figura 2A y 2C). La menor variación se presentó cuando las muestras de sangre fueron almacenadas a 4°C; la cual se mantuvo relativamente estable hasta por el tiempo evaluado en el estudio (Figura 2B).
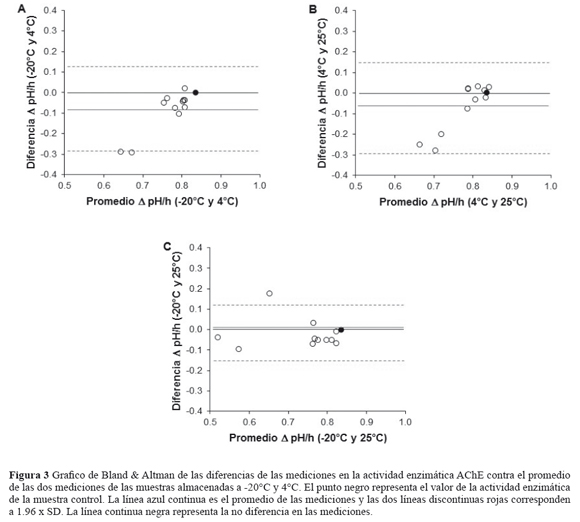
El análisis de concordancia mostró un mayor número de puntos por debajo de la línea de no diferencia y una mayor dispersión de los mismos cuando se compararon los valores de la actividad AChE de las suspensiones de eritrocitos almacenadas a -20°C y 25°C, seguido de 4°C y 25°C, y -20°C y 4°C (Figura 3). Las mediciones de la actividad AChE se reducen respectivamente por un promedio de 0.08 (DS = 0.20) y 0.06 (DS = 0.23) ΔpH/ hora cuando las muestras son almacenadas a -20°C y 25°C como se indica por la línea continua azul en el gráfico de Bland & Altman(Figura 3A y 3B).
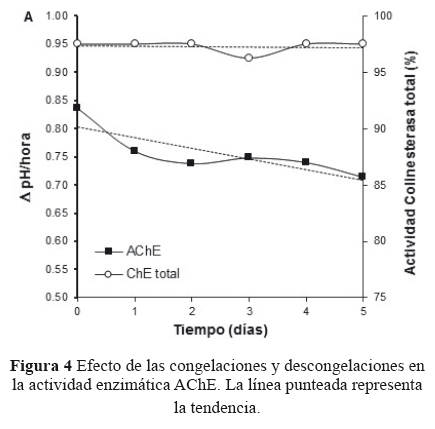
No se observaron diferencias estadísticamente significativas en las mediciones de la actividad ChE total y AChE después de las 5 congelaciones y descongelaciones sucesivas. Sin embargo, a diferencia de las mediciones de la actividad ChE total, las mediciones de la actividad AChE mostraron una disminución gradual de sus valores: desde 0.84 ± 0.07 hasta 0.71 ± 0.05 ΔpH/hora (Figura 4).
DISCUSIÓN
Los resultados mostraron que el método de almacenamiento afecta significativamente la actividad ChE. Para la determinación de la actividad ChE total por el método de Limperos & Ranta modificado por Edson las muestras de sangre entera se pueden almacenar hasta por 28 días a -20°C, 4°C y 25°C; o hasta por 60 días a -20°C y 4°C (Figura 1). Tiempos prolongados de almacenamiento generan oscilaciones significativas en las mediciones de esta actividad enzimática y, como consecuencia, diagnósticos con resultados falsos positivos o negativos y con las implicaciones clínicas correspondientes.
Las mediciones de la actividad AChE presentaron una mayor sensibilidad a las condiciones de almacenamiento, especialmente cuando las suspensiones de eritrocitos fueron almacenadas a -20°C y 25°C (Figura 2A y 2C). De hecho, el análisis de concordancia mostró que estos valores no solo son más dispersos sino que una gran parte de ellos están alejados de la línea de no diferencia (Figura 3C). Por otra parte, cuando se evaluó la concordancia entre estas dos temperaturas, en la temperatura de 4°C se observó un mayor agrupamiento de los datos alrededor de la línea de no diferencia (Figura 3A y 3B); lo que indica que estos valores podrían ser comparables. Sin embargo, los valores dispersos (Figura 3B) y por fuera de los límites de acuerdo (Figura 3A) indican que las mediciones de la actividad AChE son más bajas cuando las muestras se almacenan a -20°C y 25°C que a 4°C. Por lo tanto, esta evidencia experimental sugiere que la temperatura de refrigeración conserva mejor la actividad AChE en función del tiempo.
La disminución en la actividad enzimática cuando las muestras son almacenadas a -20°C se puede deber a una potencial desnaturalización de la enzima por una significativa reducción del pH dada por la concentración de NaCl durante el proceso de congelamiento y descongelamiento18. La fuente de NaCl en nuestros experimentos provino de la solución salina fisiológica al 0.9 % que se utilizó para preparar la suspensión de eritrocitos. En este sentido, esto también podría explicar, al menos en parte, la tendencia a la disminución observada en las mediciones de la actividad AChE en el tiempo durante las congelaciones y descongelaciones sucesivas (Figura 4).
Es importante tener en cuenta que para la determinación de la actividad AChE mediante el método de Michel12 no se pueden almacenar las muestras de sangre entera a -20°C porque la formación de cristales lisaría los eritrocitos y la enzima libre se eliminaría posteriormente durante los pasos de lavado; por esta razón el almacenamiento de las muestras en las diferentes temperaturas se realizó después de lavar los eritrocitos con solución salina fisiológica. Sin embargo, y aunque la temperatura de refrigeración no tiene un fuerte impacto en la formación de cristales y por lo tanto en la hemólisis, nuestros resultados no pueden ser extendidos al almacenamiento de las muestras de sangre entera a 4°C para determinar la actividad AChE por el método de Michel porque esta opción no fue investigada en nuestro estudio.
Existe evidencia experimental que muestra que la estabilidad de la actividad enzimática de las ChEs no sólo depende de las condiciones de almacenamiento, sino también de la especie animal de la cual proviene. Por ejemplo, la actividad enzimática en muestras de sangre entera de perro y oveja se mantuvieron estables por más tiempo (un mes y dos semanas, respectivamente) cuando se almacenaron a -20°C que a 4°C o 25°C, mientras que las muestras de sangre entera de caballo fueron estables hasta por seis meses cuando se almacenaron a 4°C y por dos semanas a -20°C y 25°C19. Adicionalmente, otros estudios reportaron una estabilidad de las muestras de sangre de caballo a 4°C entre una semana20 y aproximadamente 8 meses21.
En conclusión, y teniendo en cuenta la seguridad diagnóstica, nosotros recomendamos, por una parte, almacenar las muestras de sangre entera a -20°C por un tiempo máximo de 30 días para la determinación de la actividad ChE total y, por otra parte, para evitar una pérdida estadísticamente significativa de la actividad enzimática AChE, la suspensión de eritrocitos en 0.9% de NaCl se debería conservar a 4°C como máximo por 14 días.
AGRADECIMIENTOS
Este trabajo se desarrolló en el marco del proyecto de investigación 5670 financiado por la Vicerrectoría de Investigación y Extensión de la Universidad Industrial de Santander. A la MSc Marien Villamil Preciado por la revisión crítica del texto, ideas y sugerencias.
CONSIDERACIONES ÉTICAS
El Comité de Ética de la Universidad Industrial de Santander aprobó el protocolo de investigación.
CONFLICTO DE INTERÉS
Los autores declaran que no tienen conflictos de interés relacionados con los contenidos de este artículo.
REFERENCIAS
1. Barr DB. Biomonitoring of exposure to pesticides. J Chem Health Safety. 2008; 15: 20-29. [ Links ]
2. Idrovo AJ. Vigilancia de las Intoxicaciones con Plaguicidas en Colombia. Rev Salud Pública. 2000; 2: 36-46. [ Links ]
3. Issa Y, Sham'a FA, Nijem K, Bjertness E, Kristensen P. Pesticide use and opportunities of exposure among farmers and their families: cross-sectional studies 1998-2006 from Hebron governorate, occupied Palestinian territory. Environ Health. 2010; 9: 63. [ Links ]
4. Durán-Nah JJ, Collí-Quintal J. Intoxicación aguda por plaguicidas. Salud Pública Mex. 2000; 42: 53-55. [ Links ]
5. Subdirección de Vigilancia y Control en Salud Pública (SIVIGILA). Informe de Intoxicaciones por plaguicidas. Instituto Nacional de Salud, INS. Bogotá, Colombia. 2012. [ Links ]
6. Carlock LL, Chen WL, Gordon EB, Killeen JC, Manley A, Meyer LS, et al. Regulating and assessing risks of cholinesterase-inhibiting pesticides: divergent approaches and interpretations. J Toxicol Environ Health B Crit Rev. 1999; 2: 105-160. [ Links ]
7. Carmona-Fonseca J. Levels of plasma cholinesterase in Colombian working-class populations. Biomedica. 2003; 23: 437-455. [ Links ]
8. Maroni M, Jarvisalo J and la Ferla F. The WHOUNDP epidemiological study on the health effects of exposure to organophosphorus pesticides. Toxicol Lett. 1986; 33: 115-123. [ Links ]
9. Cárdenas O, Silva E, Morales L, Ortiz J. Estudio epidemiológico de exposición a plaguicidas organofosforados y carbamatos en siete departamentos colombianos, 1998-2001. Biomedica 2005; 25: 170-180. [ Links ]
10. Hernandez A, Gomez MA, Pena G, Gil F, Rodrigo L, Villanueva E, et al. Effect of long-term exposure to pesticides on plasma esterases from plastic greenhouse workers. J Toxicol Environ Health A. 2004; 67: 1095-1108. [ Links ]
11. Magnotti RA Jr, Dowling K, Eberly JP, McConnell RS. Field measurement of plasma and erythrocyte cholinesterases. Clin Chim Acta. 1988; 176: 315-332. [ Links ]
12. Michel HO. An Electrometric Method for the Determination of Red Blood Cell and Plasma Cholinesterase Activity. J Lab Clin Med. 1949; 34: 1564-1568. [ Links ]
13. Limperos G, Ranta KE. A Rapid Screening Test for the Determination of the Approximate Cholinesterase Activity of Human Blood. Science. 1953; 117: 453- 455. [ Links ]
14. Edson EF, Fenwick ML. Measurement of Cholinesterase Activity of Whole Blood. Brit Med J. 1955; 1: 1218. [ Links ]
15. Silva E, Morales L, Ortiz J. Evaluación epidemiológica de plaguicidas inhibidores de acetilcolinesterasa en Colombia, 1996-1997. Biomedica. 2000; 20: 200- 209. [ Links ]
16. Varona ME, Tolosa JE, Cardenas O, Torres CH, Pardo D, Carrasquilla G, et al. Pesticides use by flower companies associated with the Colombian Association of Flower Exporters. Biomedica. 2005; 25: 377-389. [ Links ]
17. Bland JM, Altman DG. Measuring agreement in method comparison studies. Stat Methods Med Res. 1999; 8: 135-160. [ Links ]
18. Pikal-Cleland KA, Rodriguez-Hornedo N, Amidon GL, Carpenter JF. Protein denaturation during freezing and thawing in phosphate buffer systems: Monomeric and tetrameric beta-galactosidase. Arch Biochem Biophys. 2000; 384: 398-406. [ Links ]
19. Tecles F, Gutiérrez C, Cerón JJ. Estabilidad de la actividad colinesterasa en muestras de sangre entera de distintas especies animales sometidas a diferentes condiciones de almacenamiento. Anal Vet. 2002; 18: 33-41. [ Links ]
20. Plumlee KH, Richardson ER, Gardner IA, Galey FD. Effect of time and storage temperature on cholinesterase activity in blood from normal and organophosphorus insecticide-treated horses. J Vet Diagn Invest. 1994; 6: 247-249. [ Links ]
21. Halbrook RS, Shugart LR, Watson AP, Munro NB, Linnabary RD. Characterizing Biological Variability in Livestock Blood Cholinesterase Activity for Biomonitoring Organophosphate Nerve Agent Exposure. J Am Vet Med Assoc. 1992; 201: 714-725. [ Links ]