Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Universidad Industrial de Santander. Salud
Print version ISSN 0121-0807
Rev. Univ. Ind. Santander. Salud vol.48 no.2 Bucaramanga Apr./June 2016
https://doi.org/10.18273/revsal.v48n2-2016010
DOI: http://dx.doi.org/10.18273/revsal.v48n2-2016010
Consentimiento Informado para
Biobancos: Un debate ético abierto
Norma Serrano-Díaz1,2,3, Elizabeth Guío-Mahecha1, María C. Páez-Leal2
1. Fundación Cardiovascular de Colombia FCV. Floridablanca, Colombia.
2. Universidad Autónoma de Bucaramanga UNAB. Bucaramanga, Colombia.
3. Universidad de Cuyo. Argentina
Correspondencia: Norma C. Serrano Díaz. Dirección: Calle 155A No. 23-58. Correo electrónico: normaserrano@fcv.org.
Teléfono: (7) 6396767 Ext: 214, Móvil: 310-2740099.
Recibido: enero 21 de 2016 Aprobado: marzo 1 de 2016
Forma de citar: Serrano-Díaz N, Guío-Mahecha E, Páez-Leal MC. Consentimiento informado para Biobancos: Un debate abierto. Rev Univ Ind Santander Salud. 2016; 48(2): 246-256.
RESUMEN
Los Biobancos con fines de Investigación están aumentando en número e importancia, con un gran potencial que contribuye a la generación de conocimiento pertinente para la solución de problemas en salud. El reclutamiento de donantes es vital para su éxito. Sin embargo, este proceso tiene implicaciones importantes de carácter ético, legal y social. El consentimiento informado requerido para la participación del donante impone desafíos éticos importantes en torno a la privacidad, confidencialidad, uso secundario de muestras y datos para estudios futuros, retorno de resultados, intercambio de datos, distribución de beneficios entre otras. Diferentes modelos de consentimiento informado han sido propuestos para responder a algunos de estos retos éticos . Sin embargo, no se ha llegado a un acuerdo, por lo tanto la discusión continúa abierta. Este trabajo pretende contribuir con la discusión, considerando fundamental el significado y el valor del proceso de consentimiento informado para la participación en investigación biomédica. Se discuten los diferentes tipos de consentimiento que se están utilizando actualmente evaluando el nivel de control y autodeterminación por parte del donante.
Palabras clave: Consentimiento Informado, Biobanco.
Informed Consent for Biobanks: An open ethical debate
ABSTRACT
Biobanks with Research purposes are increasing in number and importance, with great potential that contributes to the generation of knowledge relevant to solving health problems. For the Biobanks to be successful, donor recruitment is essential. However, this process has important ethical, legal and social implications. Informed consent required for the participation of the donor imposes significant ethical challenges about privacy, confidentiality, secondary use of samples and data for future studies, return of results, data exchange, and distribution of the benefits among others. Different templates of informed consent have been proposed to address some of these ethical challenges. However, an agreement has not been reached, and the discussion remains open. This work aims to contribute to the discussion, considering the meaning and value of the informed consent process for participation in biomedical research, and examines the different types of consents currently used evaluating the level of control and self-determination displayed by the donor.
Keywords: Informed Consent, Biobank
INTRODUCCIÓN
El propósito fundamental del Consentimiento Informado (CI) en investigación con seres humanos, es proporcionar a los sujetos potenciales la oportunidad de tomar decisiones libres e informadas sobre si desea o no participar, o continuar participando, en un estudio de investigación específico. Sin embargo, existe una gran cantidad de literatura que detalla las limitaciones significativas del CI para promover la participación voluntaria en investigación1,2. En el caso de los Biobancos poblacionales con fines de investigación, entendidos como, cualquier colección de muestras biológicas humanas con datos vinculados que serán utilizadas con fines de investigación3, el debate ético y legal sobre el tipo de consentimiento informado a utilizar, e incluso sobre el no uso de CI, ha pasado a primer plano, poniendo de manifiesto la tensión existente entre los intereses individuales y los beneficios sociales. Para algunos grupos particulares, en especial para los investigadores, los biobancos son la herramienta del futuro para promover y facilitar la investigación biomédica traslacional de alto nivel que conduciría a mejorar la salud de las generaciones futuras. Para otros, en especial para los bioeticistas, son preocupantes los repositorios de muestras o tejidos, ligados a información personal, porque pudieran ser usados sin respeto ni garantías suficientes para los donantes. En cualquier punto de este amplio espectro, las consideraciones éticas en torno al funcionamiento de los biobancos se tornan complejas pero oportunas con un reto fundamental, el lograr acuerdos que permitan la generación de nuevo conocimiento pertinente para la sociedad pero respetando los derechos individuales del donante.
Las garantías éticas tradicionales del consentimiento informado son necesarias pero no suficientes para la gobernanza de los biobancos y como resultado se requieren nuevas estructuras éticas. En discusión se encuentran controversias claves que incluyen: i) tipo de consentimiento informado, ii) confidencialidad, iii) propiedad y comercialización del material biológico, iv) retroalimentación a los participantes, v) ética del re-contacto, vi) anonimización de los participantes, vii) tiempo de almacenamiento del material biológico.
El presente artículo tiene como objetivo revisar los diferentes tipos de CI utilizados hoy en el contexto de los biobancos con fines de investigación, y dejar expuestas las principales implicaciones, beneficios, riesgos y limitantes de cada uno de ellos, que se consideran en la actualidad, un reto ético para la comunidad científica y académica.
Consideraciones éticas para los Biobancos
En los últimos 10 años los biobancos han atraído la atención en todo el mundo como una infraestructura clave para la investigación biomédica. Sin embargo, los avances en el campo de los biobancos también plantean importantes preocupaciones éticas y de derechos humanos. Uno de los problemas emergentes más visibles en el debate ético, ha sido el tipo de consentimiento informado empleado para recolectar y almacenar por largo tiempo el material biológico humano (MBH) asociado a datos médicos y demográficos del donante, así como la necesidad de transformar el marco ético generado a partir del código de Núremberg sobre el CI para la investigación con seres humanos. Esta transformación ética, se basa principalmente en la introducción y alcance del concepto de un "consentimiento amplio" en contraste con el concepto de un "consentimiento específico", el cual describe en detalle el proyecto de investigación particular. El consentimiento informado específico ha sido relevante para la ética en investigación en el contexto post- Núremberg, en especial en los ensayos clínicos de intervención, que en muchos casos conllevan un nivel de riesgo significativo para el sujeto de investigación4. Sin embargo, este tipo de CI, no es del todo adecuado para algunas iniciativas de investigación como los biobancos a gran escala, cuyo objeto fundamental es la recolección de MBH asociado a datos clínicos, los cuales serán usados en investigaciones futuras, por lo tanto no es posible indicar de manera suficientemente específica, el tipo de investigación para la cual sería utilizado el MBH y los datos asociados.
De entrada, el curso hacia un modelo de "consentimiento amplio", puede ser visto como un debilitamiento de la exigencia fundamental del marco ético post- Núremberg, a partir del cual se ha venido construyendo el consentimiento informado específico, con un claro enfoque hacia el respeto por la autonomía del sujeto de investigación, protegiendo su integridad e información personal, delimitando los riesgos e interés social de la investigación en el avance general del conocimiento, y manteniendo la confianza del público en los investigadores y las instituciones.
Por otro lado, desde la perspectiva de un consentimiento informado amplio, este tipo sólo se ha propuesto para actividades de investigación, tales como las generadas a partir de los biobancos, que no implican intervenciones de alto riesgo para el individuo y que contribuyen de manera significativa a la evolución de la investigación biomédica para beneficio social. Lo anterior ha generado la discusión actual de un marco ético alternativo para los biobancos, en el cual se equilibre los principios éticos que contempla el CI específico, (autonomía, beneficencia, no maleficencia y justicia), con otros principios éticos, tales como, solidaridad, (participación en la investigación para el bien común), ciudadanía y reciprocidad5,6.
Cabe destacar que el debate ético sobre los biobancos, no sólo es importante para establecer las normas para la adquisición de MBH como tal, sino también, y quizás más importante aún, para reflexionar sobre las normas que salvaguardan la información médica personal que va a acompañar el MBH en todas las actividades de investigación futuras. El debate, ya por más de dos décadas continúa aún sobre el tipo de consentimiento informado a utilizar y no existe aún consenso en el plano teórico sí el CI específico, o amplio, o general, o incluso el no uso de CI, es el mejor modelo para equilibrar los intereses de los donantes con los intereses de la investigación7-10. Sin embargo, en la práctica, el modelo denominado "consenso amplio" ha sido adaptado por varios biobancos actuales, tales como, Biobanco de Reino Unido (UK), Estudio HUNT de Noruega, y CARTaGENE (Montreal, Canadá)11.
Tipos de Consentimiento Informados en Biobanco
Los procedimientos apropiados para el consentimiento informado son ampliamente reconocidos como una exigencia ética para la investigación biomédica en seres humanos, en particular, como un medio para respetar la autonomía y la integridad personal de los participantes potenciales y reales de investigación12.
Consentimiento informado específico
El consentimiento informado específico, tradicionalmente utilizado en investigación biomédica, requiere de información específica y pertinente sobre la investigación, de tal forma que el individuo que participa pueda evaluar los beneficios y riesgos asociados con su participación y tomar decisiones autónomas. Por lo anterior, sería un error conceptual utilizar la noción de consentimiento informado para la investigación secundaria derivada de muestras almacenadas en biobancos con fines de investigación, dado que, al momento de la donación del MBH no es posible conocer información detallada sobre el tipo de investigación en la cual la muestra será utilizada13. Una opción para superar esto, sería solicitar al donante un nuevo consentimiento (re-consentir), para utilizar el MBH almacenado en el biobancos con anterioridad.
Sin embargo, varios estudios plantean que ésta no es la mejor opción tanto para el donante como para la investigación. Para algunos donantes es molesto que se les esté re-contactando, y para la investigación resulta costoso y poco efectivo renovar el consentimiento, lo cual reduciría el número de participantes disponibles e incrementaría la posibilidad de introducir un sesgo de selección14-16.
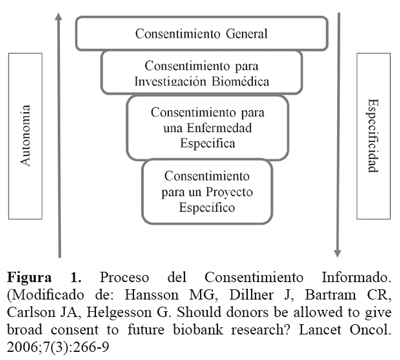
Con base en las consideraciones anteriores, surgen preguntas: ¿Cuál es la información adecuada?, sí la información dada al sujeto de investigación cubre todos los temas que son relevantes y suficientes para que él tome un decisión, entonces, ¿la persona está debidamente informada para dar el consentimiento?, sí los riesgos y beneficios son comunes a varios estudios, entonces, ¿la información general sobre estos estudios podría ser suficiente para que el donante pueda tomar una decisión informada? Lo anterior lleva a plantear que entre más general sea el CI, menos informativo es el mismo, por lo tanto los procedimientos del CI pueden ser pensados como un continuo que va desde el CI altamente Específico o CI cerrado, hasta un CI General o abierto, por lo tanto una menor restricción en los tipos de autorización por parte del donante, implica un mayor respeto a la autonomía16. (FIGURA 1)
Existe acuerdo general en los beneficios sociales que genera la investigación secundaria derivada de los bancos biológicos, como también, de la importancia del respeto por la autonomía y la autodeterminación como principios éticos importantes en la investigación biomédica, por lo tanto es pertinente buscar el equilibrio que permita obtener un consentimiento que respete los derechos éticos y legales del sujeto de investigación pero que no sea innecesariamente restrictivo, permitiendo finalmente generar beneficios en la salud de la sociedad. Tomando como argumento que el riesgo físico inherente al uso de MBH es menor para el sujeto de investigación>17, y el grado de especificidad del CI, se han propuesto una serie de nuevos modelos de consentimiento como alternativas más adecuada para los biobancos.
En una primera etapa se consideró que una muestra biológica sólo podía utilizarse para aquello para lo que se había extraído o para lo que se tenía autorización, lo cual, como ya se expuso, es inadecuado para las investigaciones secundarias derivadas de MBH almacenado en biobancos. Por lo tanto, se ha propuesto, y cada vez hay más investigadores y bioeticistas que están de acuerdo en la conveniencia de utilizar otros modelos de CI, tales como, CI amplio, (broad consent), CI general o abierto (Blanket consent/open consent) y más recientemente CI dinámico (dynamic consent).
Consentimiento Informado Amplio
El consentimiento informado amplio (CA), se entiende como un proceso mediante el cual los participantes están de acuerdo en mantener sus muestras biológicas, datos genómicos e información clínica y demográfica disponibles para uso en cualquier tipo de investigación futura que considere pertinente la gobernanza del biobanco. El CA se encuentra en una escala que va desde consentimiento específico para cada estudio individual hasta el consentimiento general o genérico, es decir, el consentimiento sin restricciones para cualquier tipo de uso, incluyendo los usos forenses y comerciales18,19.
El CA implica que los donantes de muestras biológicas dan su consentimiento no sólo para estudios específicos, sino que amplían su aceptación a diferentes clases o categorías de investigación, por ejemplo investigación en cáncer o en enfermedad cardiovascular. Lo anterior implica que, los investigadores no tienen que reconsentir, sí el nuevo proyecto de investigación se encuentra dentro de la categoría para la cual se obtuvo el CA. Una vez se ha consentido para una "categoría de investigación", se está aceptando que el material biológico puede ser utilizado para una amplia variedad de proyectos futuros en investigación biomédica, de los cuales, al momento de aplicar el CA no se tiene conocimiento sobre el tipo, alcances, riesgos, beneficios, ni el momento en la cual se va ejecutar. Por esta razón, los opositores de este tipo de CI, argumentan que el consentimiento amplio no es una forma legítima de consentimiento informado, debido a que un propósito importante para el CI es garantizar que los participantes potenciales de investigación obtienen información relevante sobre el estudio en el que están a punto de entrar19. Por lo tanto, podría decirse que el CA no cumple con los principios de consentimiento informado según lo dispuesto por la Declaración de Helsinki de la Asociación Médica Mundial 196420.
Existe una corriente amplia que apoya este tipo de CI, con los siguientes argumentos principales a favor de una autorización amplia y a futuro. En primer lugar, la investigación derivada del biobanco es muy útil, varios estudios han demostrado un gran potencial, especialmente en epidemiología, por lo tanto políticas muy estrictas sobre el CI pueden obstaculizar los avances en investigación y limitar el beneficio social. De este primer argumento se deriva que la obtención del consentimiento específico pone en peligro la cantidad y la calidad de la investigación que se pueda hacer. El segundo argumento a favor, se centra en que el consentimiento amplio es una forma genuina de respetar la autonomía de las personas. Los donantes tienen el derecho a decidir participar en la investigación, así la información completa de la misma no sea posible tenerla ni predecirla en el momento de solicitar el consentimiento. El tercer argumento para el uso del CA en la investigación derivada del biobanco, es un argumento de coherencia. A media que más países aceptan la idea de que los donantes deben tener derecho a dar un CA, esta práctica se debe legislar, inclusive muchos países permiten la investigación sin el consentimiento cuando las muestras no son identificables21. El cuarto argumento, se basa en que el tipo de investigación derivada de los biobancos no implica ningún riesgo físico directo para el donante. Por lo tanto, el riesgo es bastante menor al que se corre con la participación en ensayos clínicos con medicamentos o dispositivos invasivos. Los riesgos asociados con la participación en las investigaciones a partir de los biobancos radicarían en el daño potencial a los participantes del estudio, causado por la distribución inadecuada de la información derivada de las muestras biológicas o de los registros clínicos y demográficos asociados a la muestra21,22.
Si bien, no existen riegos físicos mayores para los participantes potenciales en investigación, se esbozan una serie de argumentos específicos en contra del uso del CA, ya sea en relación con la protección de los participantes, con la oportunidad genuina de la persona a elegir, o con ambas. La primera premisa es que la información personal relacionada con la investigación se debe manejar de forma segura. Esto significa, que la información debería ser codificada, mantener la confidencialidad y que los donantes y sus familias estén protegidos de cualquier daño derivado de la pérdida de confidencialidad17. ¿Cómo satisfacer esta premisa? ¿Es posible proteger la información por medio de codificación?, ¿Podemos predecir futuros problemas de seguridad de la información en la investigación abierta?21.
La codificación de una muestra o de los datos clínicos asociados, presupone que a partir de códigos en cualquier momento se podría identificar a una persona, dado que, la información que se recolecta es valiosa para la investigación y por lo tanto se hace necesaria protegerla. Pero ¿cómo podemos prever que valor tendrá en el futuro? ¿Cómo vamos a evaluar los mecanismos de seguridad para la información que se va a obtener y que aún no se prevé?, por ejemplo, la derivada de la secuencia del genoma23,24. Por lo tanto, parece que el riesgo principal, y el debate en torno a la investigación derivada de biobancos, debería estar más centrada en la información que en el material biológico. El problema, es que no sabemos cómo la información puede ser perjudicial. Ésta es una de las características fundamentales de la investigación derivada del biobanco. Todo lo que sabemos es que aunque el beneficio de la investigación puede ser compartida por grupos de pacientes y la sociedad en general, los riesgos informativos son asumidos por los participantes individuales de investigación y sus familiares. El manejo seguro de la información es exactamente el problema clave en la investigación derivada de los biobancos, que tiene que ser abordado y no eludido por criterios de poca relevancia práctica.
Sin duda, la seguridad de la información para el CA puede llegar a ser muy difícil de obtener. Incluso trabajando con muestras sin identificación o muestras anónimas, el individuo puede llegar a ser identificado25. Las técnicas de biología molecular utilizadas en medicina forense, permiten identificar a un donante de células o tejidos. Un ejemplo clásico, es el caso del famoso criminal de la ministra sueca de Asuntos Exteriores, Anna Lindh. Los investigadores utilizaron el material biológico de un biobanco de diagnóstico (tamizaje de recién nacido), para identificar al asesino, por lo tanto, hay razones para creer que es posible que esto pueda ocurrir en muestras almacenadas en un biobanco con fines de investigación a gran escala21.
Otro punto importante que no puede garantizar el CA, es el derecho al retiro. Una condición previa importante para el retiro es, por supuesto, que el participante conozca en qué investigación está inscrito, lo cual es bastante difícil de controlar cuando se usa un CA y más aún cuando las muestras y los datos se pueden compartir entre redes de investigadores trabajando en una categoría determinada; por lo tanto, muestra y datos se pueden distribuir en muchos lugares fuera del control del investigador individual26,27.
Consentimiento Informado General
Este tipo de consentimiento, también denominado, "consentimiento abierto", "de amplio consenso", "consentimiento genérico", o "consentimiento manta", es la forma más alejada y la que más se desvía del modelo tradicional de consentimiento informado específico. En este tipo de CI no se le pide al sujeto de investigación dar su consentimiento para un proyecto específico de investigación (consentimiento informado específico o tradicional), o para una área o categoría de investigación (consentimiento amplio), sino consentir para el uso, sin restricciones, de su muestra biológica y datos clínicos asociados, en los proyectos de investigación que sean definidos por la gobernanza del biobanco, por lo tanto el sujeto de investigación juega un papel totalmente pasivo en esta decisión y está consintiendo, de forma anticipada, para proyectos futuros sin limitaciones en el alcance y en la duración de la autorización17. El consentimiento general (CG), permite la máxima utilidad del MBH para investigación, dado que no hay límites en el alcance de la investigación, ni límites de tiempo, además exige un esfuerzo administrativo y organizativo mínimo, siendo este el modelo utilizado por la mayoría de los bancos de datos genéticos28.
Debido a la forma tan abierta de consentir, este tipo de CI, que si bien es aceptado y usado por la mayaría de bancos de datos genéticos, genera una fuerte discusión sobre los principios éticos involucrados, discusión que tiene más de una década. En el 2001, Chadwick y Berg propusieron introducir diferentes etapas de consentimiento, con un consentimiento específico para la toma inicial de la muestra, CI que estaría enfocado en una investigación específica y otro CI, más general, para el uso de las muestras en investigaciones adicionales, este CG estaría fundamentado en principios éticos alternativos, tales como, solidaridad y equidad, por lo tanto, el donante tendría la opción de consentir para uno u otro o para los dos29. Sin embargo, la tecnología genómica continúa evolucionando de forma acelerada, desafiando el marco normativo tanto ético como legal de la investigación biomédica. Un ejemplo claro, es el enfoque del consentimiento abierto o general, desarrollado en el marco del Proyecto Genoma Personal (PGP). Este tipo de consentimiento es aplicado a los participantes de estudios que utilizan datos correlacionados entre el genotipo y fenotipo.
En este modelo se hace evidente que los conceptos de privacidad y confidencialidad no se pueden sostener de forma absoluta. Por lo tanto los participantes del PGP al dar un consentimiento abierto están aceptando que: i) sus datos podrían ser incluidos en una base de datos pública de libre acceso, ii) no existen garantías ofrecidas en relación con el anonimato, la privacidad y confidencialidad, iii) la participación implica un cierto riesgo de daño a sí mismos y a sus familiares, iv) la participación no beneficia al participante de manera directa y tangible, v) el proyecto requiere hacer seguimiento del bienestar del donante por medio de cuestionarios trimestrales, vi) el participante se puede retirar del estudio en cualquier momento, vii) la eliminación completa de los datos que han estado disponibles en el dominio público puede no ser posible30. Lo anterior implica que los donantes deben ser plenamente conscientes que sus datos clínicos y genéticos pueden ser compartidos y vinculados a otras bases de datos para investigaciones a gran escala, y que el propósito pleno y el alcance de su uso posterior no se pueden prever. Los donantes deben conocer y aceptar que son potencialmente identificables y que su privacidad no se pueden garantizar. De igual forma, los voluntarios a partir de una relación de confianza consienten la divulgación sin restricciones de los resultados obtenidos de cualquier investigación futura cuyo contenido no es posible predecir. Lo anterior implica que este tipo de consentimiento carece de compromisos de anonimato, de privacidad o de confidencialidad. El principio moral que respalda el consentimiento es la verdad -decir la verdad-, como fundamento para que el donante tome una decisión autónoma.
Es claro que la evolución actual de la tecnología genómica desafía el marco ético tradicional para la investigación biomédica, basado principalmente en la autonomía, confidencialidad y privacidad; siempre que se investigue sobre el genoma humano, será posible identificar al donante, por lo tanto se requiere de forma permanente y urgente una reevaluación de la relación entre los científicos y los sujetos de investigación. Sin embargo, las soluciones alternas parecen escasas, por lo tanto para llegar a soluciones sostenibles se requiere del dialogo permanente entre las ciencias biomédicas y las humanidades.
Consentimiento Informado Dinámico
El consentimiento dinámico (CD), tiene como fundamento el uso de estrategias modernas de comunicación para informar, involucrar, ofrecer opciones y por último, pero no menos importante, obtener el consentimiento por cada proyecto de investigación que se derive de MBH conservado en biobancos con fines de investigación. Esta propuesta, de manifestación "dinámica", proviene del proyecto EnCoRe (por su siglas en inglés; Ensuring Consent and Revocation), un proyecto interdisciplinario con actores del mundo académico y el sector empresarial31. El proyecto EnCoRe utiliza una plataforma web que permite a los participantes de investigación tener una relación interactiva con los gestores del biobanco y con la comunidad de investigación32. Desde la plataforma web se promueve un proceso dinámico, que hace hincapié en el re-contacto continuo con los donantes del biobanco, ofreciendo a ellos información "en tiempo real" de los proyectos específicos de investigación, lo cual permite a los participantes la opción de proporcionar o revocar fácilmente su consentimiento33. Bajo esta metodología interactiva, utilizado herramientas de informática, el CD propone ser un modelo de continua comunicación bidireccional entre los participantes en la investigación (donantes), y los investigadores, superando así el problema ético que implica la participación pasiva, propia del consentimiento amplio34. Por lo tanto, el CD propicia el respeto y el ejercicio de la autonomía por parte de los participantes, al tener la oportunidad de dar su consentimiento en tiempo real para los nuevos tipos de investigación, en lugar de otorgar una autorización amplia no específica al momento de donar el MBH para almacenamiento en el biobanco.
En el modelo de consentimiento dinámico, los participantes siempre deben diligenciar el consentimiento informado para el uso de su material biológico y datos clínicos electrónicos asociados, tanto para uso primario como secundario. No importa si el nuevo proyecto es sólo ligeramente diferente del proyecto inicial. Ser capaz de informar a los donantes sobre la investigación en la cual están involucrados, es esencial en cualquier tipo de consentimiento para investigación y ha sido el punto crucial en el debate en torno a la legitimidad de los consentimientos amplios. Al enviar continuamente información actualizada a los donantes sobre los proyectos específicos de investigación, por medio de mensajes cortos de texto, correos electrónicos o páginas web, el consentimiento dinámico puede cumplir mejor los ideales de suministrar la información detallada en comparación con consentimientos amplios35.
Si bien, el CD ofrece la opción de informar en tiempo real al donante, existe riesgo al momento de definir sí la información es relevante, suficiente y pertinente para que el participante haciendo uso de su autonomía tome una decisión y marque la casilla acorde con su decisión. Los defensores del CD argumentan que el mantener una interacción constante y estrecha con los participantes, incrementa la adherencia de los participantes así como la posibilidad de contar con el donante para la toma de una nueva muestra en caso de ser requerida. Por otro lado, también genera mayor confianza por parte de los donantes en la investigación, procurando que los estudios estén en sintonía con las expectativas y preocupaciones de la sociedad36,37.
El informar de manera dinámica a los donantes, podría generar expectativas no satisfechas, al crear en los participantes grandes esperanzas en la investigación, y entender el objetivo de la misma como un beneficio directo, aspecto que pocas veces se cumple en la investigación biomédica, en especial en la investigación secundaria generada a partir de los biobancos, cuyos resultados van dirigidos al beneficio para la salud de generaciones futuras. Es factible que al no cumplirse las expectativas de los donantes, ellos puedan asumirlo como una falta o abuso de confianza y el reclutamiento menor sería la consecuencia, por lo tanto el costo/ beneficio de un mayor contacto debe ser sopesado de manera cuidadosa38. El poder proveer a los donantes de los biobancos de herramientas que les permitan un mayor control y tal vez nuevos derechos sobre su contribución, es probablemente el argumento más fuerte para un modelo de consentimiento dinámico e interactivo. Por lo tanto, los donantes juegan un papel más de socio activo que de colaboradores pasivos, ofreciendo al participante la posibilidad de expresar sus preferencias y proteger sus intereses37.
Por otro lado, la estrategia utilizada en el CD tiene como potencial inherente el darle a los participantes control sobre el uso de sus muestras biológicas y datos clínicos asociados, control que antes estaba bajo la responsabilidad de los comités de ética en investigación, comité de gobernanza del biobanco e investigadores participantes en la investigación, por lo tanto constituye una diferencia moral que puede ser parte de un movimiento hacia procesos más abiertos y democráticos en ciencia39. Otra ventaja potencia del CD, es que permite el retorno de los resultados de investigación y los hallazgos incidentales a los participantes, puntos que cada vez adquieren un creciente interés por parte de los donantes40,41. Por lo tanto sus defensores argumentan que, la devolución de los resultados es una necesidad, especialmente cuando se hace investigación en medicina genómica, por ejemplo, secuenciación del genoma, de donde se derivan datos que podrían ser valiosos para un participante; por lo tanto bajo la estrategia del CD, se respetan los valores de reciprocidad, autonomía y beneficencia, dando la opción al donante de querer estar informado o no, de los resultados de la investigación34. Sin embargo, en la actualidad, la mayor parte de la información derivada de los estudio de medicina genómica, como la secuenciación del genoma, no es fácilmente entendida por el público generar y requiere de un asesoramiento de personal científico entrenado para ello, de lo contrario se corre el riesgo de generar confusión y expectativas falsas Por lo anterior, la investigación biomédica es un acto de equilibrio entre la creación de un mejor entendimiento sobre la prevención de enfermedades, la enfermedad como tal y su tratamiento, pero al mismo tiempo, no debe generar un entusiasmo exagerado en la traducción de resultados de investigación en medicina práctica.
CONCLUSIONES
El núcleo de debate ético, para determinar cuál es el tipo de CI más adecuado a ser utilizado en el biobanco, continua siendo el significado y alcance de "ser informado adecuadamente y sí al dar el consentimiento sobre la base de premisas amplias es válido o no". Por lo tanto la discusión y la investigación sobre el tema se hacen necesarias para lograr construir un modelo moralmente válido que legitime que el individuo está realmente informado para tomar una decisión autónoma. Esto implica que 'más información' en sí misma no significa necesariamente que el donante esté en condiciones de tomar una decisión autónoma, lo que hace realmente que el consentimiento sea informado, es la relevancia, pertinencia y validez de la información otorgada.
Por otro lado, desde la perspectiva moral es tan válido respetar el derecho de las personas que desean tener control sobre el material biológico donado y datos asociados, como también, es importante respetar el derecho de aquellas personas que no desean recibir información, ni ser re-contactadas, y que consideran el ser donantes como un acto de altruismo que contribuye a la salud de las generaciones futuras, así no se reciban beneficios de manera directa.
Sí aceptamos el supuesto que la investigación secundaria a partir de biobancos generará avances médicos importantes, sería moralmente problemático imponer procedimientos innecesarios que reduzcan estas oportunidades sociales, por lo tanto tendríamos un deber prima facie para promover este tipo de investigación. Lo anterior obliga a la necesidad de llegar a acuerdos consensuados sobre el tipo o tipos de CI moralmente aceptados para la protección de los intereses de los donantes, sin reducir el valor de la investigación.
AGRADECIMIENTOS
Apoyos Recibidos: Colciencias bajo el contrato 696- 2014, Programa Cardiecol, Código 617399847755. Unidad Estructural Biobanco.
NOTA: Como parte del trabajo desarrollado por el equipo a cargo del "Biobanco Cardiecol: Herramienta para la investigación Biomédica en Enfermedad Cardio-Cerebro-Vascular", avalado y patrocinado por Colciencias, según contrato 696-2014, en el marco del Programa Cardiecol, se propone un consentimiento informado tipo amplio, el cual se presenta como material suplementario del presente artículo. Este documento puede servir como una opción de modelo para proyectos de investigación que requieren conservar MBH asociado a datos con fines de investigación para estudios secundarios en la misma área de conocimiento del proyecto para el cual se tomó la muestra original. Para el uso, reproducción o modificación de este material, se debe citar como: Serrano N, Guio E., Páez MC. Consentimiento Informado para la donación voluntaria al Biobanco de muestras biológicas y datos asociados. Rev Univ Ind Santander Salud. 2016; en prensa.
1. DESCRIPCIÓN DEL PROCEDIMIENTO
Durante su participación en el proyecto de investigación (poner el nombre) se podrán tomar muestras de sangre, así como fluidos (orina, esputo, saliva, etc). Una vez realizados los análisis para el presente proyecto, es posible que quede muestra biológica sobrante, por lo tanto le proponemos donar, de manera voluntaria, el material biológico sobrante para ser almacenado en el Biobanco (poner el nombre). Dichas muestras biológicas excedentes podrán ser utilizadas en un futuro para proyectos de investigación biomédica, incluyendo estudios genéticos, en la misma área temática del proyecto actual y que previamente sean aprobados por los comités externos, técnico-científico y ética en investigación, a los que está adscrito el biobanco. Las muestras biológicas seguirán almacenadas en el biobanco hasta que las mismas se agoten, o hasta el momento en que usted decida retirar el consentimiento.
2. OBJETIVO
La finalidad del biobanco (poner el nombre) es recoger y almacenar muestras biológicas humanas para realizar, en un futuro, proyectos de investigación biomédica en el área (poner el nombre). Los resultados de dichos proyectos de investigación pueden contribuir a generar nuevos métodos para el mejor diagnóstico de las enfermedades y a generar nuevas medicinas para tratarlas.
3. CONDICIONES PARA LA DONACIÓN
La donación de su muestra biológica es totalmente voluntaria, por ser un acto altruista, no recibirá ningún beneficio de tipo económico ni material. Su donación podría ayudar en el futuro a pacientes e incluso a familiares suyos que tienen la misma patología o padecen enfermedades similares. El Biobanco al cual esta donando su muestra biológica, bajo ninguna condición venderá o distribuirá con fines comerciales la muestra donada por usted. Los costos de obtención, conservación y envío de la muestras serán cargados a quienes las utilicen pero sin ánimo de lucro. En caso de producirse un eventual cierre del biobanco usted será contactado para que manifieste su conformidad o no con el destino previsto de su muestra.
4. RIESGOS
El procedimiento de donar las muestras biológicas al biobanco no implica ningún riesgo sobre agregado para su salud, dado que se trata de una muestra sobrante de la intervención. La donación de sangre apenas tiene efectos secundarios, el más frecuente es la aparición de pequeños hematomas (morados), en la zona de punción que desaparecen de manera espontánea entre 1 a 2 días después de la toma de sangre.
5. DERECHO A RETIRAR SU CONSENTIMIENTO INFORMADO
La decisión de donar sus muestras para ser almacenadas en este biobanco para estudios biomédicos en un futuro es totalmente voluntaria. Usted puede negarse a donarlas y seguir haciendo parte del protocolo de investigación para el cual se le está tomando la muestra. Si consiente en donar las muestras restantes al Biobanco (poner el nombre), usted puede retirar este consentimiento en cualquier momento, sin necesidad de dar explicación alguna sobre los motivos de su decisión, y sin que ello tenga ninguna repercusión en la atención que está recibiendo. Si decide retirar su consentimiento, las muestras que no hayan sido utilizadas serán descartadas bajo los protocolos de calidad del Biobanco. Sin embargo, es importante que conozca que es posible que ya se tengan resultados de investigaciones previas al retiro del presente consentimiento, por lo tanto su retiro no se extenderán a estos resultados.
6. PROTECCIÓN DE DATOS PERSONALES Y CONFIDENCIALIDAD
Los datos personales y de salud obtenidos a partir del proyecto de investigación o de su historia clínica serán manejados en una base de datos que cumple con garantías que establece la legislación colombiana sobre protección de datos de carácter personal.
Las muestras biológicas junto con la información asociada pueden ser cedidas a otros centros de investigación en el ámbito nacional e internacional que estén trabajando en la misma área temática. En este caso la cesión de la información contenida en la base de datos asociada a la muestra biológica, se realizará mediante un procedimiento de disociación, esto significa, que se suprimirá la información personal que lo identifica y ésta será reemplazada por un código.

REFERENCIAS
1. Boulton M, Parker M. Informed consent in a changing environment. Soc Sci Med. 2007; 65(11): 2187-2198. [ Links ]
2. Miller T, Boulton M. Changing constructions of informed consent: qualitative research and complex social worlds. Soc Sci Med 2007; 65(11): 2199-2211. [ Links ]
3. Shaw DM, Elger BS, Colledge F. What is a biobank? Differing definitions among biobank stakeholders. Clin Genet. 2014; 85(3): 223-227. DOI: 10.1111/ cge.12268. [ Links ]
4. Serepkaite J, Valuckiene Z, Gefenas E. "Mirroring" the Ethics of Biobanking: What Analysis of Consent Documents Can Tell Us? Sci Eng Ethics. 2014; 20(4): 1079-1093. DOI: 10.1007/s11948-013-9481-0. [ Links ]
5. Chadwick R, Berg K. Solidarity and equity: new ethical frameworks for genetic databases. Nat Rev Genet. 2001; 2(4): 318-321. [ Links ]
6. Knoppers BM, Chadwick R. Human genetic research: emerging trends in ethics. Nat Rev Genet. 2005; 6(1): 75-79. [ Links ]
7. Caulfield T, Kaye J. Broad consent in biobanking: reflections on seemingly insurmountable dilemmas. Med Law Int 2009; 10: 85-100. [ Links ]
8. Otlowski M: Donor perspectives on issues associated with donation of genetic samples and information: an Australian viewpoint. J Bioethical Inq. 2007; 4: 135-150. DOI: 10.1007/s11673-007-9055-4. [ Links ]
9. Elger BS, Caplan AL. Consent and anonymization in research involving biobanks: differing terms and norms present serious barriers to an international framework. EMBO Rep 2006; 7: 661-666. DOI: 10.1038/sj.embor.7400740. [ Links ]
10. Caulfield T, Knoppers BM. Consent, privacy and research biobanks. GPS Policy Brief 2010; 1: 10. [ Links ]
11. Master Z, Nelson E, Murdoch B, Caulfield T. Biobanks, consent and claims of consensus. Nat Methods 2012; 9(9): 885-888. DOI: 10.1038/10.1038/nmeth.2142. [ Links ]
12. Beauchamp T, Childress R. Principles of Biomedical Ethics, 6th ed. New York: Oxford University Press; 2009. [ Links ]
13. Árnason V, Árnason G. Consentimiento Informado Democrática? El caso de la base de datos de Islandia 'Trames. 2004; 8:164-177. [ Links ]
14. Furness PN, Nicholson ML. Obtaining explicit consent for the use of archival tissue samples: practical issues. J Med Ethics. 2004; 30(6): 561-564. [ Links ]
15. Couzin-Frankel J. Newborn blood collections. Science gold mine, ethical minefield. Science. 2009; 324: 166-168. DOI:10.1126/science.324.5924.166. [ Links ]
16. Mascalzoni D, Hicks A, Pramstaller P, Wjst M. Informed consent in the genomics era. PLoS Med. 2008; 5(9): e192. DOI: 10.1371/journal. pmed.0050192. [ Links ]
17. Hansson MG, Dillner J, Bartram CR, Carlson JA, Helgesson G. Should donors be allowed to give broad consent to future biobank research? Lancet Oncol. 2006; 7(3): 266-269. [ Links ]
18. Garrison NA, Sathe NA, Antommaria AH, Holm IA, Sanderson SC, Smith ME, et al. A systematic literature review of individuals' perspectives on broad consent and data sharing in the United States. Genet Med. 2015. DOI: 10.1038/gim.2015.138. [ Links ]
19. Helgesson G1. In defense of broad consent. Camb Q Healthc Ethics. 2012; 21(1): 40-50. [ Links ]
20. World Medical Association. 1964. Declaration of Helsinki. [ Links ]
21. Hofmann B. Broadening consent-and diluting ethics? J Med Ethics. 2009; 35(2): 125-129. DOI: 10.1136/jme.2008.024851. [ Links ]
22. Eriksson S, Helgesson G. Potential harms, anonymization, and the right to withdraw consent to biobank research. Eur J Hum Genet. 2005; 13: 1071-1076. [ Links ]
23. Greely HT. The uneasy ethical and legal underpinnings of large-scale genomic biobanks. Annu Rev Genomics Hum Genet. 2007; 8:343-364. [ Links ]
24. Meslin EM, Quaid KA. Ethical issues in the collection, storage, and research use of human biological materials. J Lab Clin Med. 2004; 144: 229-234. [ Links ]
25. McGuire AL, Gibbs RA. Genetics. No longer deidentified. Science. 2006; 312(5772): 370-371. [ Links ]
26. OECD. Draft Guidelines for Human Biobanks and Genetic Research Databases 2008. [ Links ]
27. Asslaber M, Zatloukal K. Biobanks: transnational, European and global networks. Brief Funct Genomic Proteomic. 2007; 6: 193-201. [ Links ]
28. Wendler D. Broad versus blanket consent for research with human biological samples. Hastings Cent Rep. 2013; 43(5): 3-4. DOI: 10.1002/hast.200. [ Links ]
29. Chadwick R, Berg K. Solidarity and equity: new ethical frameworks for genetic databases. Nat Rev Genet. 2001; 2(4): 318-321. [ Links ]
30. Lunshof JE, Chadwick R, Vorhaus DB, Church GM. From genetic privacy to open consent. Nat Rev Genet. 2008; 9(5): 406-411. DOI: 10.1038/nrg2360. [ Links ]
31. EnCoRe - Ensuring Consent and Revocation 2010. [ Links ]
32. Kaye J. Embedding biobanks as tools for personalised medicine. Norsk Epidemiol 2012; 21(2): 169-177. [ Links ]
33. Whitley EA, Kanellopoulou N, Kaye J. Consent and research governance in biobanks: evidence from focus groups with medical researchers. Public Health Genomics. 2012; 15(5): 232-242. DOI: 10.1159/000336544. [ Links ]
34. Steinsbekk KS, Kåre Myskja B, Solberg B. Broad consent versus dynamic consent in biobank research: is passive participation an ethical problem? Eur J Hum Genet. 2013; 21(9): 897-902. DOI: 10.1038/ ejhg.2012.282. [ Links ]
35. Kaye J. From single biobanks to international networks: developing e-governance. Hum Genet. 2011; 130: 377-382. DOI: 10.1007/s00439-011-1063-0. [ Links ]
36. Kaye J, Curren L, Anderson N, Edwards K, Fullerton SM, Kanellopoulou N, et al: From patients to partners: participant-centric initiatives in biomedical research. Nat Rev Genet. 2012; 13: 371-376. DOI: 10.1038/nrg3218. [ Links ]
37. Petrini C: 'Broad' consent, exceptions to consent and the question of using biological samples for research purposes different from the initial collection purpose. Soc Sci Med. 2010; 70: 217-220. DOI: 10.1016/j.socscimed.2009.10.004. [ Links ]
38. Whitley EA, Kanellopoulou N, Kaye J. Consent and research governance in biobanks: evidence from focus groups with medical researchers. Public Health Genomics. 2012; 15(5): 232-242. DOI: 10.1159/000336544. [ Links ]
39. Kaye J. From single biobanks to international networks: developing e-governance. Hum Genet. 2011; 130: 377-382. DOI: 10.1007/s00439-011- 1063-0. [ Links ]
40. Tabor HK, Berkman BE, Hull SC, Bamshad MJ. Genomics really gets personal: how exome and whole genome sequencing challenge the ethical framework of human genetics research. Am J Med Genet A. 2011; 155A: 2916-2924. DOI: 10.1002/ ajmg.a.34357. [ Links ]
41. Wolf SM, Crock BN, Ness BV, Lawrenz F, Kahn JP, Beskow LM, et al: Managing incidental findings and research results in genomic research involving biobanks and archived data sets. Genet Med. 2012; 14: 361-384. DOI: 10.1038/gim.2012.23. [ Links ]