Introducción
La leishmaniasis cutánea constituye un problema de salud pública debido a su morbilidad, amplia distribución geográfica y complejo ciclo de transmisión, comprendiendo diferentes especies de parásitos, reservorios y vectores1,2,3. A nivel mundial, más de 12 millones de personas están infectadas con leishmaniasis cutánea, y 350 millones están en riesgo de contraer esta enfermedad4. Para Colombia la situación es alarmante, ya que se presenta como uno de los países endémicos en América Latina5, segundo país con el mayor número de reportes positivos, solo superado por Brasil6.
Nyssomyia yuilli y Nyssomyia trapidoi (Psychodidae: Phlebotominae), son especies vectoras de flagelados del género Leishmania sp. (Euglenozoa: Trypanosomatidae), agente etiológico de la enfermedad tropical leishmaniasis4,7-8 en varios países de latinoamérica como Brasil, Colombia, Ecuador y Panamá9,10,11,12,13,14. La especie N. trapidoi es considerada la principal especie transmisora de leishmaniasis cutánea en diferentes departamentos de Colombia, de los cuales, Nariño, Tolima, Antioquia, Boyacá y Santander, se le reconoce como un vector de Leishmania panamensis 11,15,16,17,18,19,20; para este último, también se ha podido identificar a esta especie con individuos de L. (Viannia) braziliensis 21. Para Colombia, se ha incriminado a N. yuilli como vector de L. panamensis encontrando hembras naturalmente infectadas en los municipios de Otanche y Pauna en el occidente del departamento de Boyacá20, y para el municipio de Leticia (departamento del Amazonas) se encontraron individuos con flagelados no identificados9.
Así, debido a la presencia de N. yuilli y N. trapidoi en el municipio, y a los antecedentes vectoriales para el departamento y para el país20, se hace necesario el estudio de la bionomía de estas dos especies, investigaciones que ayuden a complementar y describir su ecología, en especial, parámetros de comportamiento como la actividad horaria de picadura,20,22 ya que la falta de información sobre los vectores agudiza la transmisión de la enfermedad, por la carencia de herramientas que faciliten la realización de planes de prevención y control20,23,24,25. Por lo anterior, el objetivo de este estudio es describir la actividad nocturna de las especies de N. yuilli y N. trapidoi, en el municipio de Otanche, zona endémica de leishmaniasis cutánea.
Metodología
Área de estudio
El estudio se realizó en el municipio de Otanche, departamento de Boyacá, uno de los 25 municipios que más casos de leishmaniasis cutánea reportan a nivel nacional (0,7 del total de casos para el país a la semana epidemiológica 10 del 2014)21, y ubicado al occidente del departamento, área considerada como endémica para esta enfermedad20. Debido a que el mayor número de casos fueron reportados para el área rural26, se seleccionó dentro del municipio la Vereda El Carmen (5°49’10,56”N y 74°9’28,67”O, altura promedio de 915 msnm) por el alto número de casos positivos (32 casos positivos a la semana epidemiológica 31 del 2014)27.
El área de estudio es un territorio propiamente montañoso y quebrado, presenta una temperatura media de 23-25ºC, con pisos térmicos cálido y templado, con zonas de vida como bosque húmedo tropical (bh-T), y bosque muy húmedo premontano (bmh-PM), con una pluviosidad anual entre 2800-3600mm y un régimen de lluvias bimodal con máximos entre abril-mayo y octubre- noviembre28.
Recolección y determinación taxonómica
La recolección de los flebótomos se llevó a cabo en el mes de agosto de 2014 durante 15 noches, donde se seleccionaron (de forma aleatoria) 41 viviendas con antecedentes de casos positivos de leishmaniasis cutánea o donde vivieran personas con ulceras activas, información adquirida por medio de encuestas entomológicas para estudios de foco de leishmaniasis cutánea29-30. La colecta de flebótomos se realizó en tres viviendas por noche en promedio (dependiendo de las condiciones climáticas), siguiendo la metodología para levantamiento de adultos de flebótomos propuesta por el Instituto Nacional de Salud en la Guía: Protocolo para la Vigilancia en Salud Pública de leishmaniasis29.
En cada vivienda, previo a la consulta y firma de consentimiento informado, se instalaron dos trampas de luz blanca sin cebo, o trampas CDC (por sus siglas en inglés: Center for Disease Control and Prevention) por noche. En el intradomicilio (interior de la vivienda) en un dormitorio, y en el peridomicilio (parte exterior de la vivienda) en gallineros, establos o porquerizas, removiendo la malla cada hora durante doce horas (18:00-06:00). Se registraron datos ambientales como humedad relativa (%) y temperatura (ºC) promedio en cada hora de cada noche, con el objetivo de poder determinar si estos factores ambientales influyen sobre la actividad nocturna de los flebótomos.
El material recolectado en cada una de las trampas fue separado cuidadosamente, y los flebótomos encontrados se preservaron en alcohol al 70% para su posterior identificación en el Laboratorio de Entomología de la Secretaria de Salud del Departamento de Boyacá. La determinación de las especies se hizo por medio de la revisión de genitalitas de hembras y machos, con ayuda de las claves taxonómicas de Galati2 y Young y Duncan3, además, cada una de las especies fueron corroboradas por el programa de Control de Calidad del Instituto Nacional de Salud. El montaje permanente de los individuos se hizo en placas portaobjeto con bálsamo de Canadá31, y se incluyeron a la colección de referencia de Flebótomos de la Unidad de Entomología de Laboratorio Departamental de Salud Pública de Boyacá.
Análisis de datos
Para cada especie, incluyendo hembras y machos, se calculó la abundancia relativa por hora/por noche, lo que permitió determinar la actividad nocturna de las especies de flebótomos durante las 15 noches de muestreo. Para establecer si las variables ambientales temperatura y humedad están relacionadas o no con el número de individuos capturados, se utilizó una prueba paramétrica de correlación de Pearson, ya que esta indica la relación lineal entre variables32. Previo a esto, se realizó una prueba de Normalidad de Shapiro-Wilk. Todos los análisis se hicieron por medio del programa SPSS Statistics 18.133.
Resultados
Se colectaron 361 individuos, distribuidos en 16 especies de la subfamilia Phlebotominae, de las cuales N. yuilli y N. trapidoi significaron el 60,3% de todas las colectas. Para las dos especies el número de individuos capturados fue mayor en el intradomicilio (101) que en el peridomicilio (48), con más capturas de hembras que de machos, 102 y 47 individuos respectivamente. Tabla 1. Otras especies capturadas fueron Trichopygomyia triramula (13,37%), Psathyromyia barrettoi majuscula (6,11%), Lutzomyia hartmanni (4,17%), Evandromyia dubitans (3,61%), Ev. walkeri (3,33%), Lu. sp. de pichinde (3,16%), Ev. saulensis (1,94%) y Lu. gomezi (1,39%).
Tabla 1 Número de individuos (n) y abundancia relativa (%) de N. yuilli y N. trapidoi, colectados en cada sitio de captura en la Vereda El Carmen, Otanche (Boyacá), durante 15 días del mes de agosto de 2014.
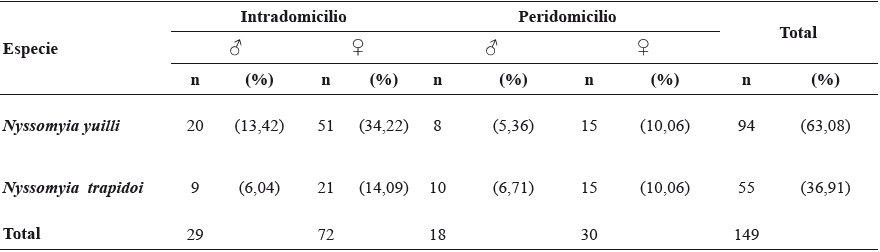
aNúmero de individuos colectados.
La actividad de N. yuilli inició desde las 18:00 horas, alcanzando un incremento alrededor de la media noche entre las 23:00-24:00 horas, donde se capturó el 22% de todos los individuos, a partir de esta hora empezó un descenso gradual hasta las 3:00-4:00 horas, donde se tuvieron las últimas colectas, a partir las 4:00 horas no se capturaron más individuos. Figura 1.
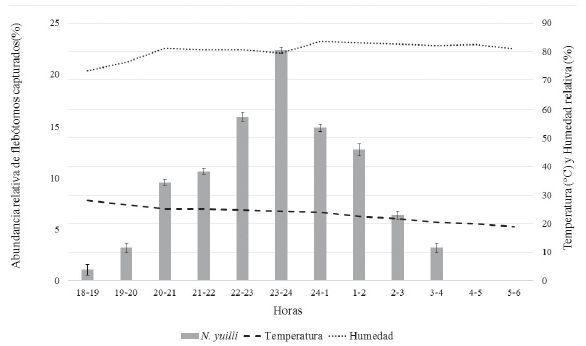
Figura 1 Actividad nocturna de N. yuilli. Se muestra la abundancia relativa de los individuos colectados por hora/por noche, desde las 18:00 hasta las 6:00 horas, durante 15 días del mes de agosto de 2014, en la Vereda El Carmen, Municipio Otanche (Boyacá).
N. trapidoi tuvo un inicio de actividad desde las 19:00 horas, aumentando sucesivamente hasta las 22:00 horas donde alcanzó un máximo, después de esta hora no se evidenciaron aumentos o disminuciones marcados hasta las 2:00-3:00 horas donde la actividad decae. A las 4:00-5:00 horas se registraron las últimas colectas para esta especie. Figura 2.
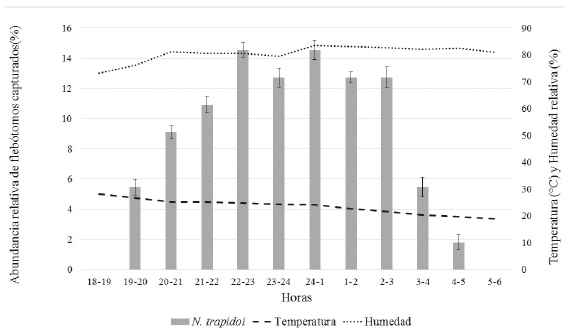
Figura 2 Actividad nocturna de N. trapidoi. Se muestra la abundancia relativa de los individuos colectados por hora/por noche, desde las 18:00 hasta las 6:00 horas, durante 15 días del mes de agosto de 2014, en la Vereda El Carmen, Municipio Otanche (Boyacá).
En cuanto a las condiciones meteorológicas durante las noches de muestreo, se presentó viento leve a moderado, lloviznas, cielo completamente o parcialmente cubierto, temperatura promedio de 23,5⁰C y humedad promedio de 80,5%. Los resultados de los análisis de correlación de Pearson muestran que no existe una relación lineal entre la abundancia de los individuos colectados de la especie N. yuilli con la humedad relativa (r: 0,259, p: 0,416) y temperatura promedio (r: 0,296, p: 0,351), igual resultado para la especie N. trapidoi: humedad relativa (r: 0,482, p: 0,113) y temperatura promedio (r: 0,191, p: 0,552).
Discusión
Para N. yuilli, Porter y De Foliart34 reportan un comportamiento con dos picos de actividad, en un bosque seco en el departamento de Antioquia (Colombia), el primero a las 20:00-21:00 horas y el segundo a las 24:00-1:00 horas, aparentando un comportamiento bimodal, puesto que los patrones de actividad fueron bastantes variables de una noche a otra, existiendo una sola constante: una mayor actividad a las primeras horas. Nuestros resultados difieren con lo anterior, ya que la alta actividad a horas tempranas de la noche no es alta, además, solo es evidente un aumento de actividad y no dos. Aun así, existe una similitud con el segundo incremento de actividad hacia la media noche reportado por Porter y De Foliart34. Este tipo de comportamiento, donde los flebótomos muestran una preferencia para alimentarse y ser más activas a mitad de la noche, constituye un comportamiento típico de especies de hábitat boscoso35,36,37,38,39, coincidiendo con el comportamiento de Lu. intermedia y Lu. whitmani, especies típicas en selvas ecuatorianas40-41. Adicionalmente, nuestros resultados concuerdan con el criterio de Porter y De Foliart34 quienes describen a N. yuilli¸ como una especie característica de zonas boscosas, y con Young42, quien afirma que es una especie exclusiva de bosques en diferentes países de Suramérica. Sin embargo, como se observa en los resultados de este estudio y según López, et al.43 y Alexander, et al.44, esta especie también está relacionada a ambientes modificados por el hombre, encontrándose en el intra y peridomicilio, lo cual confirma su adaptación a lugares donde la intervención humana está presente.
Con respecto a N. trapidoi, reportes para Colombia en un bosque seco tropical en el departamento de Antioquia34, describen una actividad desde las 6:00 horas, con un primer aumento a las 21:00-22:00 horas, y un segundo aumento a las 24:00-1:00 horas, manteniendo una actividad sin variaciones marcadas, comportamiento que se mantiene hasta las 3:00-4:00 horas donde la actividad empieza a decaer. En la vertiente del pacifico de los Andes en Ecuador, el comportamiento de esta especie difiere al de la población Colombiana, la cual exhibe un primer aumento de actividad a las 8:00-9:00 horas y un segundo con menor número de colectas a las 3:00-4:00 horas, a partir de la cual, el número de colectas empieza a disminuir12. El comportamiento de N. trapidoi en el área de estudio es similar con la población Colombiana y difiera en gran medida con la población en Ecuador, presentando una actividad que aumenta a medida que transcurre la noche con un máximo entre las 22:00-02:00 horas sin presentar cambios drásticos en la actividad, y con una disminución en la actividad a las 3:00-4:00 horas. Lo anterior evidencia que la actividad de esta especie no está limitada a una hora u horas específicas de la noche, comportamiento característico de una especie altamente antropofílica,12,20,34 típica de flebótomos que están asociados a la presencia y actividad de los seres humanos, lo que sugiere una adaptación de esta especie a la conducta humana45.
En cuanto a la relación de la actividad nocturna con factores ambientales, estudios demuestran que las condiciones climáticas afectan la abundancia y presencia de los flebótomos adultos46,47,48,49,50, a pesar de esto, nuestros análisis describen que no existe una correlación positiva entre la actividad nocturna de N. yuilli y N. trapidoi con la temperatura y humedad, resultado que se asemeja a los expuestos por Porter y De Foliart34 y Hashiguchi12, donde la actividad de picadura de estas especies no tiene una relación con estos dos factores ambientales. De este modo, la baja pluviosidad registrada durante las capturas puede estar influyendo en el resultado, ya que en épocas lluvias, determinar una relación de la actividad de los flebótomos con la temperatura y la humedad es más difícil, pues a finales y después de estas, el número de capturas es mayor que durante la misma50, como lo demuestran estudios sobre Lu. evansi donde la mayor abundancia poblacional fue registrada después de los meses de mayor precipitación23,51,52,53. Otros factores que pueden estar incidiendo sobre la actividad de las dos especies son la velocidad del viento, el sexo de cada individuo, las diferencias en edades en la población y la atracción a la luz artificial de trampas y de las viviendas12,54,55,56,57,58,59. Este último, teniendo quizás una mayor incidencia, por lo que el alto número de capturas con relación a las demás especies, puede deberse a un fototropismo positivo hacia la luz artificial de las trampas CDC y por la cercanía de las viviendas a los bosques.56,58,60
Al ser las hembras las únicas hematófagas al picar a humanos y animales, son las responsables de la transmisión del agente etiológico61, por lo tanto, el alto número de hembras capturadas en comparación a los machos, puede tener una relación sobre la prevalencia de este enfermedad en la zona62, y más aún, si se tiene en cuenta que el número más alto de hembras capturado fue en el intradomicilio de las viviendas, situación documentada en varios estudios, donde los casos de leishmaniasis cutánea son frecuentes por el simple hecho de habitar cerca a los bosques63,64,65,66, lo que permite que la enfermedad se propague en ciclos extraforestales y aumente la prevalencia de esta en la zona67,68,69.
Por último, la actividad nocturna de N. yuilli y N. trapidoi reportadas por Porter y De Foliart34, muestran que cada especie tiende a tener una pronunciada variación de una noche a otra, por lo que su actividad nocturna es muy fluctuante, incluso con patrones ambientales estables el comportamiento puede cambiar considerablemente, de manera que se hace necesario seguir estudiando los horarios de actividad de las especies de flebótomos para la zona teniendo en cuenta otras variables ambientales a las aquí estudiadas, abarcando diferentes épocas del año (época seca y época lluvia), e incluyendo áreas de bosque a parte del intra y peridomicilio.














